作者简介:魏瑞成(1979-),男,河南商丘人,博士。E-mail:rcwei79@jaas.ac.cn
通过水培试验,研究了不同浓度17β-雌二醇(17β-E2)胁迫对萝卜种子萌芽、幼苗生长和抗氧化酶系统活性的影响,以及17β-E2在幼苗体内的积累。结果发现,萝卜种子的发芽势、发芽率和根长与17β-E2处理浓度呈负相关,在10 μg/L浓度时17β-E2刺激萝卜种子的发芽势和根长明显增加,诱导幼苗体内抗氧化酶SOD、POD和CAT活性显著上升;但在50 μg/L浓度的17β-E2胁迫下,SOD、CAT和POD活性受到明显抑制,MDA含量显著升高,幼苗抗氧化能力显著降低,膜质过氧化程度加剧;受17β-E2污染,萝卜幼苗体内17β-E2积累量随着处理浓度的升高而增加,其在根部累积量要大于地上部分,在转运过程中发生17β-E2代谢,产生具有低雌激素活性的雌酮。萝卜对17β-E2胁迫具有一定的抗性,在17β-E2污染土壤中种植萝卜存在潜在的食用安全风险。
The effects of different concentrations of 17β-estradiol (17β-E2) on seed germination, seedling growth, antioxidant enzyme system and 17β-E2 accumulation in radish ( Raphanus sativus) were investigated using water culture method. The results indicated that the germinating potentiality, germination rate and root elongation of radish presented the inverse correlation with 17β-E2 treatment. The germinating potentiality and root elongation of radish were obviously increased and activities of SOD, POD and CAT of radish were significantly enhanced by 17β-E2 at levels of 10 μg/L. The 50 μg/L 17β-E2 treatment inhibited the activities of SOD, POD and CAT and significantly stimulated an increase in the content of MDA. It made seedling oxidation resistance significantly decrease and finally resulted in aggravate of the lipid peroxidation. With rising treatment concentration, the content of 17β-E2 accumulated in seedlings was increased. The content of 17β-E2 in the root was larger than that in aerial part. In the transportation process, 17β-E2 was partly metabolized into the low active estrone in radish. The experiments revealed that radish showed a certain tolerance to 17β-E2 stress, so there was a potential food risk posed to mankind health for radish growing in estrogen-contaminated soils.
环境雌激素, 对野生动物和人体健康具有巨大的潜在危害, 已经愈来愈受到全世界的关注[1, 2]。在诸多天然的雌性荷尔蒙物质中, 雌二醇被认为是最具潜在影响的一种, 即使是很低的浓度也会产生严重影响[3, 4]。污水处理厂出水和畜禽养殖场排泄物是天然雌激素的两大污染源, 前者最先引起了人们的关注和研究, 但是近期研究发现, 集约化养殖场对环境雌激素的贡献很大, 主要源于畜禽动物正常的生理分泌排泄以及饲料中促生长素的添加, 在欧洲养殖废弃物中发现雌二醇含量高达14904 μ g/kg干重, 新西兰奶牛场污水中雌二醇水平为191 360 ng/L, 代谢物雌酮的水平为413 123 ng/L, 养猪场污水中的雌激素含量为46 ng/L, 使用肉鸡粪便的土壤中雌激素浓度有55675 ng/kg[5], 而施用猪粪3个月后雌激素从植物根区的渗滤使农田排水系统中E1浓度可以达到68.1 ng/L[6], 雌激素通过畜禽粪便农用的方式进入到土壤、水体中, 对环境构成潜在威胁[7, 8], 也造成农产品的污染。雌激素在110 ng/L浓度即具有很强的生理功能, 河水中含量仅为1 ng/L时就会造成雄鱼的雌性化, 人类长期食用含有激素的肉制食品或其他农产品, 即使含量甚微, 但由于其作用极强, 亦会影响机体的激素平衡, 从而形成长期潜在的危害。有研究表明, 雌激素对人类的直接危害是干扰内分泌生殖系统的正常功能, 促使婴儿性早熟和造成男性生育能力的下降甚至丧失[7, 9, 10]。
萝卜(Raphanus sativus)作为我国主要蔬菜之一, 在蔬菜的周年均衡供应上占有重要地位。雌激素随粪污进入土壤, 与植物根细胞壁中交换位点相互作用, 能吸附雌激素或将其进一步向地上部分转移, 因此粪污中的雌激素将在根部积累, 通过萝卜的食用进入人体, 对人体健康造成潜在的危害。目前, 有关雌激素污染对萝卜生长影响少有报道。本研究以萝卜为试验材料, 采用水培法研究了不同浓度17β -雌二醇(17β -E2)胁迫对萝卜种子萌芽、幼苗生长和SOD、POD、CAT活性、MDA含量的影响, 以及17β -E2在幼苗体内的积累和代谢物雌酮的生成(图1), 旨在探讨雌激素对非靶标植物生态毒性和残留特征, 以期为揭示植物适应和抵御雌激素污染物的损伤机制以及蔬菜的安全生产和健康风险评价提供依据。
材料:17β -雌二醇(17β -E2)标准品购自Dr. Ehrenstorfer, 其标准液用甲醇溶解; 甲醇、乙腈和乙酸铵为色谱纯, ROE SCIENTIFIC INC(Newark, USA); 超氧化物歧化酶(superoxide dismutase, SOD)、过氧化物酶(peroxidase, POD)、过氧化氢酶(catalase, CAT)、丙二醛(malondiadehyde, MDA)和蛋白质含量测定试剂盒购自南京建成生物技术公司; 聚乙烯吡咯烷酮(PVPK30)购自德国 BASF公司; 水为超纯水。
仪器:人工气候箱(GXZ, 宁波江南仪器厂); H-1850高速冷冻离心机(湖南湘仪实验室仪器开发有限公司); 紫外-可见分光光度计(Perkin Eimer Instruments); 数显恒温水浴锅HH-6(国华电器有限公司); 漩涡混合器(上海琪特分析仪器有限公司); 固相萃取柱(Agilent C18柱, 500 mg); 超声振荡仪; 氮吹仪(NEVAPTM112); 配备DAD 检测器的Agilent 1200S 高效液相色谱仪和ESI 源的Agilent 6410 三重四极管质谱仪等。
供试蔬菜为萝卜。2012年3月将萝卜种子用0.3%双氧水消毒后蒸馏水洗净, 挑选均一、饱满的种子置于铺3层滤纸的培养皿(直径9 cm)中, 每皿150粒, 每个浓度设3个重复, 放置种子时, 保持种子胚根末端和生长方向呈直线。17β -雌二醇(17β -E2)处理浓度为10, 50和100 μ g/L, 将配制的溶液均匀的加入到培养皿中, 每皿5 mL, 以0.1%甲醇作为对照(CK), 将上述处理置于人工气候箱[温度(25± 1)℃, 相对湿度(75± 5)%, 光期12 h/d, 光强3000 Lux]中。每日更换相应的溶液以保持滤纸湿润。试验第8天时收获幼苗, 用于各项指标的测定。
1.3.1 发芽和生长指标的测定 分别在试验第3天和第7天统计种子发芽数, 计算发芽势和发芽率:发芽势(GE, %)=前3 d发芽种子粒数/供试种子总数× 100; 发芽率(GP, %)=前7 d发芽种子粒数/供试种子数× 100。根长的测定:每个重复随机取5株, 用精确度为0.1 mm的游标卡尺测量幼苗的主根长度, 计算平均值。
1.3.2 抗氧化酶活性和MDA含量的测定 试验第8天时取萝卜幼苗地上部分0.6 g, 加入6 mL预冷的0.05 mol/L pH 7.8磷酸缓冲液(含1% PVPK30), 在冰浴上研磨成浆, 匀浆液倒入离心管中, 在4℃下5 000 r/min离心10 min, 上清液即为酶提取液, 置于4℃ 保存待用[11, 12]。
蛋白质含量的测定采用考马斯亮蓝G-250法, 测定595 nm下OD 值。超氧化物歧化酶(SOD)采用黄嘌呤氧化酶法测定, 活性的测定以37℃条件下每mL反应液中SOD抑制率达50%时所对应的SOD量为1个SOD活力单位(U), 测定550 nm 下OD值。过氧化物酶(POD)活性的测定以37℃条件下每mg组织蛋白每min内A420催化产生1 μ g底物的酶量为1个酶活力单位。过氧化氢酶(CAT)的测定采用钼酸铵法, 以每mg组织蛋白每s内A405分解1 μ mol的H2O2的量为1个活性单位(U)。丙二醛(MDA)采用硫代巴比妥酸法测定。
1.3.3 幼苗体内17β -雌二醇(17β -E2)残留量的分析 取待测幼苗用蒸馏水冲洗除去附在表面的17β -雌二醇(17β -E2), 然后用滤纸吸干表面水分, 研磨后备用。样品处理参照Fiers等[13]方法并加以改进[14, 15]。准确称取0.20.5 g 研磨样品至10 mL聚丙烯具塞离心管, 加1 mL乙腈, 超声10 min后在4℃下10 000 r/min离心10 min, 取上清液, 45℃水浴中氮气吹近干, 加入1 mL 10%甲醇超声溶解后过C18 SPE柱。将Agilent C18柱分别用6 mL乙腈和6 mL水活化, 将上述样品全部加入小柱中, 用6 mL 10%甲醇淋洗, 然后用6 mL乙腈洗脱, 样品装载和洗脱过程控制流速0.5 mL/min。洗脱后的样品在45℃水浴氮气吹近干, 加入200 μ L乙腈溶解, 溶液过0.22 μ m滤膜后供LC-MS测定。
试验数据用SPASS 16.0和Excel 2003进行统计分析和作图。
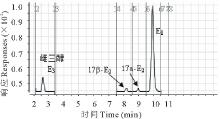
17β -雌二醇(17β -E2)和其代谢物雌酮(E1)的分离对分析是相当重要的。本试验比较了0.1%甲酸水-甲醇和10 mmol/L乙酸铵-乙腈作为流动相、C8与C18为分离柱对目标组分分离的影响, 经过优化, 采用C18色谱柱和10 mmol/L乙酸铵-乙腈在0.30 mL/min的流速下实现了雌激素以及杂质峰的分离(图2)。质谱参数获得采用1 mg/L的17β -E2和E1标准液以流动注射的方式在ESI(-)模式下进行母离子全扫描, 确定17β -E2和E1分子离子, 然后分别以分子离子为母离子, 对其子离子进行全扫描, 选取丰度较强, 干扰较小的离子为定性离子, 最后以多反应检测(MRM)确定碰撞能量和碎裂电压, 优化的质谱条件见表1。萝卜植株根和地上部分的17β -E2和E1回收率分别在70%85%和78%91%, 相对标准偏差均小于10%, 最低检出限分别为10和1 μ g/kg, 能够满足本试验的检测需求。
| 表1 17β -雌二醇和雌酮的MRM监测质谱条件 Table 1 MS/MS multiple reaction monitoring (MRM) analysis conditions of 17β -E2 and E1 |
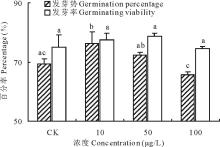
2.2.1 不同浓度17β -雌二醇对萝卜的发芽势和发芽率的影响 萝卜种子的发芽势受到加入17β -E2的影响(图3), 低浓度刺激有促进种子发芽的趋势, 以10 μ g/L 处理组效果最为显著, 10和50 μ g/L 17β -E2处理组的发芽势比对照组分别上升了9.76%和4.16%, 而100 μ g/L 17β -E2处理组对萝卜的发芽势有抑制作用, 使其比对照组下降了5.28%。虽然雌激素的3个浓度处理组中种子的发芽率与对照组之间不存在显著差异, 但从数据看低浓度组刺激有促使发芽率升高的能力, 比对照组分别升高了3.25%和4.73%; 高浓度组刺激可以降低种子的发芽趋势, 比对照组下降了0.89%。上述结果可能与雌激素透过种皮影响种子萌发相关的酶有关, 这种影响存在一个较低浓度下刺激效应和高浓度下的抑制效应[11, 16, 17]。
 | 图3 不同浓度17β -雌二醇对萝卜发芽的影响Fig.3 Effects of different concentrations of 17β -E2 on the germination of radish |
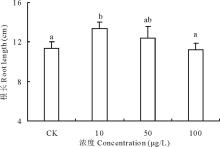
2.2.2 不同浓度17β -雌二醇对萝卜根长的影响 17β -E2对萝卜根长的影响趋势与发芽势相同(图4), 10和50 μ g/L 17β -E2处理组促进了根长的生长, 比对照组长了17.31%和8.86%, 10 μ g/L 处理组与对照组相比具显著性差异; 而17β -E2浓度为100 μ g/L处理组的根长比对照组减少了1.53%, 其下降程度同10 μ g/L 处理组比较有显著性差异。说明在低浓度(010 μ g/L)范围内17β -E2对萝卜幼苗根长的生长具有促进作用, 而在高浓度(50100 μ g/L)范围内17β -E2抑制了萝卜幼苗根长的生长, 根长的发育与加入的污染物17β -E2浓度呈负相关。
2.3.1 不同浓度17β -雌二醇对萝卜SOD影响 超氧化物歧化酶(superoxide dismutase, SOD)是1969年由Mccord 和Fridovich发现, 催化超氧化物自由基
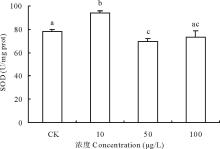 | 图5 不同浓度17β -雌二醇对萝卜幼苗SOD活性的影响Fig.5 Effects of different concentrations of 17β -E2 on the SOD activity in radish |
2.3.2 不同浓度17β -雌二醇对萝卜CAT影响 过氧化氢酶(catalase, CAT)是以铁卟啉为辅基、催化过氧化氢(H2O2)分解为分子氧和水的重要酶, 与SOD、POD等协同作用, 使细胞免于遭受H2O2的毒害。10和50 μ g/L 浓度的17β -E2使萝卜CAT的活性分别比对照下降了5.84%和13.78%, 其中50 μ g/L 浓度处理组与对照差异显著; 100 μ g/L 浓度的17β -E2使萝卜CAT活性比对照上升1.85%, 但与对照差异不显著(图6)。一方面可能是由于萝卜在50 μ g/L 浓度的17β -E2胁迫下, 抑制了SOD的产生, 致使H2O2生成减少, 而CAT专一作用于H2O2, 但反应的米氏常数(Km)较大, 只能在H2O2浓度或酶活性较高时发挥作用[18], 而本试验中H2O2生成减少, 使得CAT活性降低; 另一方面可能是因为植物体吸收的17β -E2直接对CAT的生成产生抑制, 具体机制需要进一步探讨。
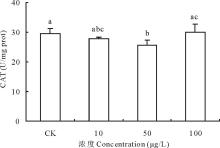 | 图6 不同浓度17β -雌二醇对萝卜幼苗CAT活性的影响Fig.6 Effects of different concentrations of 17β -E2 on the CAT activity in radish |
2.3.3 不同浓度17β -雌二醇对萝卜POD影响 过氧化物酶(peroxidase, POD)是一族以过氧化氢(H2O2)为电子受体催化底物氧化的酶, 铁卟啉为辅基, 具有消除过氧化氢毒性的作用, 与植物的生长、发育、病性、衰老等有密切关系。萝卜POD活性受到加入17β -E2影响, 10 μ g/L处理组明显促进萝卜POD活性上升, 比对照组升高了32.87%, 而50和100 μ g/L浓度处理组的POD活性受到抑制, 活性分别下降了15.50%和5.64%, 其中以50 μ g/L浓度处理最为明显, 与对照差异显著(图7)。17β -E2对萝卜中POD的影响趋势与SOD基本相同, 主要协助SOD清除由SOD催化自由基
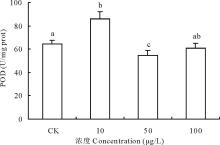 | 图7 不同浓度17β -雌二醇对萝卜幼苗POD活性的影响Fig.7 Effects of different concentrations of 17β -E2 on the POD activity in radish |
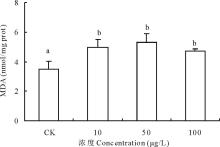
2.3.4 不同浓度17β -雌二醇对萝卜MDA影响 丙二醛(malondialdehyde, MDA)是自由基作用于膜脂发生过氧化反应的产物, MDA的积累会引起蛋白质、核酸等生命大分子的交联聚合, 且具有细胞毒性。随着17β -E2处理浓度升高, MDA含量逐渐增加, 10, 50和100 μ g/L浓度处理的萝卜中MDA含量比对照升高了42.41%、52.65%和35.22%, 尤其以50 μ g/L浓度处理组的萝卜膜质过氧化程度严重, 3个处理组试验结果与对照组差异显著(图8)。
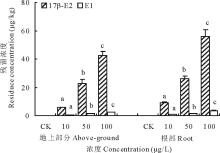
17β -E2处理浓度在10100 μ g/L时, 随着浓度的升高, 单位重量的地上部分和根中累积的雌激素的量相应增加, 各组间差异显著, 同组内根部吸收的17β -E2比地上部分累积的量高1.11.7倍(图9)。检测发现, 17β -E2处理的幼苗除了有17β -E2残留, 还在地上部分和根部检测到代谢物雌酮(E1)的生成, 说明17β -E2可以随着萝卜的生长被机体吸收, 而吸收的17β -E2在机体某种机制下可发生代谢转化为E1。
不同浓度的雌激素处理对萝卜种子萌发的影响程度不同。低浓度处理时, 对萝卜种子萌发有促进作用, 但随着17β -E2处理浓度的升高, 种子发芽势和发芽率均表现出逐渐降低的趋势, 而对发芽势的影响明显大于发芽率。萝卜根的生长也受到加入17β -E2的影响, 其生长与浓度呈负相关。17β -E2对种子发芽势、发芽率与根长影响的差异可能与种子发育过程有关。通常种子发芽过程与胚内营养成分和各种酶活动有关, 生长环境污染导致的影响只有在环境严重污染时与种子发芽有关的酶才能完全被抑制, 否则存在一个低浓度下刺激效应和高浓度下的抑制效应[11, 16, 17], 本试验结果与此相似。植物在生长和发育过程中, 根是始终暴露于17β -E2等污染的环境, 其对污染物的反应较为敏感[18, 19, 20, 21], 主要因为根是植物同周围环境交换和吸收营养物质的场所, 根细胞壁中交换位点能将17β -E2等污染物固定在这些位点上, 阻止或减少污染物进一步向地上部分转移[22, 23, 24], 试验中发现17β -E2在萝卜根部吸收的量要高于地上部分累积的量, 积累的雌激素使得其对根的抑制作用较为明显, 本研究也发现雌激素对萝卜幼苗根的抑制要大于对种子萌发的影响。17β -E2被萝卜吸收后在体内因素参与下发生了代谢, 随着萝卜幼苗生长期延长, 17β -E2是否会继续积累以及物质代谢发生的程度, 还需要进一步研究和探讨。
植物在正常代谢中会产生
综上所述, 从萝卜种子的发芽势、发芽率、根长、抗氧化酶活性及MDA含量来看, 在17β -E2胁迫下, 萝卜的种子萌发和幼苗生长会受到影响, 植物从周围环境吸收养分的能力也导致17β -E2在根部和地上部分的累积并伴随代谢活动的发生, 从而可能造成农产品潜在的食用安全风险, 对于17β -E2在非靶标植物的运转机制和作用机理还需要进一步的探讨和研究。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|