作者简介:樊文娜(1981-),女,河南许昌人,在读博士。E-mail:chou0516@163.com
本试验研究了不同光周期对3种秋眠型苜蓿光敏色素和植物体内源激素含量的影响,为揭示苜蓿秋眠性的调控机理提供科学依据。试验采用FQ-PCR SYBR-Green I方法,在人工气候室,以美国苜蓿秋眠级标准对照品种 Norseman(FD1, 秋眠型苜蓿,秋眠1级)、Dupuils(FD5,半秋眠型苜蓿,秋眠5级)和CUF101(FD9,非秋眠型苜蓿,秋眠9级)为材料, 设计4个不同的日照长度梯度(7,10,13和16 h/d),对其植株处理35 d,测定叶片中光敏色素(
To explore the effects of photoperiod on phytochromes and endogenous hormones of different fall-dormancy alfalfas (
苜蓿( Medicago sativa)为长日照植物,秋冬短日照下休眠,说明苜蓿秋眠(fall dormancy,FD)存在着光周期效应[ 1, 2, 3]。不同苜蓿品种对低温和短日照的反应有差异,据此可将其分为秋眠型(fall dormancy,1~3级)、半秋眠型(semi-fall dormancy,4~6级)和非秋眠型(non-fall dormancy,7~9级) 3种类型[ 4]。秋眠型苜蓿夏末和早秋即进入休眠,停止生长时间早,秋季产量低;非秋眠型苜蓿秋季休眠晚,只要温度等条件适宜,仍可继续旺盛生长,有较高的秋季产量;半秋眠型苜蓿正好介于二者之间[ 5, 6]。
据研究,植物感受和测量日照长短是通过叶片中的光受体完成的。在植物的光形态建成中,光敏色素是主要的光受体。对拟南芥( Arabidopsis thaliana)等植物的研究表明,双子叶植物中至少存在5种不同的光敏色素基因,即 PHYA、 PHYB、 PHYC、 PHYD和 PHYE[ 7],光敏色素A(phytochrome A, PHYA)和光敏色素B(phytochrome B, PHYB)是主要的光敏色素,在植物的生长发育中有重要作用[ 8],植物的种子萌发、生长、开花和休眠等生长发育过程与其密切相关[ 9, 10]。研究发现,植物的光受体信号基因往往是通过其内源激素传递给靶基因从而调控其生长发育的[ 10, 11]。既然光周期是影响苜蓿秋眠性的主要环境因子,秋季日照长度的变化就可能通过光受体基因 PHYA、 PHYB的表达和植物激素的合成调控其休眠,因此研究不同秋眠型苜蓿 PHYA、 PHYB的表达量和植物激素含量能在很大程度上探明其与苜蓿秋眠性的关系。
光敏色素和内源激素在调控苜蓿秋眠性上可能有互作关系, PHYB(或 PHYA)调节脱落酸 (abscisic acid,ABA)、赤霉素3(gibberellin,GA)等植物内源激素的生成、转化和代谢以及植物对ABA、GA3等的敏感程度,进而影响植物的生长发育。GA3与ABA是2个对植物生理作用相反的激素,ABA能促进秋眠,GA3有解除秋眠的作用,喷洒外源ABA能促进内源ABA的累积,有利于苜蓿的秋眠[ 11]。由于ABA能诱导抗寒等逆境基因的表达,因此在短日照处理下ABA水平增加,可能会加强苜蓿秋眠基因的诱导与表达,从而调控和促进秋眠。内源激素可能是调节秋眠性的化学信使, GA3/ABA、生长素 (indole acetic acid,IAA)/ABA和玉米素核苷(zeatinR, ZR)/ABA的变化可反映促进生长的激素和抑制生长的激素之间的相对平衡状态, PHYB作为绿色植物主要光受体可能通过光周期调控激素合成和其平衡进而调控或参与了苜蓿的秋眠[ 11, 12, 13, 14],因此, PHYA、 PHYB以及植物激素之间的关系用以研究苜蓿秋眠性机理有重要意义。
本研究的目的在于探讨不同光周期条件下不同秋眠型苜蓿 PHYA、 PHYB mRNA的表达量,揭示日照长度与不同秋眠型苜蓿光受体基因表达之间的关系;测定内源激素含量与光受体基因表达之间有无互作关系。从而为揭示苜蓿秋眠性的调控机理提供科学依据。
选取苜蓿秋眠性标准对照品种Norseman(FD1)、Dupuils(FD5)和CUF101(FD9),于2009年9月20日种植于河南农业大学科教园区牧草试验地,2010年8月20日选择生长健壮、均匀一致的苜蓿植株移植于花盆(24 cm×24 cm)中,待其成活后转入人工气候室。实验设 7 h/d、10 h/d(SD,短,short day)、13 h/d(MD,中,middle day)和16 h/d(LD,长,long day)光照处理,每个处理重复6次,定时定量浇水。温度设置为:光照20℃/黑暗10℃,处理35 d。随机摘取各株顶芽及上部叶片,无菌锡箔纸包裹,立即由液氮固定,并转移至-80℃冰箱保存待用。为接近自然光质的能量和辐射强度,采用全光谱灯和LED灯,光照设备由南京农业大学李志刚老师设计并提供( 图1)。
引物参考本实验室提供的 PHYA、 PHYB基因全长[ 15, 16, 17]设计,通过荧光定量PCR(polymerase chain reaction,聚合酶链式反应)测定其mRNA表达量。 PHYA-s:5'-GAGAGATAGCTTTATGGATGTCTGAGT-3'(27 bp), PHYA-a:5'GCGACCTAAACCAG- AAAACTATG T-3'(24 bp), PHYA的扩增片段长度为168 bp; PHYB-s:5'-GTAGAGGACGCTATGGGGAAGT-3'(22 bp), PHYB-a: 5'-TGGAGCAAGCATTCACCACTAT-3'(22 bp), PHYB的扩增片段长度为146 bp。
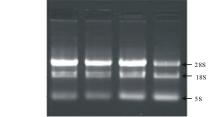
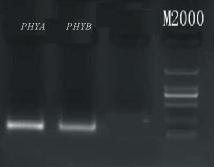
将紫花苜蓿叶片迅速转移至用液氮预冷的研钵中研磨至粉状,按照RNA提取试剂(Takara,RNAiso Plus)上的操作说明提取总RNA。用2%琼脂糖凝胶电泳检测提取RNA的完整性,结果如 图2所示。从图中可以看到RNA 28S和18S的条带清晰,28S为18S的2倍,RNA完整性良好。取总RNA 2 μL在微量核酸检测仪上检测质量,OD260/280值均在1.8~2.0之间,RNA质量好,纯度高。对cDNA进行PCR扩增,均得到168和146 bp大小的产物(如 图3)。
提取苜蓿中总RNA,以此为模板进行逆转录PCR扩增,扩增产物用1%琼脂糖凝胶电泳鉴定。对目的片段进行切胶、纯化回收,将2个基因分别与载体pMD19-T连接,转化TG1感受态细胞,蓝白菌落进行初步筛选,随机挑取白色菌落进行菌液培养,然后将含pGM-T- PHYA、 PHYB质粒的菌液送宝生物工程(大连)有限公司进行测序、鉴定。通过测序分析,其结果与设计引物所用模板序列完全一致,NCBI中比对分析的结果与紫花苜蓿品种WL-525HQ的 PHYA、紫花苜蓿品种 Vernal 的 PHYB基因序列一致,说明由引物得到的 PHYA、 PHYB的RT-PCR产物与目的基因相符。
提取 PHYA、 PHYB的重组质粒作为标准品。质粒制备后,用紫外分光光度计对质粒模板进行定量并梯度稀释成1011, 1010, 109,108,107,106,105,104拷贝/μL,作为阳性定量标准模板,制备标准曲线。实时荧光定量系统对收获的 PHYA和 PHYB的cDNA的拷贝数进行精确定量,并根据测定结果,计算出光敏色素在不同光周期条件下的标准曲线[ 18, 19, 20, 21]。根据公式和重组质粒的分子量计算出标准品核酸的摩尔浓度,然后依据阿伏伽德罗常数6.02×1023换算成该质粒核酸每微升拷贝数(copy/μL)。 PHYA的质粒拷贝数为4.08×1010 拷贝/μL; PHYB的质粒拷贝数为5.11×1010 拷贝/μL。 PHYA的标准曲线为 yA=-3.43 x+45 .85,相关系数为0.999; PHYB的标准曲线为 yB=-3.26 x+46 .90,相关系数为0.998。
在每份样品中检测 PHYA、 PHYB的CT值(PCR反应每个反应管内的荧光信号达到设定的域值时所经历的循环数),并进行3次PCR重复,取3次PCR CT值的平均值,根据标准曲线计算定量结果,计算校正值。
光周期实验中,反转录反应液的配制及其反应条件如下:25 mmol/L硫酸镁2 μL,缓冲液5 μL, 无酶水0.75 μL, DNA聚合酶的底物(10 mmol/L) 0.5 μL, RNA酶抑制剂RNase Inhibitor(40 U/μL) 0.25 μL, 反转录酶(22 U/μL) 0.5 μL, 随机引物 0.5 μL, 阳性对照 RNA 0.5 μL, 共10 μL。 反应体系SYBR Premix Ex TaqTM(2×)10.0 μL, PCR 上游引物(10 μmol/L) 0.4 μL, PCR下游引物(10 μmol/L)0.4 μL, 荧光染料(50×) 0.4 μL, DNA模板2.0 μL, 无酶水6.8 μL, 共20 μL 反应体系。反应参数为95℃30 s预变性,95℃ 5 s,60℃ 30 s,共40个循环。扩增完毕后,进行熔解曲线分析,94℃ 1 min,60℃ 1 min,以0.10℃/s的速度升温到92℃,连续监测荧光。
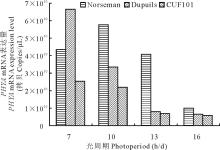
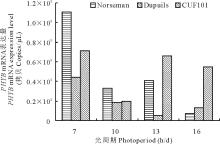
在同时间内随机摘取各处理每株顶芽及上部叶片1 g左右,无菌锡箔纸包裹,立即由液氮固定,并转移至-80℃冰箱保存待用。激素的测定采用间接酶联免疫吸附法(enzyme-linked immunosorbent assays,简称ELISA),ELISA试剂盒由中国农业大学作物化学控制中心提供。酶标仪的型号为Thermo Multiskan MK3。每个样品测定3次重复,取其平均值进行分析。2 结果与分析由 图4, 图5可知,随着光照时间的增长,3种秋眠类型苜蓿品种叶片中的 PHYA、 PHYB mRNA表达量均成下降态势。3种不同秋眠类型比较, PHYA表达量均随着苜蓿秋眠性的下降依次降低(7 h/d除外);秋眠型苜蓿和非秋眠型苜蓿 PHYB mRNA表达量在不同光周期条件下,也有随着苜蓿秋眠性的下降而依次降低的趋势,但半秋眠型苜蓿这种规律性不明显。
由 表1可知,随着光照时间的延长,3种秋眠类型苜蓿的 GA3含量基本上均呈上升趋势,其中Norseman变化趋势最为明显,各处理之间差异都极显著;同一个光照时间不同秋眠类型GA3含量之间无规律性,但Norseman GA3含量高于Dupuils和CUF101。
ABA含量的变化趋势正好与GA3相反,随着光照时间的延长,无论是秋眠型苜蓿Norseman、半秋眠型苜蓿Dupuils,还是非秋眠型苜蓿CUF101,均呈依次下降的趋势,且不同光照处理间差异均极显著,其中尤以Norseman ABA的含量变幅最大。同一个光照时间不同秋眠类型ABA含量比较,无论哪一个日照长度,均呈现出Norseman>Dupuils>CUF101,且差异显著。
3种秋眠类型苜蓿的ZR含量并无规律性,但以Dupuils的最高。对IAA的含量来说,每一个秋眠类型品种都有随着光照时间的延长而提高的趋势(个别时间除外),且差异显著;除7 h/d的光照处理外,其余光照时间处理均 Norseman<Dupuils<CUF101,大部分都达到了差异极显著程度。
| 表1 光周期对不同秋眠型紫花苜蓿内源激素含量的影响 Table 1 Photoperiod effect on endogenous hormones of alfalfa with different fall-dormancy |
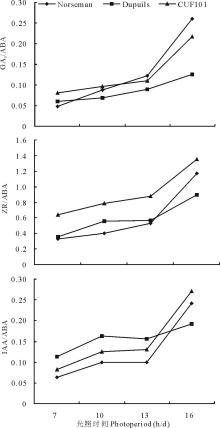
由 图6可知,随着光照时间的递增,GA3/ABA、ZR/ABA和IAA/ABA都有依次上升趋势。各光照处理下,3个比值的峰值都在16 h/d,且变化趋势明显。
秋眠是一种特殊的休眠方式,即内生性休眠。目前,休眠在生理方面得到广泛的研究[ 22, 23, 24],苜蓿基因克隆和功能组学的研究日渐深入[ 25, 26, 27, 28],但苜蓿休眠的调控机理研究仍有很多空白。
大量研究表明,植物的休眠受光周期的诱导和调节。短日照诱导植物的休眠在杨树( Populus tomentosa)、葡萄( Vitis vinifera)、狗木( Cornus sericea)等树木中得到了证实[ 29, 30, 31, 32],其中 PHYA和 PHYB的表达在光信号通路中发挥着重要作用,拟南芥中96%光诱导的基因是通过 PHYA和 PHYB来调节的[ 33, 34],短日照条件下, PHYA的超表达抑制休眠诱导,通过改变日照长度能改变其休眠反应[ 30, 32] 。Kuhn等[ 34]的试验证明,光周期调控了葡萄叶中 PHYA和 PHYB mRNA 表达量,在转录水平调控了葡萄的休眠, PHYA和 PHYB含量在正常生长季节不稳定,一旦被转移至短日照诱导休眠的条件下,不稳定的表达现象都停止,取而代之的是表达量均增加[ 34, 35]。王成章等[ 10] 通过研究不同光周期对苜蓿秋眠性的影响结果表明,秋眠型苜蓿短日照条件下 PHYB的蛋白表达量最高,推测其含量多寡程度不同调控了光周期反应,进而诱导了休眠。本实验结果显示,3个不同秋眠类型苜蓿品种基本都是在短日照条件下叶片中的 PHYA和 PHYB mRNA 表达量高,秋眠特征明显,可能的原因是:苜蓿为长日照植物,短日照为苜蓿生长创造了较强的逆境效应,苜蓿为应对这种不良的环境刺激,通过加速 PHYA和 PHYB合成,诱导苜蓿进入秋眠。尤其短日照条件下1级品种Norseman即秋眠型苜蓿品种 PHYB表现最为明显,合成量也最大,随着光周期的延长, PHYB的含量直线下降,秋眠型苜蓿 PHYB mRNA合成量明显高于半秋眠型、非秋眠型苜蓿,显示了 PHYA和 PHYB可能在苜蓿秋眠性中发挥了重要作用。
在植物的自然休眠中,内源激素是一个十分重要的影响因子,多数研究认为,内源激素参与了休眠的诱导、维持与终止。GA3与ABA在休眠中的作用相反,ABA能促进休眠,GA3有解除休眠的作用,但GA3能促进ZR、IAA的生物合成,且ABA的作用只有在其他内源激素的密切配合下才能表现出来[ 36]。休眠不仅与植物内源激素的绝对含量有关,还与各类激素之间的平衡,特别是促进生长的激素与抑制生长的激素之间的比例及平衡有关[ 37]。本试验测定了IAA、ABA、ZR、GA3的含量,结果表明,7 h/d光照时间GA3/ABA、ZR/ABA和IAA/ABA均为最低,可能是短日照条件下苜蓿的生长被抑制和休眠较强的原因;随着光照时间的延长,GA3/ABA、ZR/ABA和IAA/ABA依次增大,其中3种秋眠类型苜蓿3种激素比值均以16 h/d最高,可能是长日照条件下苜蓿休眠被解除、生长被促进的原因。
植物的光形态建成中,在接受光周期信号后,光受体基因通过改变植物内源激素的含量进而调控靶基因发挥作用[ 38, 39, 40, 41, 42, 43, 44],ABA、GA3和IAA被包含在光形态建成中。Mazzella等[ 45]、Seo等[ 46]证明 PHYB直接或间接调控了ABA合成,进而影响拟南芥的休眠;王成章等[ 10]的研究表明,在短日照条件下,苜蓿的秋眠是通过促进 PHYB蛋白的合成进而增加ABA的合成量来实现的,其中秋眠型苜蓿在短日照条件下的 PHYB和ABA的合成量显著高于半秋眠苜蓿和非秋眠苜蓿可能是其秋眠早且强的原因之一。本研究中,短日照条件下苜蓿叶片中 PHYA、 PHYB mRNA表达量和ABA含量显著高于长日照与王成章等[ 10] 不同光周期条件下 PHYB蛋白水平的表达研究结果基本一致,进一步说明在不同光周期条件下,光敏色素和植物内源激素可能参与了苜蓿的光形态建成, PHYA和 PHYB直接或间接调控植物内源激素GA3、ZR、 IAA、ABA的合成,进而调控了苜蓿的秋眠。4 结论在短日照条件下,ABA和 PHYA、 PHYB mRNA的表达量或合成量增加,GA3、ZR、 IAA的合成量下降,可能 PHYA、 PHYB在转录水平直接或间接影响了内源激素GA3、ZR、 IAA、ABA的合成,进而调控了苜蓿的秋眠。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|