作者简介:房娟娟(1988-),女,山西襄汾人,硕士。E-mail:839652226@qq.com。武玉玲(1989-),女,山西洪洞人,本科。E-mail: 32852624@qq.com。刘云(1990-),女,山西平遥人,在读硕士。*共同第一作者These authors contributed equally to this work.
为了筛选基于MS培养基的盐节木种子萌发与幼苗生长的最佳NaCl浓度,及初步探讨NaCl渗透胁迫作用(使用MS盐消除了NaCl的离子毒害作用)促进根生长的机制, 以MS为基本培养基研究了不同浓度的NaCl(0~700 mmol/L)对贮存7年的盐节木种子在三角瓶中萌发及幼苗生长的影响,并用光学显微镜对适宜盐浓度促进盐节木根伸长的初步机制进行了根尖形态与细胞学观察。结果表明, 1)储藏7年的种子仍有活力,对照组的活力指数和萌发率分别为3.36和74.46%,但萌发时间与前人比较有所延迟。2)盐节木种子的萌发具有不同步性,初始萌发天数为6~8 d,萌发可持续到25~30 d。3)基于 MS培养基盐节木种子萌发最佳浓度为100~200 mmol/L,与对照比可使萌发时间提早2 d,且盐害率为负值。4)幼苗生长适宜的NaCl浓度范围为100~300 mmol/L,最佳浓度为200 mmol/L;盐对幼苗表型的影响是MS0和NaCl>300 mmol/L的MS培养基中生长的幼苗在1个月内能促进多数幼苗下胚轴变红,3~4个月后多数幼苗同化枝变红,而附加100~200 mmol/L NaCl的培养基植株大多数呈绿色。5)根尖细胞学观察可知:MS附加100和200 mmol/L NaCl促进根生长的原因是:NaCl促进了根尖分生组织细胞的分裂和伸长区与成熟区细胞的伸长,因而加速了根冠细胞的程序性细胞死亡,表现为根冠细胞脱落加快。本研究为盐节木耐盐机理的继续深入研究打下了一定的基础。
盐节木(Halocnemum strobilaceum)属于藜科(Chenopodiaceae)盐节木属(Halocnemum) 的一种多年生矮小肉汁半灌木, 分布于非洲北部到欧洲的地中海, 直到亚洲西部地区的盐碱地上[1], 在我国主要分布于新疆和甘肃北部地区, 是盐生荒漠群落建群种之一[1, 2], 属于多汁盐柴类半灌木荒漠群落类型[3], 在有些地区能够形成单优群落[4]。盐节木具有很强的耐盐能力, 甚至能够在土壤表面具有5~10 cm厚盐壳的生境中存活[5], 盐节木是秋季牲畜的优良饲料, 具有一定的经济价值。目前, 关于盐节木的研究人们已关注了种子的萌发[1, 6]、盐对幼苗根长的影响[1, 7]、群落特征[8, 9]以及体内植物次生代谢产物类物质如黄酮、 咖啡酸酯及香豆素等的提取和资源开发[10, 11]等方面的研究。最近, 也开始涉及耐盐基因的克隆和表达方面的研究[12]。
关于盐节木种子萌发的研究, 已有Qu等[1]及高瑞如等[6, 7]的文献报道, 他们验证了盐分是限制盐节木种子萌发的因素之一, 光照能提高盐节木的萌发率, 最适萌发温度为25~30℃等。盐节木种子为小粒种子, 前人对盐生植物小粒种子一般采用在沙基中或培养皿水浸滤纸表面萌发[1, 6, 7, 12, 13]的方法, 该方法受温度湿度不稳、需称重法补水、水淹、细菌滋生和沙埋机械阻力[14]等因素的影响; 而且, 单盐NaCl溶液由于Na+毒害作用使得适宜种子萌发和幼苗生长的浓度低于土盐复合盐的浓度[6]。曾幼龄等[15]研究表明, 盐碱地区盐胁迫下植物的萌发生长受抑制与渗透胁迫和离子毒害两种效应有关, 并且盐生植物中起主要抑制作用的是渗透胁迫而不是离子毒害, 本文利用组织培养法, 基于MS培养研究不同浓度NaCl对储存7年之久的盐节木种子萌发和幼苗生长的影响, 主要反映的是NaCl的渗透胁迫作用, 旨在筛选基于MS培养基的最佳NaCl浓度, 研究长期贮存盐节木种子的活力, 为进一步研究NaCl对盐节木渗透胁迫的耐盐机理建立有效的研究方法。该法是在无菌、恒温、恒湿及营养充分的条件下进行的, 不需要补水, 可以克服前人方法的缺点, 经过连续转移继代培养还可以清晰地观察到不同盐浓度对幼苗不同时期的生长发育表型的变化。前人只做过不同盐浓度对盐节木幼苗根长生长的影响[1], 但对促进根生长的根尖形态学和细胞学方面尚未研究。本研究拟进行以下3个方面的研究:1)基于MS培养基, pH=5.8条件下, 盐节木种子萌发、幼苗生长的最佳NaCl浓度的确定; 2)储存7年的盐节木种子活力探究; 3)适宜NaCl浓度促进盐节木幼苗根生长的细胞学探究。
盐节木种子由本单位高瑞如老师于2003年采自新疆古尔班通古特沙漠南缘五家渠市蔡家湖盐节木自然分布的群落中, 种子贮于牛皮纸袋中, 在室温 (20~27℃)下通风处保存3年后转到4℃保存4年。于2010年10月-2011年2月进行种子萌发、幼苗生长实验。2013年补充了幼苗根尖细胞学观察实验。种子千粒重为(0.093± 0.004) g, 长(0.673± 0.069) mm, 宽(0.439± 0.038) mm。
1.2.1 培养基的配制
MS为基本培养基, 实验共设置7个NaCl浓度梯度(100, 200, 300, 400, 500, 600, 700 mmol/L)和1个对照组(0 mmol/L), 每组设置6个重复, 调pH为5.8, 琼脂8 g/L, 蔗糖10 g/L, 将培养基分装于100 mL锥形瓶中, 每瓶40 mL, 共48瓶。
1.2.2 种子的消毒及接种
取适量种子于eppendorf (EP)管中, 在超净工作台内用70%乙醇处理1 min后用0.1%(w/v)升汞消毒8 min, 无菌水冲洗3~4次, 吸去多余水分。用解剖针挑取消毒后的成熟种子, 每次1粒, 接种在培养基上, 每瓶30粒。培养温度25℃左右, 光周期为12 h光照/12 h 黑暗, 相对湿度为50%左右, 光照强度约3000 lx, 每月更换1次新鲜培养基。
1.2.3 盐节木种子萌发指标的计算方法
种子接种后, 1~2 d观察1次, 以胚根露出种皮且胚根长度大于等于种子长度作为萌发的标准, 分别在接种后的10, 15, 20, 25, 30 d统计萌发率。 种子发芽率(%)=萌发种子粒数/接种种子粒数× 100; 种子发芽势(%)=发芽初期比较集中的天数的发芽率(30 d); 发芽指数(GI)=∑ Gt/Dt, 式中, GI为在t日的发芽数(30 d), Dt为发芽天数[16]; 活力指数=(胚芽长+胚根长)× 发芽指数; 相对盐害率=[(对照发芽率-盐处理发芽率)/对照发芽率]× 100%[17]; 相对发芽率=(盐处理发芽率/对照发芽率)× 100%[18]。
1.2.4 幼苗生长发育表型的观察
分别培养1, 2, 3, 4个月后, 从各个盐浓度组选取30株代表性幼苗测量其株高和根长, 并对4个月植株进行拍照。
1.2.5 幼苗根尖的细胞学及形态观察
盐节木种子同步化萌发5 d后, 选取形态大小相同的幼苗转接到含琼脂10 g/L直径90 cm的培养皿中, 实验共设置4个NaCl浓度梯度(100, 200, 300, 400 mmol/L)和1个对照组(0 mmol/L), 每组设置3个重复, 每皿30株幼苗分3行排列, 进行平板垂直培养, 培养10和30 d后, 各选取10株代表性幼苗, 截取约0.8 cm长的根尖, 将根尖浸入2/3 HCG透明液(HCG透明液:80 g水合氯乙醛, 10 mL甘油, 溶于30 mL蒸馏水中)中透明5 min, 然后在OLYPUS-X51 型显微镜下, 对生长30 d的幼苗根尖包括根冠区和生长10 d的幼苗根尖通过仔细对焦对伸长区、成熟区细胞进行了细胞学观察, 并摄片。
采用Excel 软件进行数据计算和作图, 采用SPSS 13.0软件进行显著性分析。
从表1可知, MS培养基中附加NaCl浓度小于等于400 mmol/L时, 可促进盐节木种子提早萌发, 过高盐浓度会抑制并延迟种子的萌发。半数种子萌发所需时间与初始萌发时间略有不同, 高于300 mmol/L盐浓度后就表现为萌发延迟。所以附加100~300 mmol/L NaCl的实验组与对照组相比, 能促进盐节木种子提早1~2 d萌发。
| 表1 不同NaCl浓度下种子初始萌发时间与半数种子萌发所需时间 Table 1 The initiate time for seeds germination and the requiring time for half seeds germination under different concentration of NaCl |
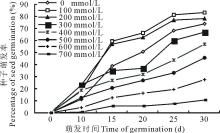
图1表明, 种子萌发天数低于10 d时, MS附加100~400 mmol/L NaCl培养基上的种子萌发率均高于对照组, 500 mmol/L NaCl与对照相当, 600和700 mmol/L NaCl对种子萌发有强烈抑制。 萌发天数超过15 d后, 仅100和200 mmol/L两个浓度对盐节木种子的萌发有促进作用, 其他浓度都表现为抑制作用, 并且随着盐浓度的增高, 抑制作用增强。经多重比较分析发现, 100 mmol/L NaCl处理组与对照组相比均具有显著性差异, 故100 mmol/L NaCl为盐节木种子萌发的最适盐浓度。
由表2可知, 不同浓度的NaCl胁迫处理1个月后对盐节木种子的萌发有明显的影响, 种子发芽势和发芽指数随NaCl浓度的升高表现为先升高后下降的趋势, 在100 mmol/L NaCl浓度时达到最大。从相对发芽率和相对盐害率可以看出低浓度盐(100~200 mmol/L NaCl)处理对其萌发有促进作用, 而高浓度盐(300~700 mmol/L NaCl)处理强烈抑制了种子的萌发。从活力指数方面分析, 300 mmol/L NaCl处理下表现为最大, 生物量最高。总体说明盐节木可以耐受一定浓度范围的NaCl而生存, 低盐环境尤其100~200 mmol/L NaCl显著提高了种子的萌发指数、发芽势, 对种子萌发是有益的, 高盐环境不利于其萌发。
| 表2 不同NaCl浓度下种子发芽指数、活力指数、发芽势、相对盐害率及相对发芽率 Table 2 Seed relative germination rate, germination vigor, germination index, vigor index and relative salt injury rate of H. strobilaceum under different concentration of NaCl |
由图2A, 图3可知, 在含MS附加100~500 mmol/L NaCl培养基上培养的盐节木幼苗地上部分即株高均高于对照组MS0培养基上培养的植株, 含600~700 mmol/L NaCl培养基上生长的植株, 株高低于MS0上培养的植株。同一时期相比, MS附加200 mmol/L NaCl培养基上的植株明显高于其他组, 如在4个月时在此培养基上的植株株高是对照组植株的1.88倍, 可以看出盐节木的生长能耐受一定浓度范围的盐胁迫, 在此浓度范围内, 对盐节木的生长起促进作用, 且最佳NaCl浓度是200 mmol/L。在此浓度上生长的植株除了株高高于其他处理组外, 植株表型为生长比较健壮, 同化枝呈现绿色, 其他处理组除了植株矮化外, 绿苗减少, 同化枝大多数呈红色, 可能是由于盐胁迫使得植物体内产生较多花青素的原因。当盐浓度为700 mmol/L NaCl时, 植株死亡。
由图2B可以看出, 几乎每个生长时期, NaCl浓度在100~300 mmol/L培养基上的实验组植株的根长均比对照组要长, 说明在此浓度范围内, NaCl对根生长起促进作用, 大于400 mmol/L时, 根长变短, 起抑制作用。在附加200 mmol/L NaCl的培养基上生长的幼苗根长最长, 且显著高于对照组和其他实验组, 可见幼苗根生长的最适盐浓度也为200 mmol/L。
如图4所示, 对照组幼苗根尖呈锥形, 直径小, 颜色深, 透明液脱色困难, 根冠部分相对不活跃, 由于根尖分生组织相对处于静止状态, 根冠脱落细胞数目少; 而盐浓度100~200 mmol/L培养基上生长的植株, 其根尖直径变大, 颜色变浅, 根尖生长点部分有较多的分泌物; 盐浓度为300~400 mmol/L时, 根冠部分相对增厚, 根冠细胞脱落变慢。这种现象间接说明在一定盐浓度(100~200 mmol/L)能够促进根冠包裹的根尖分生组织分裂加快, 加速细胞程序性死亡, 造成脱落物质增多, 根冠变薄, 对盐节木根的生长起到了促进作用。
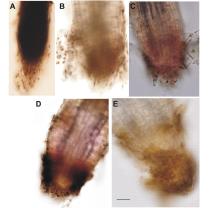 | 图4含不同NaCl浓度MS培养基生长1个月的盐节木幼苗根尖Fig.4Root tip of one-month-old seedling of H. strobilaceum cultured on MS supplemented with different concentration of NaCl |
如图5所示, 与对照相比, 在100~200 mmol/L NaCl培养基上生长的幼苗根尖, 伸长区和成熟区的细胞变窄变长, 单位面积内细胞数目逐渐增多。而分生区因太短不好区分, 没有摄片。由此可知, 适宜盐浓度能够加快根尖分生区细胞的分裂速度, 致使伸长区和成熟区细胞数目增多, 根尖变粗。
前人用培养皿湿滤纸表面萌发法和沙培法[1, 6, 7, 13]研究其种子萌发率, 但因水淹、细菌滋生、沙埋机械阻力、种子(褐色)与沙培基质难于区分等原因, 使研究和统计存在一定的困难, 对结果的可靠性有一定影响。本研究采用组织培养法, 培养基与盐节木种皮的颜色区别明显, 便于观察。而且, 培养是在无菌、恒温、恒湿等优越条件下进行, 不受其他不利因素影响, 对最适盐浓度的筛选和种子萌发率的统计结果可靠性提高, 为进一步研究其耐盐机理打下了一定的基础, 也为其他小粒盐生植物种子萌发和幼苗生长最佳耐盐浓度的筛选提供了可以借鉴的方法。
本研究表明, 100~200 mmol/L NaCl是盐节木种子萌发较适宜的盐浓度范围, 幼苗生长的最适宜浓度为200 mmol/L。该结论与高瑞如等[6]采用培养皿湿滤纸表面萌发法所得研究结果有所不同, 高瑞如等[6]的结果显示, 当单盐NaCl溶液电导率为3.125 dS/m(相当于0.32%; 57 mmol/L NaCl)时, 盐节木种子萌发率达到最高, 幼苗根长达到最大, 比本研究的最适浓度100~200 mmol/L要低很多。而土盐(复合盐)溶液15.630 dS/m(相当于1.0%; 285 mmol/L NaCl)与本实验结果100~300 mmol/L NaCl种子萌发率相差不大, 进一步证明了MS培养基中其他盐离子与NaCl存在拮抗作用, 进而提高了幼苗的耐盐性, 也说明MS培养基在一定程度内能够模拟土盐, 从而较为准确地反映出植物适盐的真正规律。曾幼龄等[15]的研究表明, 盐碱地区盐生植物受到渗透胁迫和离子毒害两种胁迫的影响, 并且主要是渗透胁迫而不是离子毒害, 基于MS培养基研究, 消除了离子毒害作用, 主要反映的是NaCl的渗透胁迫作用, 从而为进一步研究NaCl对盐节木的渗透胁迫机制打下了基础。
观察盐节木幼苗表型可知:生长在无NaCl的MS0培养基和含盐高于300 mmol/L的MS培养基上的植株, 1个月内下胚轴表现为红色, 3~4个月后同化枝呈红色, 而生长在适宜盐浓度培养基上的植株大多数为绿色, 说明无盐和高盐对盐节木幼苗都有胁迫作用, 引起体内花青素的生物合成, 以提高抗逆性[19]。
与前人的研究结果相似, 盐节木种子的萌发具有不同步性。Qu等[1]采用新收种子进行研究, 直到第15天仍然有开始萌发的种子, 而本研究用贮存7年的种子, 在无盐的MS培养基上萌发率可高达74%, 只是萌发时间延迟, 萌发可持续到第25~30天, 说明陈旧种子仍有萌发力, 可能由于种子劣变导致了萌发时间的延迟。另外, 其他盐生植物的种子也存在萌发的不同步性[13, 20, 21]。那么, 盐生小粒种子同步化萌发有待进一步研究。
另外, 本研究用透明液处理盐节木根尖后进行了形态学和细胞观察, 发现不同盐浓度处理下根尖形态尤其根冠形态和根尖伸长区、成熟区细胞长度和数目有差异, 反映到宏观方面就是幼苗根长的不同, 有关盐节木这方面的研究还未见报道, 本研究也为其他盐生植物耐盐机理的研究提供了可以借鉴的方法。
本研究采用组织培养法, 以MS为基本培养基, 研究了不同NaCl浓度对盐节木种子萌发和幼苗生长的影响, 此外, 还对适宜NaCl浓度促进根尖生长的形态学和细胞学进行了观察, 结论如下:1)储藏7年的种子仍有活力, 对照组的活力指数和萌发率分别为3.36和74.46%, 但萌发时间与前人[1]比较有所延迟, 且萌发具有不同步性, 萌发时间可从6 d持续到25~30 d。2)基于MS培养基, 盐节木种子萌发的最佳NaCl浓度范围为100~200 mmol/ L, 不仅能提早萌发1~2 d, 萌发率提高到84.00%, 且盐害率为负值。3)基于MS培养基, 盐节木幼苗生长的最佳NaCl浓度为200 mmol/L。地上部分耐盐浓度高, 100~400 mmol/L甚至500 mmol/L NaCl都有促进作用; 根的耐盐浓度较低100~300 mmol/L NaCl有促进作用。4)低浓度的盐(100~200 mmol/L)促进根生长的原因是NaCl能促使根尖生长点代谢旺盛, 分裂加快, 也促进了根伸长区和成熟区细胞数目的增多, 长度增加, 从而促进了根冠细胞的程序性死亡即脱落加快, 最终促进了根的伸长。
总之, 本研究基于MS培养基, 消除了NaCl的离子毒害作用, 主要体现了其渗透胁迫作用, 筛选出了盐节木种子萌发和幼苗生长的最佳NaCl浓度, 分别为100和200 mmol/L, 也初步通过对根尖的形态学和细胞学观察, 了解到NaCl促进盐节木根生长的机制是加快了根尖分生区细胞的分裂和伸长区、成熟区细胞的伸长, 从而加速了根冠的程序性细胞死亡。本研究为盐节木耐盐机理的深入研究奠定了一定基础, 并提出了新的研究课题— — 盐节木种子同步化萌发研究。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [3] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [20] |
|
| [21] |
|