作者简介:李州(1986-),男,云南文山人,在读博士。E-mail: lizhou1986814@163.com
以广泛栽培的“拉丁诺”白三叶为供试材料,对其在不同水分胁迫处理下叶片相对含水量、活性氧成分、膜脂过氧化产物、抗氧化酶活性、脯氨酸含量及其代谢酶活性等生理指标进行测定,并利用RT-PCR技术分析4种抗氧化酶基因在不同胁迫条件下的表达特性,分析外源亚精胺缓减水分胁迫的效应。结果表明,水分胁迫下白三叶叶片相对含水量逐步降低,活性氧和丙二醛含量不断升高,外源亚精胺能显著提高胁迫下叶片相对含水量,有效降低活性氧和膜脂过氧化产物的积累;外源亚精胺使水分胁迫下白三叶抗氧化酶活性和基因表达量发生改变,提高了水分胁迫下白三叶叶片超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)和抗坏血酸过氧化酶(APX)基因的表达从而提高抗氧化酶活性,缓解了水分胁迫造成的氧化胁迫伤害;外源亚精胺提高了脯氨酸合成代谢关键酶Δ’-吡咯啉-5-羧酸合成酶(P5CS)和分解代谢关键酶脯氨酸脱氢酶(ProDH)活性,促进了水分胁迫下脯氨酸的代谢,但对脯氨酸合成代谢鸟氨酸途径中关键酶——鸟氨酸转氨酶(OAT)没有影响。外源亚精胺能有效提高白三叶的抗水分胁迫能力,这与亚精胺诱导了胁迫下白三叶抗氧化酶基因表达,提高抗氧化酶活性和促进脯氨酸的代谢从而减轻由水分胁迫造成的氧化伤害、稳定了细胞膜系统及提高渗透调节能力密切相关。
The effects of spermidine (Spd) on relative water content, reactive oxygen, membrane lipid preoxidation, antioxidant enzyme activity and proline metabolism were studied in white clover ( Trifolium repens) leaves, cultivar ‘Ladino’. The expression patterns of four different antioxidant enzyme genes were analyzed using semi-quantitative RT-PCR under different water stress. Under water stress, relative water content gradually declined whereas reactive oxygen and malondialdehyde (MDA) content increased. Exogenous Spd significantly improved relative water content and effectively reduced the accumulation of reactive oxygen and MDA. Exogenous Spd changed antioxidant activities and gene expression pattern under different water stress regimes and increased expression of superoxide dismutase (SOD), catalase (CAT), peroxidase (POD) and ascorbate peroxidase (APX) genes to improve antioxidant enzyme activities, reducing water stress injury. Exogenous Spd accelerated proline catabolism and biosynthesis from the glutamate pathway during water stress although it had no effect on the ornithine pathway of proline biosynthesis. The results suggested that exogenous Spd can effectively improve water stress tolerance of white clover associated with the improving antioxidant enzyme activities, enhancing expression of genes encoding antioxidant enzymes and accelerating proline metabolism.
白三叶(Trifolium repens)是一种世界性分布与栽培的多年生豆科饲草, 由于具有蛋白质含量高、再生速度快以及良好的固氮能力等特点, 在改良天然草地和建植人工混播草地过程中发挥着巨大作用[1, 2]。然而, 白三叶属浅根型作物, 喜冷凉湿润气候, 抗逆性较差, 干旱是限制其发展和利用的主要逆境因素[3]。多胺(polyamine, PAs)是一类广泛分布于生物体内具有生理活性的低分子量脂肪族含氮碱, 在植物体内主要包括腐胺(putrescine, Put)、亚精胺(spermidine, Spd)和精胺(spermine, Spm)等, 众多研究表明, 逆境胁迫下, 多胺具有缓解氧化压力、保护生物大分子结构并参与逆境胁迫信号传递的功能[4, 5, 6]。Kasukabe等[7]的研究发现, 转亚精胺合成酶基因的拟南芥(Arabidopsis thaliana)植株体内亚精胺含量显著增加, 并表现出了显著增强的耐旱性、耐冷性和耐盐性等多种特性, 并认为亚精胺在植物响应逆境胁迫过程中扮演着信号调节枢纽的作用。Sung等[8]研究表明, 外源亚精胺和精胺通过上调高盐胁迫下粗齿冷水花(Ulva fasciata)铁超氧化物歧化酶(FeSOD)基因的表达以提高其抗氧化保护能力, 从而缓解了高盐胁迫下机体氧化性损伤。这与2011年Aryadeep等[9]的研究相似, 外源亚精胺和精胺能有效提高盐胁迫下水稻(Oryza sativa)抗坏血酸过氧化物酶(APX)和过氧化氢酶(CAT)等抗氧化酶活性, 并诱导了盐胁迫下脯氨酸的积累。同时Jinn等[10]发现, 水淹条件下外源亚精胺和精胺还能通过提高抗氧化酶活性来帮助维持大葱(Allium fistulosum)体内活性氧平衡并防止膜脂过氧化带来的伤害。此外, 逆境胁迫下多胺还具有稳定细胞膜[11]、提高可溶性糖含量[12]、影响Ca2+和K+通道, 调节气孔关闭等[13]作用。因此, 研究亚精胺诱导白三叶抗旱性机制不仅能为提高白三叶抗旱性提供理论基础和寻找新的途径, 而且能进一步了解亚精胺调控植物抗逆性的作用机理。
前人对于亚精胺诱导逆境胁迫下植物的耐受性主要集中在抗氧化酶活性的变化和有机渗透调节物质的积累等方面, 缺乏系统性和完整性, 对于亚精胺调控不同水分胁迫强度下不同类型抗氧化酶基因的表达模式以及对于脯氨酸代谢的影响鲜有报道, 在白三叶上几乎处于空白。本研究通过添加外源亚精胺的方法, 对不同水分胁迫强度下白三叶叶片活性氧积累、抗氧化保护系统以及脯氨酸代谢进行研究, 并通过RT-PCR技术研究不同处理和胁迫强度下抗氧化酶基因的表达特异性和表达模式, 旨在深入理解亚精胺参与调控植物逆境防御的生理和分子机制, 同时为丰富白三叶的抗逆栽培措施提供理论依据。
本试验于2013年在四川农业大学草业工程试验室进行。以广泛种植的拉丁诺(Ladino)白三叶为供试材料, 采用沙培法进行培育。具体方法为:将白三叶种子用0.1%的高锰酸钾溶液消毒后, 播种在装有石英砂的白色育苗盘(长35 cm, 宽25 cm, 高10 cm)中, 24℃光照培养箱中进行发芽, 待发芽7 d后用Hoagland全营养液继续培养, 温度为白天23℃, 夜晚19℃, 时长各为12 h, 相对湿度为70%, 当幼苗长至30 d(2片成熟叶片)时选取长势一致的材料用20%(W/V)聚乙二醇6000(PEG-6000)进行水分胁迫处理。
本试验共设对照(CK)和外源亚精胺(CK+Spd)2个处理(每处理设4个重复)和3个水分胁迫强度, 分别为:1)正常水分:CK(Hoagland全营养液正常培养)和CK+Spd(Hoagland全营养液加入0.05 mmol/L外源亚精胺正常培养); 2)轻度水分胁迫:CK(加20% PEG-6000的Hoagland全营养液胁迫3 d)和CK+Spd(在加20% PEG-6000的Hoagland全营养液中加入0.05 mmol/L的亚精胺胁迫3 d); 3)重度水分胁迫:CK(加20% PEG-6000的Hoagland全营养液胁迫9 d)和CK+Spd(在加20% PEG-6000的Hoagland全营养液中加入0.05 mmol/L的亚精胺胁迫9 d)。为了保持各个处理溶液中药品浓度一致, 从进行处理开始, 每3 d更换1次处理液。
1.3.1 相对含水量(relative water content) 叶片相对含水量采用烘干法测定[14], 剪取叶片0.3 g, 用普通吸水纸将其包裹好, 放入装满水的50 mL离心管中, 盖好盖子, 放置于避光处静置24 h叶片吸水饱和后, 取出叶片, 擦干表面水分, 称量饱和鲜重, 然后置于鼓风烘箱中在105℃下杀青45 min, 然后75℃下烘至恒重, 称其干重, 重复4次, 取平均值。计算公式:相对含水量(%)=(鲜重-干重)/(饱和鲜重-干重)× 100。
1.3.2 超氧阴离子产生速率(the generation of superoxide anion)和过氧化氢含量(H2O2 content) 超氧阴离子递减速率参照Elstner和Heupel[15]的方法稍加改进测定, 剪取叶片0.3 g, 用3 mL 50 mmol/L磷酸缓冲液(pH 7.8)研磨, 5000 r/min, 离心10 min。取上清液1 mL, 加入pH 7.8磷酸缓冲液0.9 mL和10 mmol/L盐酸羟胺0.1 mL, 混合并25℃保温20 min。加入1 mL 17 mmol/L对氨基苯磺酸和1 mL 7 mmol/L α -萘胺, 25℃保温20 min, 反应后的显色液加入3 mL乙醚, 充分摇匀, 静置分层, 吸取试管下层水相。530 nm下测定吸光值, 从标准曲线查得NO2-浓度, 计算O2-产生速率。H2O2含量参照Uchida等[16]的方法稍加改动进行测定, 称取新鲜植物组织0.2 g, 按材料与提取剂1∶ 1的比例加入4℃下预冷的丙酮和少许石英砂研磨成匀浆后, 转入离心管3000 r/min下离心10 min, 分层弃去残渣, 上清液即为样品提取液。用移液枪吸取样品提取液1 mL, 加入5%硫酸钛和浓氨水, 待沉淀形成后3000 r/min离心10 min, 弃去上清液。沉淀用丙酮反复洗涤3~5次, 直到去除植物色素。向洗涤后的沉淀中加入2 mol/L硫酸5 mL, 待完全溶解后, 415 nm比色。
1.3.3 抗氧化酶活性(antioxidant enzyme activity)和丙二醛(malondialdehyde, MDA)含量 粗酶液的提取, 称取植物鲜重0.4 g放入研钵中, 放入液氮(能够完全覆盖组织)研磨组织破碎后, 待液氮完全挥发后加入2 mL预冷的磷酸缓冲液和0.1 g PVP在冰上充分研磨, 然后转入离心管中, 再用2 mL缓冲液充分清洗研钵, 一并转入离心管中。4℃下15000 r/min离心20 min, 上清液即为粗酶提取液。将粗酶液分装入各管中进行MDA和抗氧化酶的活性测定。MDA含量采用硫代巴比妥酸法测定[17]; 超氧化物歧化酶(superoxide dismutase, SOD)活性采用核黄素-NBT法测定[18]; 过氧化氢酶(catalase, CAT)活性采用紫外吸收法测定[19]; 过氧化物酶活性(peroxidase, POD)采用愈创木酚显色法[19]; 抗坏血酸过氧化物酶(ascorbate peroxidase, APX)采用紫外吸收法测定[20]。
1.3.4 游离脯氨酸(free proline)含量及其代谢酶活性 采用茚三酮比色法测定[21], 取不同处理的剪碎混匀叶片0.2 g, 分别置于大试管中, 加入5 mL 3%磺基水杨酸溶液, 管口加盖玻璃球, 置于水浴中浸提10 min。取出试管待冷却至室温后, 吸取上清液2 mL, 加2 mL冰乙酸和3 mL显色液, 于沸水浴中加热40 min, 取出冷却后加入5 mL甲苯充分振荡, 以萃取红色物质。静置待分层后吸取甲苯层在波长为520 nm下比色, 从标准曲线中查出测定液中脯氨酸浓度。鸟氨酸转氨酶(ornithine aminotransferase, OAT)活性采用茚三酮法测定[22]; Δ ’ -吡咯啉-5-羧酸合成酶(pyrroline-5-carboxylate synthetase, P5CS)活性参照Garcia-Rios等[23]的方法; 脯氨酸脱氢酶(proline dehydrogenase, ProDH)活性参照Sanchez等[24]的方法。
1.3.5 基因表达分析 白三叶叶片总RNA提取参照捷倍斯公司试剂盒(Plant RNA Kit)说明书, 提取的总RNA参照美国Bio-Rad Laboratories公司反转录试剂盒(iScriptTM cDNA Synthesis Kit)说明书进行反转录获得cDNA第一链。以白三叶肌动蛋白基因(β -Actin)为内参, 根据白三叶POD基因设计半定量引物。根据GenBank中的已知的红三叶(Trifolium pratense)SOD基因、蚕豆(Vicia faba)CAT基因和蒺藜苜蓿(Medicago truncatula)APX基因序列, GenBank编号分别为:AY434497.1、JQ043348.1、XM_003601995.1, 使用近源物种基因序列相似性的TBLASTX分析, 在白三叶已有的表达序列标签(EST)中鉴定出了白三叶SOD、CAT、APX基因序列片段, GenBank编号分别为:FY461274.1、FY464988.1和FY460674.1, 他们与前面已知相应基因序列的相似性分别达到94%, 93%和95%, 因而可用于设计引物(表1)。
| 表1 试验中所用到的引物 Table 1 All primers used in this experiment |
以获得的cDNA第一链为模板进行PCR扩增。β -Actin、SOD、CAT和POD基因反应程序为:94℃ 3 min; 94℃ 30 s, 57℃ 30 s, 72℃ 1 min, 30个循环; 72℃ 5 min。APX基因反应程序为:94℃ 3 min; 94℃ 30 s, 62.5℃ 30 s, 72℃ 1 min, 30个循环; 72℃ 5 min。
采用Excel 2003进行绘图; SAS 9.1软件进行方差分析和显著性分析(P< 0.05); Quantity one进行半定量分析。
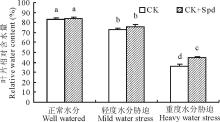
植物叶片的相对含水量(RWC)可以直接反应植物体在干旱环境下水分的亏缺程度。随着水分胁迫强度的加大, 白三叶叶片RWC呈明显的下降趋势。正常水分和轻度胁迫下, 外源亚精胺对白三叶叶片相对含水量没有显著影响。重度胁迫下CK处理和CK+Spd处理的RWC分别下降了57%和46%, 此时CK+Spd处理维持了显著较高的RWC(图1)。
水分胁迫过程中, 不同处理超氧阴离子产生速率、H2O2和MDA含量反应一致, 都随着水分胁迫强度的加大不断增大, 说明水分胁迫过程中活性氧和膜脂过氧化产物不断积累, 细胞氧化性损伤不断增大(图2)。与正常水分相比较, 轻度水分胁迫使CK处理的超氧阴离子产生速率和MDA含量显著上升, 但并未对CK+Spd处理造成显著影响, 而CK+Spd处理分别在轻度水分胁迫和重度水分胁迫下维持了显著低的超氧阴离子产生速率和MDA含量, 说明外源亚精胺有效缓解了水分胁迫下白三叶叶片膜脂过氧化程度(图2A, C)。如图2B所示, 轻度水分胁迫和重度水分胁迫都使CK和CK+Spd处理的H2O2含量显著增高, 但添加外源亚精胺处理显著降低了白三叶在轻度和重度胁迫强度下的H2O2水平, 一定程度上缓解了水分胁迫带来的氧化伤害。
轻度水分胁迫下CK+Spd处理的叶片SOD活性比正常水分条件下高出了2.7个百分点达到显著水平, 而CK处理几乎处于同一水平, 且CK+Spd处理的SOD活性在轻度和重度胁迫下显著高于CK处理(图3A)。轻度水分胁迫使CK和CK+Spd处理的CAT活性分别上升了65%和84%, 二者之间存在显著差异, 重度胁迫下两处理的CAT活性又急剧下降, 但CK+Spd处理下降幅度小于CK处理, 维持了显著较高的CAT活性(图3B)。外源亚精胺显著提高了正常水分和轻度胁迫条件下白三叶叶片POD活性, 但此种效益在重度胁迫下并未表现出来(图3C)。APX活性随着胁迫程度的增大而升高, 重度胁迫下, CK和CK+Spd处理的APX活性分别是正常水分条件下的1.6和1.8倍, 此时CK+Spd处理的APX活性显著高于CK处理(图3D)。
半定量RT-PCR结果显示, SOD基因的相对表达量随着胁迫强度的加大逐渐增强, 与SOD活性变化相一致, 水分胁迫诱导了SOD基因的表达, 而添加外源亚精胺能进一步提高SOD的表达量, 在重度胁迫下, CK+Spd处理维持了显著较高的SOD表达量(图4A)。正常水分和轻度水分胁迫下CK和CK+Spd处理的CAT基因稳定表达无显著差异, 但重度胁迫下CK处理的叶片CAT基因表达量显著降低, 而CK+Spd处理的叶片CAT基因仍具有显著较高的表达量(图4B)。
 | 图4 亚精胺对水分胁迫下白三叶叶片抗氧化酶基因表达的影响. W:正常水分Well watered; M:轻度水分胁迫Mild water stress; H:重度水分胁迫Heavy water stress.Fig.4 Effects of spermidine on the gene expression of anti-oxidative enzyme under water stress |
水分胁迫同时也诱导了POD基因的相对表达量, 但添加外源亚精胺处理使正常水分和胁迫下白三叶叶片POD表达量进一步提升(图4C)。轻度水分胁迫下, CK和CK+Spd处理的POD表达量显著增加, 分别比正常水分下上升了121%和135%, 二者差异显著(图4C)。外源亚精胺对正常水分下白三叶APX基因的表达量影响显著, 大大激活了APX基因的表达, 但轻度水分胁迫下有所下降。CK处理的APX基因表达在轻度胁迫下有所上升, 但未达到显著水平, 重度胁迫下CK+Spd处理的APX基因表达是CK处理的2.4倍, 达到显著水平(图4D)。
游离氨基酸含量在响应水分胁迫的过程中急剧升高, 重度胁迫下CK和CK+Spd处理的白三叶叶片游离脯氨酸含量分别是胁迫前的29和34倍, 此时两处理的游离氨基酸含量没有表现出显著差异, 但CK+Spd处理在轻度胁迫下积累了显著较高的游离脯氨酸(图5A)。
 | 图5 亚精胺对水分胁迫下白三叶叶片脯氨酸含量及代谢酶活性的影响Fig.5 Effects of spermidine on free proline content and activities of its metabolic enzyme under water stress |
鸟氨酸转氨酶(OAT)和Δ ’ -吡咯啉-5-羧酸合成酶(P5CS)是脯氨酸合成代谢两个不同途径的关键酶, OAT活性随着水分胁迫强度的增加逐步升高, 特定水分胁迫强度下CK和CK+Spd处理间均未表现出显著差异(图5B)。而P5CS活性在CK处理中呈先下降后上升的趋势, CK+Spd处理的P5CS活性在正常水分和轻度胁迫下变化不大, 重度胁迫下快速上升, 且活性在3种胁迫强度下均显著高于CK处理组(图5C)。这说明外源亚精胺主要通过诱导P5CS活性从而促进脯氨酸在白三叶叶片内的积累。ProDH是脯氨酸分解代谢途径的关键酶, 在响应水分胁迫的过程中, 两个处理的ProDH活性先升高后下降, 轻度胁迫下有较大幅度的上升。轻度和重度水分胁迫下, CK+Spd处理的ProDH活性均显著高于CK处理, 说明外源亚精胺处理促进了白三叶叶片脯氨酸在水分胁迫下的分解代谢(图5D)。
多胺参与逆境胁迫下植物抗氧化防御已被广泛报道, 它的分子作用机制和信号作用也越来越受到人们的关注。Wen等[25]和He等[26]研究发现, 过量表达亚精胺合酶的转基因梨(Pyrus spp.)植株通过上调SOD和APX等抗氧化酶活性, 降低了胁迫下H2O2含量和膜脂过氧化产物MDA积累, 有效缓减了盐胁迫和甘露醇导致的水分胁迫。而转入反义亚精胺合酶基因的梨树体内亚精胺含量降低, 盐胁迫和镉胁迫下抗氧化防御系统功能减弱, MDA含量显著增加, 膜脂过氧化程度加剧, 植株耐受性减弱[27]。外源亚精胺亦能显著提高非生物胁迫下多种抗氧化酶活性, 增强植物抗氧化防御[28]。本研究中, 外源亚精胺显著提高了水分胁迫下白三叶SOD、CAT、POD和APX活性, 使得细胞内超氧阴离子产生速率和H2O2含量显著下降, MDA含量显著降低, 细胞膜脂过氧化程度减小, 从而增强了水分胁迫下白三叶抗氧化胁迫能力。这与Kubis[29]在研究外源亚精胺缓解水分胁迫下黄瓜(Cucumis sativus)叶片氧化压力的研究相一致, 他发现外源亚精胺能通过提高POD等多种抗氧化酶活性降低胁迫下叶片超氧自由基和H2O2含量, 以达到缓解氧化压力的作用。
Kasukabe等[7]研究表明, 多胺在提高植物逆境胁迫能力上扮演着双重作用, 一是以胁迫保护化合物的方式直接参与抵御环境胁迫, 二是起到胁迫信号调节器的作用, 能诱导DREB等胁迫响应转录因子及rd29A等胁迫保护蛋白基因的表达。尸胺能诱导冰叶日中花(Mesembryanthemum crystallium)中SOD基因的表达已被证实[30], 而烟草(Nicotiana tabacum)中POD基因的表达受精胺的影响[31]。其他已有报道也证实亚精胺和精胺均能上调转录因子键合DNA活力并诱导多种基因的表达[32, 33]。本研究通过半定量RT-PCR技术分析亚精胺对水分胁迫下4种抗氧化酶基因的影响, 结果显示外源亚精胺不同程度地上调了正常水分和水分胁迫下白三叶叶片中SOD、CAT、POD和AXP基因的表达水平, 并使CAT基因的表达模式发生改变, 使其在水分胁迫下始终保持较高的稳定表达。这说明亚精胺通过调控多种抗氧化基因的表达从分子水平上参与了水分胁迫下白三叶抗氧化防御系统。
积累可溶性糖、脯氨酸和甜菜碱等物质是植物响应水分亏缺最主要的方式之一, 这些有机渗透调节物质对于植物体应对水分胁迫十分重要[34, 35, 36]。Cramer等[37], Szabados和Savoure[38]认为, 脯氨酸在干旱防御上的作用不仅仅是渗透调节, 而在渗透保护功能上意义重大, 它的积累和代谢可以维持干旱胁迫下细胞内结构和膜的稳定性, 同时具有清除超氧阴离子等自由基的作用。本研究结果显示, 水分胁迫下游离脯氨酸在白三叶叶片内迅速积累, 且外源亚精胺提高了轻度水分胁迫下白三叶叶片游离脯氨酸含量, 这也印证了Roychoudhury等[39]和Duan等[28]的研究结果, 即逆境胁迫下外源亚精胺能显著提高水稻等植物体内脯氨酸的含量, 且抑制亚精胺合酶的表达能显著抑制脯氨酸的积累。OAT和P5CS分别是合成脯氨酸鸟氨酸途径和谷氨酸途径中的限速和调节酶[40], 而ProDH则是脯氨酸分解途径的限速酶[41]。外源亚精胺同时显著提高了谷氨酸合成途径中P5CS活性和分解途径中ProDH活性, 但对OAT活性影响不明显, 表明外源亚精胺主要通过调节谷氨酸途径促进脯氨酸在白三叶叶片内的积累, 同时也通过提高ProDH活性促进水分胁迫下脯氨酸在白三叶叶片内的降解和利用。
综上所述, 外源亚精胺通过上调水分胁迫下白三叶叶片抗氧化酶基因SOD、CAT、POD和APX表达, 显著提高了胁迫下抗氧化酶活性, 有效缓解了水分胁迫导致的氧化性伤害, 稳定了细胞膜结构; 外源亚精胺还通过提高谷氨酸合成途径关键酶P5CS活性和降解关键酶ProDH活性, 促进了水分胁迫下脯氨酸的代谢, 增强了胁迫下白三叶渗透调节和消除氧胁迫的能力, 提高了叶片相对含水量, 在减轻水分胁迫对白三叶生理功能的影响中发挥作用。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [1] |
|
| [2] |
|
| [4] |
|
| [6] |
|
| [12] |
|
| [35] |
|
| [36] |
|