作者简介:刘晚苟(1965-),男,湖南茶陵人,副教授,博士。E-mail: liuwangou@163.com
香根草因其具有发达的根系而被许多国家用于水土保持,但紧实土壤影响根系的生长,而土壤容重与土壤紧实度密切相关。为了掌握粤西野生香根草对紧实土壤的适应状况,用人工土柱研究了容重分别为1.20 g/cm3 (D1.20)、1.35 g/cm3 (D1.35)和1.58 g/cm3 (D1.58)的土壤对其根系形态和生物量的影响。结果表明:1)随容重增大,根系和地上部生物量下降,根冠比降低,植株的根表面积、根长密度和根体积密度减小,而平均根直径增大。2)容重影响根系的空间分布,D1.20和D1.35处理的根系在上、下层分布较多,中间层分布少,表明粤西野生香根草具有深根型特性;高容重阻止根向下延伸,D1.58处理的根系主要分布0~6 cm的土层内。3)D1.20和D1.35土壤的平均根直径随土层加深减小,而D1.58的则增加。本实验结果说明粤西野生香根草能耐较紧实(D1.35)的土壤,高紧实土壤(D1.58)虽然限制其生长,但对表土层根系的分布影响小。并就容重对粤西野生香根草固土护坡的影响进行了讨论。
Vetiver grass ( Vetiveria zizanioides) has an extensive root system and is consequently used worldwide for water and soil conservation. However, soil compaction resulting in high soil bulk density negatively influences root growth. In order to understand the adaptation of vetiver grass to soil compaction, the effects of soil of different bulk density, 1.20 g/cm3 (D1.20), 1.35 g/cm3 (D1.35) and 1.58 g/cm3 (D1.58), on the root morphology and biomass of vetiver seedlings were investigated using soil columns. The results showed that shoot and root dry weight, root:shoot ratio, root surface area, root length density and root volume density decreased with increasing bulk density, but that average root diameter increased. High bulk density influenced the spatial distribution of roots; more roots grew in the upper (0-6 cm) and lower (18-24 cm) soil horizons under the D1.20 and D1.35 treatments, suggesting that vetiver typically produces a deep root system but that root growth is inhibited by high soil bulk density, confining roots to the upper soil horizon (0-6 cm). The average root diameter in the D1.20 and D1.35 treatments decreased but increased in D1.58 with increasing soil depth. It is concluded that vetiver grass could tolerate moderately compacted soil.
香根草(Vetiveria zizanioides)又名岩兰草, 为禾本科多年丛生草本植物。具有适应能力强、生长快、根系发达、耐旱、耐淹、耐盐、耐重金属、耐瘠等特性, 被世界上120多个国家和地区列为理想的保持水土植物[1]。香根草在水土保持[2]、生态环境治理、退化生态系统的恢复以及对重金属和污染物的生物修复和土壤基质的改良等[3, 4, 5]方面都有重要的作用。关于香根草在水土保持[1], 抗酸[6]、抗盐碱[7]、抗重金属[3]及垃圾污染[8], 以及干旱胁迫等方面[9]已有许多报道。
目前, 香根草主要应用于固土护坡。香根草之所以能用来固土护坡, 主要是由于其发达的根系能提高土壤的抗剪强度[9], 研究表明[10], 香根草根系的抗张力平均高达75 MPa, 是同等直径软钢的1/6。因此, 如果香根草没有了发达的根系, 那么它的生态作用效果将会大打折扣[11]。而需要固土护坡的地方的立地条件常常较差, 土壤紧实便是其一。如用在公路固土护坡, 由于路基受到重型机械的碾压, 或坡面表土取走裸露坚硬的底土层, 为了防止水土流失, 在栽植香根草时不便于松土, 土壤紧实度很高。因此香根草根系常常面对的是紧实的土壤, 而紧实土壤阻止根系的生长[12, 13]。但目前尚未见紧实土壤对香根草根系生长影响的报道。
土壤容重是土壤主要物理性状之一, 容重的变化直接影响土壤紧实度的改变。容重增加, 土壤紧实程度变大。紧实土壤对根系生长影响的研究结果较为一致, 即在紧实土壤中根伸长速度减慢[13, 14]、根变短变粗[15, 16]。香根草的固土护坡效果除了因其发达根系外, 还与根表面积、根长密度、根体积密度和平均根直径等根系形态参数有关[1]。根表面积和根体积密度决定根系吸收水分和营养的能力, 进而影响植株的生长。在根量相同的情况下, 根平均直径越小, 细根所占的比例越大, 根长密度越大, 固土能力越强[10]。肖宏彬等[17]研究了一年生香根草根系的分布和形态, 但没有涉及土壤紧实的程度对根系分布的影响。另外, 定植初期是最易发生水土流失的时期, 因此, 香根草根系早期的分布和形态是决定固土护坡效果好坏的关键。本实验采用人工土柱方法, 研究了幼苗期容重对粤西野生香根草根系空间分布和形态变化的影响, 以期为香根草在水土保持的应用提供参考。
土壤来自广东海洋大学水稻(Oryza sativa)田0~30 cm表土(该土已被多次反复用于研究粤西野生香根草种子萌发和生长实验), 质地为砂壤土, 环刀法测得的田间持水量是19.96%(干土含水量), 容重为1.20 g/cm3, 有机质含量为24.1 g/kg, 全N 1.18 g/kg, 速效P 89.7 mg/kg, 速效K 78.8 mg/kg。土壤风干后过2 mm筛, 每kg土掺入硝硫基复合肥5 g。然后使土壤自然吸湿到含水量12%左右, 这样有利于压实土壤。PVC管内径7 cm, 高25 cm, 底部管盖内径为6.43 cm, 内高为1.44 cm, 底盖有3个直径为0.5 cm的孔, 以利多余水分下渗。共设3个容重处理, 分别为1.20, 1.35和1.58 g/cm3(记为D1.20, D1.35和D1.58)。装土总体积为969.9 cm3。每管分4层装土, 根据容重计算每一层所需的土壤重量, 土倒入PVC管后, 先用塑料尺推平土壤, 再用压土杆压实土壤到所需高度。压土杆是一直径4 cm的实心钢杆, 其上有刻度, 一端焊接一直径6.5 cm、厚2 cm的圆形钢板。每一层土压实后用铁丝在表面轻轻划痕, 以免土层与土层之间出现紧实度不一致[16]。所有土柱的土面离管口1 cm, 加水到田间持水量65%, 并用塑料薄膜盖严, 待用。
实验于2012年在岭南师范学院生物园塑料大棚内进行, 自然光照。供试材料为粤西野生香根草[11]的种子苗。原产地是湛江吴川市兰石镇(2013年我们到原产地考察, 栖息地已全部变成了鱼塘, 找不到一株香根草了), 2002年引种到岭南师范学院生物园[18]。香根草种子置于花盆里发芽, 4片叶时选取大小和生长势基本一致的香根草幼苗移栽在PVC管中, 每管1株, 每个容重4次重复。对于压实的土壤, 疏松根系周围2 cm深的土壤。幼苗生长期间, PVC管口覆盖保鲜薄膜, 防止土表水分蒸发结皮, 中间开一小孔以利幼苗伸出管外, 前期每2 d用差重法[19]确定灌水量(± 5 g), 后期每天灌水一次, 维持土壤含水量在田间持水量的65%。
移栽后48 d, 将地上部剪下, 105℃杀青30 min后, 70℃烘干至恒重, 记录每株干重。土柱从PVC管中完整取出后, 用刀把土柱横切, 平分成4段(每段6 cm高), 然后把各土层分别浸泡在自来水中, 待土壤松软后, 用水轻轻冲洗根系上的土壤, 洗净后用吸水纸吸干根表面的水, 用0.5%甲基蓝染色12 h, 扫描仪扫描染色根系的图像[19], 利用WinRHIZO Pro 2009b根系分析系统软件(Regent Instruments Canada Inc.)对扫描图像分析, 得到根长密度、表面积、根体积密度、根平均直径等形态学参数。扫描后的根在70℃下烘干至恒重, 分别记录各土层根的干重, 地上部和地下部的干重之比即为香根草幼苗的根冠比。
所得数据在Microsoft Excel 2003上进行整理, 用SPSS 18.0的ANOVA进行方差分析, 采用Duncan法进行差异性检验, Origin 8.5作图。
表1表明, 随容重增大, 香根草幼苗的地上部分和根系的生物量呈下降趋势。与D1.20处理比较, D1.35和D1.58处理的根系干重分别下降了22.9%和54.2%, D1.20与D1.58之间达到显著差异; 地上部的干重分别下降了14.7%和29.3%, 但处理间差异不显著。容重增加, 根系干重降低的幅度较地上部的大, 说明容重对香根草根系的影响大于对地上部的影响。
| 表1 不同土壤容重对香根草干物质重和根冠比的影响 Table 1 Effect of different soil bulk density on dry weight and root/shoot ratio of vetiver seedlings |
根冠比是指根系和地上部干重之比, 本研究结果表明土壤容重增加使香根草幼苗的根冠比降低(表1)。与D1.20处理比较, D1.35和D1.58处理的根冠比分别下降了4.2%和30.4%, 容重增大, 根冠比降低, 也说明容重对根系生长的影响大于对地上部的影响。根冠比反映植物地下部分与地上部分的相关性, 根系是植物吸收水分和养分的主要部位, 根冠比小表明单位重量的根系要承担更多吸收任务, 才能维持地上部和自身对水分和养分的需求, 但根系吸收能力是有限的, 并且在逆境下吸收能力会降低, 因此很难满足植株对水分和养分的需要, 进而影响植株的生长。
2.2.1 土壤容重对根系生物量空间分布的影响 表2是根系干重在土柱中的空间分布情况。可以看出, 随容重增加, 各土层根系干重呈下降趋势, 在12~18 cm土层, D1.58的根干重显著低于D1.20的, 在18~24 cm土层, D1.58的根干重显著低于D1.20和D1.35的。从垂直面看, D1.20和D1.35的根系干重在土壤表层和底层分布多, 中间层少, 反映香根草深根系的特点。而D1.58处理的61.7%根干重分布在表层, 实验中D1.58处理的只有极少量根出现在最底层, 说明高容重限制香根草根系向下生长。
| 表2 土壤容重对香根草苗根系生物量空间分布的影响 Table 2 The effect of soil bulk density on spatial distribution of root dry biomass of vetiver seedlings |
2.2.2 土壤容重对香根草幼苗根系形态的影响 根表面积反映根系吸收面的大小, 根长密度为单位土壤体积内的根系长度, 根体积密度为单位土壤体积内的根系体积。从植株水平(0~24 cm)看, 上述3个指标随容重的增大而下降(表3)。与D1.20相比, D1.35和D1.58的根表面积分别下降了11.6%和51.1%, 根长密度分别下降了8.9%和65.8%, 根体积密度分别下降了14.1%和32.4%, D1.58的都显著低于D1.20的。而植株的根平均直径D1.20=D1.35< D1.58, D1.58的显著大于D1.20和D1.35的。
| 表3 土壤容重对香根草幼苗根系形态参数的影响 Table 3 The effect of soil bulk density on morphological parameters of root in vetiver seedlings |
从垂直分布看, 对于同一处理, D1.20和D1.35的根表面积、根长密度和根体积密度, 底层最大, 上层次之, 中间2层最小, 底层的显著大于中间2层, 而对于D1.58处理的, 上述3个参数主要分布在0~12 cm范围内, 下层分布很少(图1A, B, C)。D1.20和D1.35的各层平均根直径呈下降趋势, 说明随土层加深, 细根越来越多; 而D1.58的则相反, 上层细根多(图1D)。
对于处理间, D1.20各土层的根表面积、根长密度和根体积密度略高于D1.35的(18~24 cm的根长密度除外), 但差异不显著。在0~12 cm土层, D1.58的上述3个指标与其他2个处理间差异不显著, 其体积密度甚至是最高, 但在12~24 cm土层, D1.58的上述3个指标显著低于其他处理(12~18 cm的根体积密度除外)。就各土层平均根直径而言, D1.20和D1.35的差异不显著, D1.58的在0~12 cm土层的平均根直径稍微大于前二者, 但差异不显著, 而12~24 cm土层的根直径显著大于前二者(图1D)。
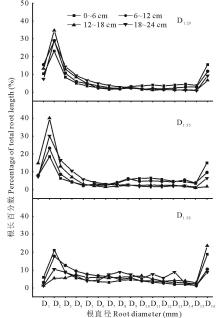
图2是不同根径范围下的根长百分数, 百分数大小反映某直径范围内根长的多寡。可以看出, D1.20和D1.35的在根径D2(0.1~0.2 mm)范围的根长百分数最大, D1.58的在根径D16(> 1.5 mm)范围的根长百分数较大。对于根径为D2的根长百分数, D1.20和D1.35随土层加深呈增大趋势, 而D1.58的呈下降趋势; 对于直径为D16的根长百分数, D1.20和D1.35随土层加深呈减小趋势, 而D1.58的呈增大趋势。
前人关于土壤容重对植物地上部分生长影响的报道不尽相同, 多数认为有影响[20, 21, 22], 有的认为影响不显著[23], 或没有影响[24], 甚至促进生长[25]。我们的实验结果表明随土壤容重增加, 地上部生物量下降, 但处理间差异不显著(表1)。关于容重影响地上部生长的原因也众说纷纭, 有的认为是高容重导致高机械阻力, 阻止根系的生长, 根系不能吸收足够多水分和养分供地上部生长需要[26], 有的认为是根系激素改变的结果[20]。我们认为容重影响地上部生长的原因是多方面的和综合的, 有物理因素如机械阻力, 化学因素如激素, 生理因素如水分和营养, 只是在特定条件下某种因素的影响更强些。如在土壤干旱下, 根土界面阻力通常是限制根对土壤水分吸收的主要阻力, 增加土壤容重可以大大提高土壤的非饱和导水率和降低根土界面阻力, 有利于根系的吸水, 而疏松土壤中根土界面阻力大, 反而不利于根系吸水[27]。容重增大, 一方面使根土接触紧密, 从而提高单根的吸收能力, 另一方面则由于高容重会降低总根量(如根长密度, 根表面积等), 以至总的吸收量还是减少, 一增一减, 水分的影响减小了, 而干旱使机械阻力大幅上升, 机械阻力的影响就凸显出来。但在土壤湿润下, 容重增大导致的机械阻力增幅小于干旱条件下的增幅, 此时机械阻力的影响较干旱下小, 而高容重导致孔隙度降低, 透气性变差, 影响根系的生理活性, 代谢失衡, 影响根系的激素合成, 此时激素的影响就凸显出来。因此, 在研究容重对植物生长的影响时, 要综合分析各种可能的因素, 结合具体条件, 分析主要原因。
土壤紧实度对根生长的影响的研究结果较为一致, 即在紧实土壤中根系生长速度减慢。据报道[12]当土壤容重达1.4 g/cm3时, 豌豆(Pisum sativum)根的生长速度仅为生长在0.85 g/cm3中的65%。Rosolem等[13]报道, 当土壤机械阻力达2.5 MPa时, 根的生长完全被抑制。我们的研究结果表明, 与D1.20比较, D1.58处理的根系生物量(表1)、根长密度和根表面积(表3)都显著下降。
实验结果表明, 随容重增大, 地上部和根系生长都下降, 但对根的影响更大, 表现在容重增大, 根冠比下降(表1)。前人对容重影响根冠比的报道不尽一致, 有的认为高容重使根冠比增大[20], 有的则认为使根冠比下降[14]。Andrade等[28]认为紧实土壤抑制地上部的生长, 促使更多光合产物向根系转移, 从而使根冠比增大, 我们认为这种解释牵强附会, 因为也可以反过来说, 根系生长受阻, 更多光合产物留在地上部, 使根冠比下降。对于高容重使根冠比下降的原因, Atwell[14]认为是紧实土壤抑制根系伸长的结果, 这种解释也不全面, 因为紧实土壤也抑制地上部的生长。容重对根系的影响大还是对地上部的影响大, 原因可能是多方面的, 如物种差异[29]、土壤水分差[23], 土壤质地差异[16]等。
根系生物量空间分布和根系形态参数空间分布的结果都表明, 容重对根系生物量空间分布产生影响。在低容重和中等容重条件下, 上层和下层土壤中根系分布较多, 而高容重土壤中, 根系主要分布在上层土壤中; 在低容重和中等容重条件下, 平均根径逐渐减小, 而在高容重土壤中平均根径呈增大趋势。肖宏彬等[17]报道, 香根草随土层加深根量减少, 根径变大, 与本研究高容重的结果相同, 他们实验中的土壤容重可能很高或紧实度高。
夏汉平和刘世忠[11]报道粤西野生香根草直径< 1 mm的根占总根量的30%(重量比), 限于当时的研究条件, 没有对根系形态作进一步分析, 如不同根径下的根长密度等。我们认为以根系重量百分比来评价不同生态型香根草的优劣存在不足, 例如单位体积土壤中的根重量(重量密度)虽然很大, 如果根很粗, 则其根长密度很小, 其固土护坡效果也差; 相反, 即使重量密度较小, 如果根很细, 根长密度大, 其固土效果比前者也要好。从本实验来看, 粤西野生香根草根径< 1 mm的根长占总根长的70%以上(D1.20, D1.35, D1.58的分别为79.5%, 79.6%, 70.6%), 从我们对粤西野生香根草和Sunshine香根草比较来看, 无论是水培还是土培, 粤西野生香根草的根径都比Sunshine香根草的小(待发表)。
本实验结果表明, 在表土层(0~6 cm), 处理间的根长密度和根径差异不显著, 表明香根草即使栽植在高容重或高紧实度的土壤中, 在生长前期也能产生足够量的根, 用于固定表土, 这很重要, 因为这个时期往往是水土流失最严重的时期。这只是用人工土柱研究的结果, 有待在实际应用中检验。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [2] |
|
| [5] |
|
| [8] |
|
| [11] |
|
| [17] |
|
| [18] |
|
| [19] |
|