作者简介:杨朝东(1971-),男,湖北巴东人,副教授,博士。E-mail:chaodongyang@aliyun.com
*通讯作者Corresponding author. E-mail:zhang.yang07@aliyun.com
利用光学显微镜和荧光显微镜对天胡荽进行了解剖学和组织化学研究,结果表明,1)天胡荽不定根为初生结构,具二原型维管柱、内皮层、皮层、外皮层和表皮。2)茎、花柄和叶主要为初生结构,除了茎和花柄维管束具次生结构,具表皮、厚角组织、皮层、内皮层、维管束和髓;茎具诱导型通气组织。3)天胡荽不定根的屏障结构包括内侧的有凯氏带且栓质化的内皮层,外侧的有凯氏带且栓质化的外皮层和紧邻外侧具扩散状栓质层的表皮细胞;匍匐茎、花柄和叶柄具相似的质外体屏障结构,一是内侧的有凯氏带且栓质化的内皮层,二是外侧的表皮外角质层,但花柄和叶柄有凯氏带的细胞,并不栓质化;叶片的仅为表皮外角质层。4)天胡荽的解剖和屏障结构特征是其适应多种水湿环境的结构基础。该研究为今后选择湿地生态修复植物提供线索。
The anatomy and histochemistry of Hydrocotyle sibthorpioides were investigated under light and fluorescence microscopy in this research. The findings were: 1) The adventitious root of H. sibthorpioides consisted of proto-xylem and proto-phloem, superceded by diarch primary vasculature of metaxymlem and metaphloem, surrounded by endodermis, then cortex, exodermis and epidermis. 2) Stolon, pedicel and leaf were primary structures with epidermis, collenchyma, cortex, endodermis, vascular bundle and pith, except that vasculature of the stolon and pedicel had secondary structures, and stolon had induced aerenchyma. 3) The apoplastic barriers in adventitious roots of H. sibthorpioides included the inner layers of endodermis with Casparian bands and suberin, the outer layers of exodermis with Casparian bands and suberin and the epidermis with suberin. The stolons, pedicels and petioles had similar apoplastic barriers, including the inner layer of endodermis with Casparian bands and suberin, and the outer layer of the cuticle, but the endodermis had no suberin in pedicels and petioles; leaf blades had only a cuticular apoplastic barrier. 4) The anatomical structure and apoplastic barrier characters are important structural determinants of adaptation of H. sibthorpioides to variably-moist environments. The implications of this research for selection of plant species to restore degraded wetlands are discussed.
天胡荽(Hydrocotyle sibthorpioides)为伞形科天胡荽属植物, 广泛分布于我国南方。天胡荽为较细小的多年生双子叶植物, 能在干旱、湿地和完全水淹条件下正常生活, 对水湿具很强的适应能力, 既作为新型草坪, 也有很高的药用价值[1, 2], 但其适应各种水湿条件的解剖结构和质外体屏障结构尚无研究报道。
湿地植物适应湿地缺氧环境必须具备两类重要结构, 即通气组织和质外体屏障结构[3, 4, 5, 6, 7]。屏障结构是由植物体各器官内、外皮层初生壁的凯氏带, 或次生壁栓质化和木质化, 以及植物体表角质层组成的保护组织[3, 8, 9, 10, 11, 12, 13, 14, 15, 16]。质外体屏障和细胞膜水孔蛋白是控制植物内部以及与环境的水、离子和氧气扩散和交换的重要结构[4, 8, 10, 11, 12, 13, 14]。湿地植物体内气腔主要包括根中通气组织, 茎中髓腔和皮层通气组织, 保障植物淹没胁迫时储藏和输导氧气[16, 17, 18]。
经典植物形态解剖学主要在光学显微镜和电镜下, 观察植物细胞组织结构和胞内细胞器超微构造, 也有染色, 其目的是便于观察胞壁和细胞器的形态和边界[19, 20, 21]。近些年, 随着组织化学、荧光显微镜的应用、植物细胞发育及其分子机理的研究, 植物解剖学取得了以下几方面的重要进展, 植物的皮层、内皮层、外皮层和皮下层的概念与经典植物解剖学所指的结构和意义完全不同。一是根尖细胞发育生物学及其基因表达等的研究结果表明, 拟南芥(Arabidopsis thaliana)根尖内皮层和皮层具有共同的原始细胞(CEI), 表皮具独立来源的原始细胞; 水稻(Oryza sativa)根尖皮层、内皮层、外皮层和表皮具共同的原始细胞(CEEI)[22]。二是拟南芥根内皮层凯氏带形成过程中, 有凯氏带膜蛋白家族(CASPs)参与, 同时说明凯氏带中具有蛋白质, 该蛋白与凯氏带在初生壁上也构成类似于动物上皮组织细胞间仅蛋白质参与的紧密连接, 具有保护作用[23, 24]。三是拟南芥根内皮层凯氏带应具备凯氏带结构、围绕维管束的拓扑学结构和SCR基因的表达三大要素[25]。四是凯氏带部位先有凯氏带膜蛋白家族出现, 随后有木质素沉积, 再有木栓质沉积[26]。五是依据根内皮层细胞初生壁和次生壁出现凯氏带之前、凯氏带、栓质化和木质化的组织化学出现先后顺序, 把内皮层的发育分为前内皮层阶段、第Ⅰ 、Ⅱ 和Ⅲ 阶段, 或者停留在某发育阶段[8]。因此, 认为植物内皮层或外皮层一定具有凯氏带, 凯氏带不仅有木栓质和木质素, 还含有蛋白质。植物的内皮层、皮层、外皮层和表皮是同等意义结构。皮下层是指表皮下有细胞形态分化的结构, 或含有外皮层或和厚壁层分化的结构。皮层是内皮层和外皮层之间的薄壁细胞组织。
三峡库区消落带的生态修复问题, 虽然从湿地植物的形态结构与生理、种群分布格局等方面已取得进展, 但解决该生态修复问题还有诸多工作需要开展。本研究试图从天胡荽的解剖结构、组织化学特征和质外体屏障结构, 为今后三峡库区消落带的生态修复寻找适合耐水淹植物提供线索。
天胡荽实验材料准备, 于2013年3月底采集湖北荆州长江大学西校区附近野生植株, 用农田土壤栽培于花盆中, 置于旱地花盆口部与地面平齐, 在自然的光和水分条件下生长, 一部分花盆作为旱生处理; 另一部分花盆在6月中旬, 模拟自然洪水胁迫, 将有完整天胡荽植株的花盆沉入自来水中, 8月中旬取出, 水中植株未见开花。取旱生和水淹下样本进行解剖学实验。取完整不定根约长75 mm左右, 完整匍匐茎约长350 mm左右, 具4~5个节。不定根用FAA固定, 匍匐茎、花柄和叶采用新鲜材料。
在立体解剖镜(JNOEC JSZ6, China)下, 用双面刀片切片距根尖10, 30, 50, 70 mm; 茎第1节间和第4节间, 花柄中部, 叶柄中部和叶片基部主脉。硫氢酸黄连素-苯氨兰对染切片确定细胞壁木质化和凯氏带, 凯氏带呈现生动黄色(vivid yellow), 木质化细胞壁呈现呆滞黄色(stagnant yellow), 如木质部[12, 27], 苏丹红7B染色切片检测栓质化细胞壁, 呈现红色, 具有很强的组织特异性, 而苏丹Ⅲ 或Ⅳ 常将细胞内的脂肪也染成红色, 特异性差, 造成栓质化胞壁不易识别[28]。苏丹红7B染色切片在莱卡光学显微镜(Leica DME)下观察, 用数码相机(Nikon E5400, Japan)拍照记录图片。硫氢酸黄连素-苯氨兰对染切片在荧光显微镜(Olympus IX71)蓝色激发光下观察, 用数码相机(RZ200C-21, China)拍照记录图片, 有关其他操作可参考Yang等[16]。图片主要用 Photoshop 7.0软件处理, 加标尺, 调整图片亮度和对比度, 以及合成图片等。
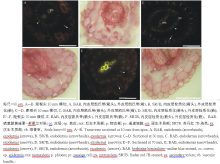
旱生和水淹下天胡荽的不定根有相似的解剖结构和组织化学发育过程。距天胡荽根尖10和30 mm, 内、外皮层开始形成微弱的凯氏带, 部分细胞壁栓质化(图1A, B), 皮层具1~2层细胞, 无通气组织, 表皮细胞壁无扩散状栓质层, 二原型初生木质部内有后生木质部发育, 其两侧为韧皮部。距根尖50 mm, 除内皮层的通道细胞外, 内、外皮层具强烈的凯氏带, 并且细胞壁栓质化; 部分表皮细胞壁开始出现扩散状栓质层[29](图1C, D)。在根基部(距根尖70 mm), 内、外皮层细胞具凯氏带, 并强烈栓质化, 皮层仅具2层细胞, 无通气组织, 维管柱停留在初生结构阶段(图1E, F); 内皮层、皮层、外皮层和表皮细胞不脱落; 表皮细胞壁均具扩散状栓质层。在不定根的各发育阶段, 已分化的不定根皮层未脱落, 维管柱处于初生结构状态。不定根中质外体屏障结构包括两部分, 一是有凯氏带且栓质化的内皮层, 二是有凯氏带且栓质化的外皮层和紧邻外侧具扩散状栓质层的表皮细胞。
旱生天胡荽匍匐幼茎的解剖结构自外向内依次由表皮、皮层、维管束、髓射线和髓构成。束状初生维管束相互独立, 之间为薄壁细胞, 呈轮状排列; 维管束可见初生木质部导管。皮层细胞暂无分化, 表皮下为1~2层细胞的厚角组织, 表皮外有角质层(图2A, B)。
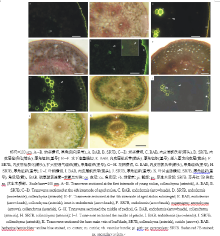 | 图2 天胡荽匍匐茎、花柄和叶柄的显微结构Fig.2 Photomicrographs of H. sibthorpioides stolon, pedicel, petiole and leaf blade |
老茎中, 表皮外角质层增厚; 表皮下厚角组织细胞壁进一步加厚, 细胞层数增加; 皮层内侧有具凯氏带的内皮层分化, 内皮层且栓质化; 维管束有次生木质部出现(图2C, D)。水淹下老茎与旱生的比较, 在皮层和髓部出现扩大型通气组织(图2E, F), 而旱生老茎内无通气组织。花柄的解剖结构和组织化学与老茎的类似, 但内皮层未栓质化; 厚角组织下数层细胞含叶绿体(图2G, H)。
旱生和水淹下天胡荽的叶解剖结构和组织化学相似, 叶柄由外而内及其特点依次为:表皮外有角质层, 表皮下为厚角组织; 厚角组织下数层细胞含叶绿体, 皮层, 皮层内方为3个相互独立的维管束, 内部为髓部(图2I, J); 每个维管束鞘细胞具凯氏带, 但未栓质化。叶片主脉中间为维管束, 维管束上下两侧为厚角组织, 最外为角质层, 主脉两侧叶片为叶肉细胞(图2K)。
天胡荽匍匐茎、花柄和叶具相似的质外体屏障结构, 一是有凯氏带且栓质化的内皮层, 二是表皮外角质层, 但花柄和叶柄有凯氏带的细胞, 并不栓质化; 叶片的质外体屏障仅为表皮外角质层。
在天胡荽的各发育阶段, 不定根、匍匐茎、花柄和叶的结构以初生结构为主, 除了匍匐茎和花柄维管束具次生结构。不定根的结构为二原型维管柱, 具有表皮, 皮层内侧细胞分化为内皮层, 外侧为外皮层。茎和花柄的结构为表皮、皮层, 皮层外侧为厚角组织、皮层内侧分化为内皮层, 初、次生维管束环状排列, 内部有髓。花柄厚角组织下数层细胞具叶绿体。叶柄的维管束散生, 厚角组织下数层细胞具叶绿体。叶片主脉中间为维管束, 上下两侧为厚角组织, 叶片具叶肉细胞。天胡荽与海边生长的药用同属植物H. umbellate[30], 在茎、花柄和叶片的解剖结构相似。
常见双子叶植物老根的维管柱后期有次生结构发育, 皮层脱落, 由维管柱鞘细胞发育而来的木栓层代替皮层的保护功能。而天胡荽不定根的皮层仅2层细胞, 皮层不脱落, 无通气组织; 也不同于常见湿地植物的根皮层具发达通气组织, 如水稻、芦苇(Phragmites australis)等[4, 7, 11, 12, 13, 14, 16, 17, 18]。
常见双子叶植物茎的次生木栓层代替皮层的保护功能, 天胡荽茎维管束具次生结构, 皮层内侧有内皮层分化, 表皮下有厚角组织。天胡荽茎在水淹胁迫条件下出现通气组织, 而湿地植物茎中通气组织为组成型[7, 9, 16, 17, 30]。
天胡荽不定根的质外体屏障由两部分组成, 内侧为具凯氏带且栓质化的内皮层, 外侧为具凯氏带且栓质化的外皮层和具扩散状栓质层的表皮细胞。植物根中内皮层都为单层细胞, 而外皮层随物种不同有单层、2层和多层细胞之分[6, 12]。天胡荽、红树林和亚马逊雨林耐淹植物幼根等的外皮层为单层细胞[31, 32], 而水稻、玉米(Zea mays)、芦苇、狗牙根(Cynodon dactylon)等的外皮层为2层和多层细胞[11-14, 16, 18]。此外天胡荽与双穗雀稗(Paspalum distichum)、玉米、菰(Zizania latifolia)等的不定根表皮具扩散状栓质层[18, 29, 33, 34]。尽管天胡荽不定根的外侧屏障结构为单层细胞外皮层和具栓质层的表皮细胞, 对天胡荽适应各种水湿环境具有重要的保护作用。
天胡荽匍匐茎和花柄具相似的质外体屏障结构为内侧的内皮层和表皮的角质层, 叶柄的维管束鞘细胞具凯氏带, 花柄和叶柄具凯氏带的细胞不栓质化, 叶片的仅为角质层。双穗雀稗、牛鞭草(Hemarthria altissima)、狗牙根和菰茎的屏障结构为外侧的角质层和表皮下栓质化和木质化的周缘厚壁层, 或者有内侧栓质化和木质化的厚壁组织, 双穗雀稗表皮下具凯氏带[7, 16, 18]。天竺葵茎的屏障结构为具凯氏带的木栓层[10], 香蒲属植物茎具内皮层[9], 水生毛茛的茎具内皮层, 叶柄散生维管束鞘细胞具凯氏带[15], 水稻中胚轴为散生维管束鞘细胞具凯氏带、第一节茎的内皮层和其厚壁组织内散生维管束鞘细胞具凯氏带[35]。天胡荽匍匐茎、花柄和叶的屏障结构是其忍耐多种水湿环境的重要特征。
天胡荽解剖结构主要为初生结构, 除了匍匐茎和花柄维管束具次生结构, 水淹诱导茎中形成通气组织。屏障结构包括不定根的内、外皮层和表皮栓质层; 茎和花柄的内皮层、叶柄具凯氏带的维管束鞘细胞和角质层。天胡荽的解剖结构和屏障结构特征是其适应多种水湿环境的结构基础, 是筛选适合用于三峡库区消落带生态修复植物的重要依据。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [1] |
|
| [2] |
|
| [6] |
|
| [7] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [34] |
|