作者简介:弋钦(1990-),女,陕西渭南人,在读硕士。E-mail:yiqin2008@163.com*通信作者Corresponding author. E-mail: weixh@gsau.edu.cn
本试验以紫花苜蓿种子为试验材料,添加外源一氧化氮供体硝普钠(SNP)、CaCl2及抑制剂亚甲基蓝(methylene blue, MB)和LaCl3,对种子进行浸种处理,以研究NO介导的Ca2+信号在干旱胁迫下紫花苜蓿种子萌发及抗氧化酶中的传导作用。结果表明,15%PEG胁迫下紫花苜蓿种子萌发受到明显抑制,当外源添加NO或Ca2+处理后萌发指标均有上升,外施0.1 mmol/L SNP或10 mmol/L CaCl2都能有效缓解PEG对紫花苜蓿种子的胁迫伤害。干旱胁迫下NO+Ca2+共处理时效果最为显著,萌发率较SNP处理提高了8.96%,较CaCl2处理提高了19.67%。共处理时比SNP、CaCl2处理时提高了种子淀粉酶活性、淀粉含量、可溶性糖、可溶性蛋白及脯氨酸含量,降低了MDA含量和超氧阴离子产生速率,显著提高了SOD,POD,CAT活性。其中淀粉酶活性、淀粉含量、可溶性蛋白、可溶性糖、脯氨酸含量以及POD活性的变化中,均表现出:NO和Ca2+共处理下各指标变化要慢于单一处理。当添加外源NO的同时添加Ca2+通道抑制剂La3+,NO的促进效果受到抑制,而添加外源Ca2+的同时添加NO抑制剂亚甲基蓝,Ca2+的促进效果受到抑制,表明NO经由Ca2+信号通路调控干旱胁迫下紫花苜蓿的信号传导。
The Ca2+ transduction pathways have been implicated in mediating stress response and tolerance in plants. In order to investigate the mechanism of Ca2+ signaling mediated by nitric oxide (NO) during seed germination and antioxidation in Medicago sativa under drought stress, sodium nitroprusside (SNP, nitric oxide donor), CaCl2, and methylene blue (NO blockers) and LaCl3 (Ca2+ channel blockers) were used in this study, and alfalfa seeds were pre-soaked with these solutions. An index of germination was markedly decreased under drought stress induced by 15% polyethylene glycol treatment, but this effect was reversed after treatments with SNP and Ca2+. Moreover, 0.1 mmol/L SNP or 10 mmol/L CaCl2 alleviated drought stress damage. Compared to SNP or CaCl2 treatment alone, germination rate significantly increased by 8.96% and 19.67% respectively when the seeds were treated with both SNP and Ca2+. Furthermore, both SNP and CaCl2 treatments increased content of starch, soluble sugar, soluble protein and proline, and activities of amylase, superoxide dismutase, peroxidase and catalase, whereas malondialdehyde content decreased compared to that under SNP or CaCl2 treatment alone. The changes were slower for seeds receiving both NO and Ca2+ treatments than for NO or Ca2+ treatment alone. Interestingly, with added exogenous Ca2+ and methylene blue, the promotional effect of Ca2+ was inhibited. In addition, the promotional effect of NO was inhibited by La3+. This indicates that NO mediated protein modifications in alfalfa seeds under drought stress through the Ca2+ signaling pathway.
紫花苜蓿(Medicago sativa)作为牧草之王, 在草地畜牧业生产中的地位无可替代。我国是苜蓿种植大国, 地处干旱半干旱区的甘肃省是苜蓿种植的第一大省, 约占全国种植面积的33%。长期以来, 在实际生产中, 因干旱胁迫等因素, 不仅导致苜蓿草产量和质量下降, 也限制了其规模化和产业化发展。同时, 西北地区种植的很多紫花苜蓿品种的抗旱能力普遍不高, 在灌溉不足的条件下难获高产。干旱环境下通常会引起一系列对植物细胞、器官或组织有害的生理影响, 如活性氧的堆积, 而氧化损伤会使细胞受损和新陈代谢发生紊乱[1]。
一氧化氮(NO)是一种短暂存在并具有高扩散性的气态生物活性分子, 是植物体中具有多种功能的信号物质[2, 3, 4]。NO在植物的生长及形态建成过程中均有参与, 如种子萌发、根生长、开花、休眠、衰老以及光形态的建成[5, 6, 7, 8, 9]; 而通过外源添加SNP(硝普钠, NO供体)提高植物内源NO含量可提高盐[10, 11]、干旱[12]、重金属胁迫[13]及冷害胁迫[14]下植物的抗逆性。NO处于激素诱导和生理反应的交叉点, 在植物体中, NO的产生包括酶促和非酶促两类途径, 酶促途径包括以L-Arg为底物的类一氧化氮合酶过程。信号调控过程中, NO可通过cGMP依赖途径, 调节cADPR改变胞浆内Ca2+浓度而调控各项生理反应[15]。而亚甲基蓝(methylene blue, MB)可使cGMP含量降低[16], 是鸟苷酸环化酶(gulanylatecyclase, GC)和一氧化氮合酶(NOS)的强效抑制剂[17]。有研究表明, NO通过诱导胞内Ca2+浓度升高而控制气孔的开闭[18], 并且植物细胞内NO的合成也依赖于Ca2+的存在[19], 在植物生理调控中NO与Ca2+之间存在着复杂的调控关系。而Ca2+作为一种大量元素, 同时也作为第二信使参与植物体内的许多生理生化过程, 具有稳定质膜结构, 激活NAD激酶、膜结合蛋白激酶及Ca-ATPase等许多激酶活性的作用[20]。
已知低浓度NO能够缓解干旱胁迫对种子萌发及生长的抑制作用, 但干旱胁迫下NO与Ca2+在紫花苜蓿种子萌发过程中是否存在调控关系并不清楚。为此, 本试验利用Ca2+抑制剂La3+及NO抑制剂MB, 对种子萌发过程中淀粉酶活性、淀粉含量、脯氨酸、可溶性糖、可溶性蛋白、MDA含量、
供试苜蓿品种为阿尔冈金(M. sativa cv. Algonquin), 购于甘肃农业科学院种子公司。千粒重为2.261 g。本试验于2013年11月-2014年6月在甘肃农业大学生命科学技术学院植物生理实验室进行。
参照牧草种子检验规程, 选取大小一致、饱满且无病虫害的种子, 用0.1% HgCl2溶液浸泡消毒3 min, 蒸馏水冲洗5~6次, 分别用蒸馏水、SNP、CaCl2、SNP+CaCl2、SNP+LaCl3、CaCl2+MB浸种48 h后(每皿加入10 mL处理液, 浸没种子, 培养皿中加盖浸种, 每隔24 h更换一次处理液), 将种子置于铺有两层滤纸9 cm培养皿中, 每皿放置40粒, 加入6 mL 15% PEG干旱胁迫, 即T0:蒸馏水(CK); T1:PEG; T2:0.1 mmol/L SNP+PEG; T3:10 mmol/L CaCl2+PEG; T4:0.1 mmol/L SNP+10 mmol/L CaCl2+PEG; T5:0.1 mmol/L SNP+10 μ mol/L LaCl3+PEG; T6:10 mmol/L CaCl2+5 μ mol/L MB+PEG。培养箱中(25± 1) ℃, 12 h光照/12 h黑暗恒温培养, 每组处理设置3个重复。分别在PEG干旱胁迫的第0、2、4、6天测定相关生理指标, 并做POD同工酶电泳。
1.2.1 种子发芽指标 以胚根0.2 cm作为萌发标志, 每天统计发芽数, 共7 d。第7天测定萌发率、发芽指数及活力指数。公式如下:
萌发率=(萌发种子数/供试种子总数)× 100%[21]
发芽指数(GI)=∑ (Gt/Dt)[22]
式中:Dt为日发芽种子数, Gt为与Dt相对应天数的发芽种子数。
活力指数(VI)=GI× 第7天正常幼苗平均鲜重[23]
1.2.2 生理指标测定 淀粉酶活性采用3, 5-二硝基水杨酸法测定[24]; 淀粉采用蒽酮比色法测定[25]; 脯氨酸含量采用茚三酮显色法[26]; 可溶性糖含量测定采用蒽酮法[25]; 可溶性蛋白采用考马斯亮蓝比色法测定[24]; MDA含量采用硫代巴比妥酸法测定[26];
1.2.3 POD同工酶分析 采用不连续系统聚丙烯酰胺凝胶垂直板电泳; 染色采用改良的联苯胺染色法[31]。
每组数据最少设定3个重复, 采用Microsoft Excel 2010整理分析数据, 采用SPSS 19.0进行方差分析比较差异显著。
表1可知, 干旱胁迫下紫花苜蓿种子的萌发率、发芽指数和活力指数均显著低于对照组(CK)。外源添加SNP或Ca2+处理后均可不同程度促进萌发。与干旱胁迫相比较, 添加外源NO处理, 种子的萌发率、发芽指数、活力指数分别提高了63.41%, 57.93%, 180.00%; 外源添加Ca2+处理时分别提高了48.78%, 37.11%, 80.00%。其中SNP处理下发芽率及活力指数显著高于Ca2+处理。SNP+Ca2+共处理比SNP处理时萌发率提高了8.96%, 发芽指数、活力指数分别降低了4.24%, 11.90%; 共处理比CaCl2处理萌发率、发芽指数、活力指数分别提高了19.67%, 10.52%和37.04%。当外源添加SNP的同时添加Ca2+通道抑制剂La3+后萌发率、发芽指数、活力指数分别比SNP处理降低了58.21%, 51.84%和61.90%; 而CaCl2+MB处理比CaCl2处理时萌发率、发芽指数和活力指数分别降低了49.18%, 36.95%和55.56%。
| 表1 外源NO与Ca2+对干旱胁迫下紫花苜蓿种子萌发的影响 Table 1 Effects of exogenous nitric oxide and Ca2+on seed germination of alfalfa seeds |
由图1可知, 干旱胁迫下紫花苜蓿种子萌发过程中淀粉酶活性随干旱胁迫时间的增加而降低, SNP、CaCl2及共处理均提高了干旱胁迫下淀粉酶活性; 第0天时SNP处理显著高于其他处理组; SNP+CaCl2处理与SNP处理相比较变化慢, 第6天时, 共处理下淀粉酶活性比干旱处理提高了43.94%, 比SNP、CaCl2预处理提高了20.37%和30.01%, 比添加抑制剂La3+和MB处理提高了95.61%和66.88%, 但又显著低于对照组(CK)。
种子萌发过程中淀粉含量呈现先增高后降低的趋势。干旱胁迫下种子淀粉含量均低于对照组(CK); SNP、CaCl2和SNP+CaCl2处理较干旱处理淀粉含量均显著增加, 添加La3+和MB则含量减少。第2天时各处理含量最高, 其中SNP处理最显著, SNP、CaCl2和SNP+CaCl2处理分别较干旱处理提高了20.92%, 6.59%, 12.99%; 第4、6天时SNP+CaCl2处理含量最高(CK除外), 比SNP处理增加了8.60%和9.25%, 比CaCl2处理增加了14.32%和22.10%。其中, 第4天时, SNP+La3+处理比SNP处理减少了35.27%, CaCl2+MB处理比CaCl2处理减少了23.17%, 其间差异显著。
可溶性糖含量变化与淀粉含量变化趋势一致, 呈现先增高后降低的趋势, 第2天时各处理含量均达到最大值, 其中SNP处理可溶性糖含量最高, 较干旱胁迫下增加了18.65%; 第4天时, SNP+CaCl2处理可溶性糖含量高于其他处理组, 较SNP处理提高了8.77%, 较CaCl2处理提高了22.82%。
可溶性蛋白含量先增高后降低, 干旱处理可溶性蛋白含量显著低于对照组(CK); SNP、CaCl2和SNP+CaCl2预处理均显著提高了干旱胁迫下苜蓿种子的可溶性蛋白含量, 而添加La3+和MB的处理组可溶性蛋白含量降低; 第2天时各处理均达到最大值, SNP、CaCl2和SNP+CaCl2处理比干旱处理下分别提高了28.80%, 33.28%, 22.11%, La3+和MB处理则降低了3.55%和4.40%; 第4天时共处理下效果最显著, 较SNP、CaCl2处理分别提高了9.06%和12.71%。
2.3 外源NO与Ca2+对干旱胁迫下紫花苜蓿种子萌发过程中脯氨酸、MDA含量和
从图2可看出, 脯氨酸含量变化呈现先增高后降低的趋势, 干旱胁迫下脯氨酸含量增加, 对照组(CK)变化缓慢。SNP、CaCl2和SNP+CaCl2处理脯氨酸含量均显著高于干旱处理, 2 d时SNP处理效果最显著; 第4天时各处理达到最大值, 共处理较SNP、CaCl2处理分别提高了9.90%和14.51%; SNP+La3+处理比SNP处理降低了26.99%, CaCl2+MB处理比CaCl2处理降低了20.90%。
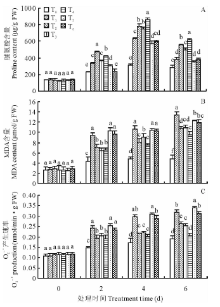 | 图2 外源NO对干旱胁迫下紫花苜蓿种子萌发过程中脯氨酸(A)、MDA含量(B)和 |
丙二醛含量随干旱胁迫时间的增加而升高, 干旱胁迫下丙二醛含量显著高于对照组(CK)。第6天时, SNP、CaCl2和SNP+CaCl2处理丙二醛含量分别比干旱处理减少了27.08%, 26.29%, 37.35%; La3+和MB处理抵消了促进作用, MDA含量比干旱处理分别减少了9.07%和11.86%。
干旱胁迫明显提高了超氧阴离子产生速率, 并且随干旱胁迫时间的增加超氧阴离子产生速率提高。第6天时SNP、CaCl2和SNP+CaCl2预处理后超氧阴离子产生速率均显著低于干旱处理, 分别降低了17.54%, 20.63%和35.46%, 而SNP+La3+处理比SNP处理提高了28.95%, CaCl2+MB处理则比CaCl2处理提高了23.32%。
如图3所示, SOD活性随着干旱胁迫时间的延长而增加, CK变化平缓, SNP、CaCl2和SNP+CaCl2处理SOD活性均显著高于干旱处理, 第6天时, SNP+CaCl2处理分别比SNP处理和CaCl2处理增加了2.72%和6.62%; SNP+La3+处理比SNP处理减少了11.98%, CaCl2+MB处理则比CaCl2处理减少了18.00%。
 | 图3 外源NO对干旱胁迫下紫花苜蓿种子萌发过程中SOD(A)、POD(B)和CAT(C)活性的影响Fig.3 Effect of exogenous NO on the SOD (A), POD (B) and CAT (C) activities in germinating alfalfa seeds under drought stress |
POD活性随着干旱胁迫时间的延长逐渐升高, CK变化缓慢, SNP、CaCl2和SNP+CaCl2预处理种子POD活性均显著高于干旱处理。第2天时CaCl2处理组POD活性最大, SNP、CaCl2和共处理之间比较差异不显著。第6天时各处理POD活性快速增加, 共处理比SNP处理和CaCl2处理分别提高了15.70%和10.71%; 添加La3+后比SNP处理降低了14.60%, 添加MB后比CaCl2处理组降低了12.57%。
CAT活性呈现先增高后降低的变化趋势(CK除外), SNP、CaCl2和SNP+CaCl2处理时CAT活性显著增加。2 d时差异最显著, SNP显著高于Ca2+处理; 第4天时CAT活性迅速上升并达到最大值, 其中SNP+CaCl2处理分别比SNP和CaCl2处理增加了20.30%和24.54%; 而添加La3+处理比SNP处理减少了14.54%, 添加MB处理则比CaCl2处理减少了9.05%。第6天时Ca2+处理下酶活性显著高于SNP处理。
表2中, 对各生理指标在干旱胁迫下不同处理和不同时间的多因素方差分析可知, 淀粉酶活性、淀粉含量、可溶性糖含量中, SNP和SNP+CaCl2互作处理较其他处理差异显著, 各处理在不同胁迫时间差异显著, 均呈降低的趋势, 第2天时, SNP处理和SNP+CaCl2处理下最优。可溶性蛋白含量中, SNP、CaCl2和SNP+CaCl2处理之间差异不显著而较其他处理差异显著。MDA含量和超氧阴离子产生速率中, SNP+CaCl2共处理显著低于其他处理组, 各处理在不同胁迫时间均差异显著, 且均呈现递增的变化趋势。脯氨酸含量中, SNP+CaCl2共处理显著优于其他处理, 而各处理在第4天时效果最佳。POD、SOD和CAT活性变化中, SNP+CaCl2共处理效果最佳, 各处理在不同时间均差异显著, 其中POD和SOD活性呈逐渐升高的变化趋势, 而CAT活性在第4天有最佳效果。
| 表2 不同处理、不同时间对干旱胁迫下紫花苜蓿种子生理指标的影响 Table 2 Effect of different treatments and different time on physiological index of alfalfa seeds |
图4所示, 共出现6条酶带, 其中A5为共有酶带, 干旱胁迫下A6酶带消失。其中, 1、8、15泳道均为CK对照, 随着萌发的进行, POD同工酶组分发生明显变化。其余泳道为干旱胁迫下不同处理POD酶条带。第4天时, 各处理中酶种类发生了显著变化, 干旱胁迫下酶带数多于CK处理。CK出现A1、A2酶带, 同时A3、A4酶带消失, A1颜色深, 酶带宽; 干旱胁迫下, 单一添加NO和Ca2+处理时均出现A1酶带, A3、A4酶带颜色变淡; 添加NO的同时添加La3+, A1酶带未出现; 添加Ca2+的同时添加MB处理, 无A1酶带, A4酶带变宽变深。而干旱胁迫下同时添加NO和Ca2+时, 仅出现A5酶带。
植物种子萌发阶段是对外界环境胁迫最为敏感的时期, 缺水或干旱胁迫下种子的萌发与幼苗的存活都会受到极大的影响[32]。萌发率、发芽指数和活力指数则可以反映种子的发芽能力[33]。使用SNP溶液预处理后可快速的增加外源NO含量, 进而调节植物生理机制来适应生物及非生物胁迫。本试验结果表明, 外源添加0.1 mmol/L SNP溶液预处理的紫花苜蓿种子在干旱胁迫下萌发率、发芽指数及活力指数显著提高, 萌发过程中淀粉酶活性、淀粉含量、可溶性蛋白及可溶性糖含量均有增加; 外源添加10 mmol/L CaCl2溶液得到相似结果, 其中SNP与Ca2+共处理下促进效果更显著, 并且在第4天时达到最大值(CK除外); 第2天时淀粉及可溶性糖在SNP处理下含量最高, 可溶性蛋白在第2天时Ca2+预处理组含量最高, 即SNP与Ca2+共处理时促进种子萌发的效果显著提高, 而生理应答反应较添加单一因素滞后; 添加NO和Ca2+的同时添加Ca2+抑制剂La3+和NO抑制剂MB后促进效果受到抑制。
干旱胁迫下, 植物体内生理代谢发生变化, 如活性氧的堆积, 会对植物体造成氧化损伤、细胞破坏, 最终导致细胞受损甚至死亡[34]。SNP预处理可以很大程度的增加抗氧化物质含量来缓解干旱胁迫[32], 而添加适宜浓度的外源Ca2+可提高内源Ca2+浓度, 提高抗氧化酶活性, 促进种子的萌发[35]。试验结果表明, 外源添加SNP可提高抗氧化酶SOD、CAT、POD活性和脯氨酸含量, 降低了MDA含量和
POD同工酶电泳试验中, 对照组CK随着萌发的进行, POD组分发生明显变化。4 d时酶种类变化差异显著, 对照组POD同工酶主要是较大分子酶蛋白的合成, 而干旱胁迫下酶的合成主要是在较小分子量的蛋白处。NO与Ca2+共处理时, 分子量小的A5条带下酶的合成增加, 较大分子量的蛋白酶的合成被抑制, 生理应答反应路径发生改变。第4天时共处理下POD活性最高, 而此时酶种类最少。添加抑制剂的处理组与SNP和Ca2+单独处理组相比较大分子量的酶蛋白未出现。可知, NO与Ca2+共处理时, 干旱胁迫下紫花苜蓿种子的调控路径发生改变, POD产物变单一, 其他分子量蛋白的合成受到抑制。当添加La3+和MB后, 大分子量酶带未出现, 酶带宽度发生改变。因此可知, 紫花苜蓿种子在受到干旱胁迫时, 胞质Ca2+参与了NO的信号传导来进行生理应答, 并且NO能够通过调节Ca2+通道提高胞质Ca2+浓度从而起到抗旱保护作用。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [11] |
|
| [15] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [31] |
|
| [33] |
|
| [35] |
|
| [36] |
|




