作者简介:段慧荣(1987-),女,山西长治人,在读博士。E-mail:duanhuirong514@163.com
盐地碱蓬在高盐生境中可以有效吸收K+,并维持细胞内K+浓度的相对稳定。高亲和性K+转运蛋白KT/HAK/KUP家族成员在植物K+吸收过程中发挥重要作用。本研究从盐地碱蓬中克隆到一个KT/HAK/KUP家族成员 HAK2的同源基因 SsHAK2,并对其进行生物信息学分析和表达模式分析。SsHAK2编码788个氨基酸,与不同植物的HAK2类蛋白具有较高的同源性(80%92%)。系统进化分析表明,SsHAK2属于KT/HAK/KUP家族亚族Ⅱ成员,与拟南芥AtKUP2位于同一进化分枝。实时定量qPCR分析显示, SsHAK2在盐地碱蓬的根和叶中均有高丰度表达,且叶中的表达丰度显著高于根中。 SsHAK2的表达受外界不同浓度K+ (2.5和0.01 mmol/L)的诱导。2.5 mmol/L K+处理下,根和叶中 SsHAK2的表达受25 mmol/L NaCl的显著诱导;0.01 mmol/L K+处理下,25和150 mmol/L NaCl的添加抑制根中 SsHAK2的表达,却显著促进其在叶中的表达。以上研究结果表明,SsHAK2可能参与盐地碱蓬K+吸收及转运过程,在根和叶中发挥不同的功能。
Suaeda salsa, a typical salt-accumulating halophyte, is capable of absorbing K+ with high efficiency, and thus maintains a relatively stable K+ level in cells, and grows well, even in highly saline soil. Members of the KT/HAK/KUP gene family have an important role in K+ uptake in plants. In this study, we cloned SsHAK2 in S. salsa and analyzed the expression patterns of SsHAK2 when the plants were exposed to different concentrations of KCl and NaCl. Results revealed that SsHAK2 coded for 788 amino acid residues and shared a high homology (80%-92%) with the identified members of KT/HAK/KUP family from other plants. Phylogenetic analysis showed that SsHAK2 belonged to a sub-group of the family known as group II, and formed a clade with AtKUP2 of Arabidopsis thaliana, indicating close relationship. SsHAK2 was highly expressed in roots and leaves, and was induced by widely differing K+ concentrations (2.5 and 0.01 mmol/L). Under 2.5 mmol/L K+ conditions, the expression of SsHAK2 in roots and leaves was induced by 25 mmol/L Na+ application. However, in the medium containing 0.01 mmol/L K+, the expression of SsHAK2 in roots was down-regulated by Na+ (25 and 150 mmol/L) application, but up-regulated in leaves. The results therefore indicate that SsHAK2 might mediate K+ uptake and transport in S. salsa, and functioned differently in roots and leaves.
K+是植物中含量最为丰富的阳离子, 也是植物生长发育所必需的营养元素, 占植物总干重的2%10%[1]。作为重要的无机渗透调节剂和酶促剂, K+在细胞渗透调节、膨压维持、细胞伸长、气孔运动、氮代谢、脂肪代谢、蛋白质合成及细胞膜的极化等过程中均发挥着重要作用[2]。土壤盐碱化是引起植物体内K+亏缺现象的主要非生物因素之一, 土壤中高浓度的Na+会限制植物体内K+的吸收和转运, 使植物生长受抑, 甚至死亡[3]。盐生植物在长期进化过程中形成了多种有效机制来抵御盐胁迫[4, 5, 6], 例如维持细胞内K+浓度的稳定。
盐地碱蓬(Suaeda salsa)又名蓬子菜、盐蒿, 是藜科碱蓬属一年生多汁草本盐生植物, 生于盐渍化土壤、湖滨、河岸和沿海地带[7]。盐地碱蓬的幼嫩茎叶营养丰富, 是很好的绿色蔬菜, 也可用作动物饲料, 其种子中富含不饱和脂肪酸和亚油酸等, 可压榨食用油, 具有很好的经济价值; 盐地碱蓬在盐碱地的改良、污染地的植被修复和有毒金属的吸附方面效果显著, 具有很好的生态价值[8]。盐地碱蓬可在400 mmol/L的盐浓度下完成其生活史, 是典型的盐碱地指示植物, 它通过将根部吸收的大量Na+运输至地上部并区域化进液泡以减轻Na+毒害, 也是极具代表性的积盐型植物[9]。Mori等[10]的研究发现, 盐地碱蓬K+、Na+选择性吸收能力(SAk)随外界NaCl浓度(550 mmol/L)的增加显著提高, 且植株体内K+吸收速率和K+浓度能维持相对稳定。可见, 有效吸收K+并维持体内K+浓度的相对稳定可能是盐地碱蓬适应高盐生境的重要策略之一。
大量研究表明, KT/HAK/KUP转运蛋白、HKT转运蛋白和Shaker K+通道主要参与植物根系K+吸收过程[11]。Shao等[12]研究发现, 盐地碱蓬HKT转运蛋白家族成员SsHKT1; 1参与根系K+吸收过程, 在盐胁迫下维持植株体内K+营养稳态, 从而提高植物耐盐性。此外, Duan等[13]克隆并鉴定了盐地碱蓬Shaker K+通道成员SsAKT1, 推测其可能参与盐地碱蓬根中的K+吸收过程, 并在耐盐性中发挥重要作用。可见, 盐地碱蓬体内存在多基因网络调控的K+吸收途径, 然而, KT/HAK/KUP家族成员的相关研究尚未见报道。
植物KT/HAK/KUP家族蛋白具有高亲和转运K+的特性, 与细菌中的K+吸收透性酶KUP及真菌中的高亲和性K+转运蛋白HAKs的同源性极高, 最早从大麦(Hordeum vulgare)中克隆到了该家族成员HvHAK1[14]。在植物中, KT/HAK/KUP家族成员能够恢复酵母或细菌K+吸收缺陷突变体的K+吸收, 在植物根和地上部K+稳态平衡中发挥重要作用[15]。此外, 亦有研究表明, KT/HAK/KUP家族部分成员可以介导Na+从土壤进入植物根部[16, 17]。Wang等[16]的研究发现, 拟南芥根中仅存在AtHKT1; 1和AtHAK5两条主要的低亲和性Na+吸收途径, 且当AtHKT1; 1功能丧失后, AtHAK5成为唯一主要的低亲和性Na+吸收途径, 并且在低K+条件下, 其作用更为重要。Zhang等[17]对海滨碱蓬(Suaeda maritima)的研究发现, KT/HAK/KUP家族可能参与95200 mmol/L Na+条件下的植株根系低亲和性Na+吸收过程。可见, KT/HAK/KUP家族成员在植物K+、Na+吸收及转运过程中可能发挥重要作用。
本研究以盐地碱蓬为材料, 克隆KT/HAK/KUP家族成员基因SsHAK2的cDNA全长并对其进行生物信息学分析, 采用实时定量qPCR的方法分析SsHAK2在不同浓度K+ (0.01和2.5 mmol/L)和NaCl (25和150 mmol/L)处理下的表达模式, 以期为进一步研究SsHAK2的功能提供分子基础。
2013年3月, 挑选籽粒饱满无缺损的盐地碱蓬种子, 用蒸馏水冲洗23遍, 在直径9 cm的培养皿上铺滤纸润湿后播种于其上, 种子密度约为4粒/cm2, 28℃下催芽, 待发芽后, 挑选均匀一致的幼苗移至装有灭菌红沙的塑料穴盘(5 cm× 5 cm× 5 cm)中, 4株/穴, 在温室中浇灌调整后的Hoagland营养液进行植物材料培养。调整后的Hoagland营养液(pH=5.7)包括2 mmol/L KNO3, 0.5 mmol/L KH2PO4, 0.5 mmol/L MgSO4· 7H2O, 0.25 mmol/L Ca(NO3)2· 4H2O, 1.25 mmol/L CaCl2· 2H2O, 0.06 mmol/L Fe-citrate, 50 μ mol/L H3BO3, 10 μ mol/L MnCl2· 4H2O, 1.6 μ mol/L ZnSO4· 7H2O, 0.6 μ mol/L CuSO4· 5H2O, 0.05 μ mol/L Na2MoO4· 2H2O。温室的昼夜温度为(28± 2)℃/(23± 2)℃, 光照16 h/d, 光强度约600 μ mol/(m2· s), 相对湿度60%80%。
3周龄盐地碱蓬幼苗用0.01 mmol/L KCl处理6 h后取样, 参照Trizol试剂盒说明书(上海生工)从根中提取总RNA, 按照PrimeScriptTM 1st strand cDNA Synthesis Kit反转录试剂盒说明书(大连宝生物)合成cDNA第1链。通过对已知植物的HAK2类核苷酸序列进行同源性比较, 找出高度保守区域, 根据同源性高和简并性低的原则, 利用DNAMAN和Primer 6.0软件设计1对简并引物P1和P2 (表1), 用于扩增盐地碱蓬HAK2基因核心片段, 推测目的片段的长度为474 bp。根据已测得的核心片段序列设计5'端特异引物P3 (外侧引物)、P4(巢式引物) (表1)及3'端特异引物P5 (外侧引物)、P6 (巢式引物) (表1), 分别与GeneRacerTM试剂盒(Invitrogen, USA)提供的5' Primer (5' P)、5' Nested Primer (5' NP)及3' Primer (3' P)、3' Nested Primer (3' NP)配对, 用于外侧和巢式PCR扩增, 推测5'cDNA和3'cDNA碱基序列的长度约为801 bp和1250 bp左右。引物由上海生工生物工程有限公司合成。PCR扩增反应体系:在200 μ L PCR管中依次加入10× PCR Buffer 5 μ L、25 mmol/L MgCl2 3.5 μ L、10 mmol/L dNTP 1 μ L、10 μ mol/L P1 1 μ L、10 μ mol/L P2 1 μ L、Taq DNA polymerase (5 U/μ L) 0.5 μ L、cDNA 2 μ L, 加纯水至50 μ L。核心片段PCR反应条件:94℃预变性2 min; 94℃变性30 s、56℃退火50 s、72℃延伸50 s, 30个循环; 最后72℃延伸10 min; 5'-RACE的PCR反应条件:94℃预变性2 min; 94℃变性30 s、58℃退火50 s、72℃延伸80 s, 30个循环; 最后72℃延伸10 min; 3'-RACE的PCR反应条件:94℃预变性2 min; 94℃变性30 s、58℃退火50 s、72℃延伸130 s, 30个循环; 最后72℃延伸10 min; PCR扩增产物用1.2%的琼脂糖凝胶检测, 目的片段的回收和纯化按照UNIQ-10柱式DNA胶回收试剂盒(上海生工)操作说明进行。回收的PCR产物连接到TransTM T5载体, 转化TransTM 1-T1感受态细胞, 送至上海生工测序。将这些片段拼接得到了SsHAK2的全长cDNA。
| 表1 引物序列 Table 1 The sequences of primers |
在NCBI (www.ncbi.nlm.nih.gov/BLAST)网站上, 将测序得到的SsHAK2基因序列和氨基酸序列与GenBank数据库中序列进行Blastn和Blastp分析; 序列的翻译、开放阅读框分析在DNAMAN 6.0生物软件上进行, 氨基酸序列与其他序列的同源比较用Bioedit软件进行, 氨基酸的跨膜区预测用在线生物学软件TMHMM (http://www.cbs.dtu.dk/services/TMHMM/)进行。系统进化树用MEGA 6.0软件的最大似然法(Maximum likelihood method)进行构建。
采用实时定量qPCR方法分析盐地碱蓬SsHAK2的表达模式。材料处理方案如下:(1) 正常K+加盐处理:待盐地碱蓬幼苗生长至30 d, 向Hoagland营养液中加25或150 mmol/L NaCl处理0, 6, 24 h。(2) 低K+ (0.01 mmol/L)加盐处理:待盐地碱蓬幼苗生长至23 d时, 转入低K+ (0.01 mmol/L) (2 mmol/L KNO3用2 mmol/L HNO3代替, 0.5 mmol/L KH2PO4用0.5 mmol/L H3PO4代替, 加入0.01 mmol/L KCl, 用1 mol/L Tris调整营养液pH值为5.7)营养液中处理7 d, 随后向低K+ Hoagland营养液中加入25或150 mmol/L NaCl处理0, 6, 24 h。处理液每天更换。处理结束后, 分别收集根和叶, 经无菌水冲洗后, 置于消毒滤纸上迅速吸干表面水分, 于液氮中快速冷冻用于RNA的提取。不同处理下盐地碱蓬根和叶总RNA的提取参照Trizol试剂盒说明书(上海生工)进行, 按照PrimeScriptTM RT Master Mix (Perfect Real Time)试剂盒操作说明(大连宝生物)合成cDNA第1链。荧光定量qPCR反应在ABI 7500荧光定量PCR仪(ABI, America)中进行, 用于表达分析的特异性引物由大连宝生物工程有限公司设计, 分别为P7和P8 (表1), 待扩增目的片段长度为155 bp, 以SsACTIN (GenBank登录号为EU429457)为内参基因, 引物为A1和A2 (表1), 待扩增目的片段长度为111 bp。PCR反应条件如下:95℃ 30 s, 40个循环(95℃ 5 s, 60℃ 34 s)。采用2-△ △ ct法[18]计算SsHAK2的相对表达量, 以无处理的根样作为对照。每个处理设3个重复, 每个样品重复3次。
采用SPSS 17.0对数据进行分析, 运用Duncan多重比较进行差异显著性分析, 最小差异显著性水平为P< 0.05。用Excel 2010、MEGA 6.0等软件作图。
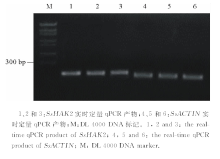
以总RNA反转录所得到的第1链cDNA为模板, 利用简并性引物P1和P2进行RT-PCR扩增。扩增产物经凝胶电泳检测发现约在474 bp处有1条亮带, 且上下无杂带(图1a), 测序结果经BLAST检测表明该cDNA片段与其他高等植物的HAK2序列具有较高的同源性(78%88%), 其中与空心莲子草(Alternanthera philoxeroides) ApKUP2基因(GenBank登录号:JN635515)核苷酸序列的同源性高达88%, 可见该片段是盐地碱蓬HAK2类基因片段。根据此核心片段进一步设计了特异引物进行5'端和3'端的RT-PCR扩增, 分别得到801 bp的5'RACE产物和1250 bp的3'RACE产物(图1b和c), 将5'端、核心片段和3'端的序列进行拼接, 得到全长2890 bp的cDNA (图2)。该cDNA包含一个228 bp的5'非翻译区(5'UTR)、2367 bp的开放阅读框(ORF)以及296 bp的3'非翻译区(3'UTR), 有12个高度保守的跨膜区 (图3), 编码788个氨基酸, 推测其分子量为107.3 kDa。本研究将其命名为SsHAK2。
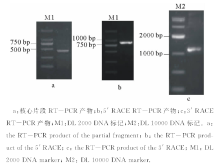 | 图1 盐地碱蓬SsHAK2基因RT-PCR产物电泳检测图Fig.1 Agarose gel electrophoresis analysis of RT-PCR products of SsHAK2 in S. salsa |
 | 图2 盐地碱蓬K+转运蛋白SsHAK2的cDNA核酸序列及其推测的氨基酸序列Fig.2 Nucleotide sequences and deduced amino acid residues of SsHAK2 in S. salsa |
多重比较分析结果表明, 盐地碱蓬SsHAK2与其他植物的HAK2类转运蛋白具有很高的同源性(图4), 其中与甜菜(Beta vulgaris)、空心莲子草、冰叶日中花(Mesembryanthemum crystallinum)和葡萄(Vitis vinifera) HAK2的同源性分别为92%, 87%, 86%和80%。系统进化分析进一步表明, SsHAK2属于KT/HAK/KUP家族的亚族Ⅱ 成员, 与拟南芥AtKUP2、AtKUP6和AtKUP8的进化关系较近, 而与其他亚族成员的进化关系较远(图5)。
 | 图4 盐地碱蓬SsHAK2与其他植物HAK2类氨基酸的多重比较Fig.4 Sequence alignment of SsHAK2 in S. salsa with HAK2-like proteins from higher plants |
将合成的盐地碱蓬cDNA用特异性表达引物P7和P8、A1和A2进行实时定量qPCR, 得到SsHAK2和SsACTIN的qPCR反应产物, 经电泳检测, 条带单一, 无引物二聚体(图6), 表明引物的特异性较高, 反应条件较好, 可用于SsHAK2的表达模式分析。
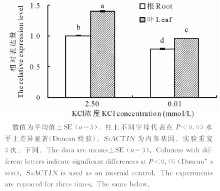
组织特异性分析结果表明, SsHAK2在盐地碱蓬根和叶中均有高丰度表达, 在不同浓度K+条件下, 叶中的表达量显著高于根中(图7)。此外, 不同浓度K+ (0.01和2.5 mmol/L)处理均诱导SsHAK2的表达, 但2.5 mmol/L K+处理下SsHAK2的表达显著高于低K处理(0.01 mmol/L) (图7)。
进一步分析不同浓度K+下添加NaCl对SsHAK2表达的影响, 结果见图8。在含有2.5 mmol/L K+的介质中, 根和叶中SsHAK2的表达受25 mmol/L NaCl处理的显著诱导, 且随处理时间延长, 分别在24和6 h处表达量达到最高, 较各自对照(0 h)增加了25%和169%; 高Na+ (150 mmol/L)处理对根中SsHAK2的表达无影响, 但抑制了叶中的表达(图8A和B)。0.01 mmol/L K+条件下, 25和150 mmol/L NaCl的加入均抑制根中SsHAK2的表达, 且随处理时间延长, 在24 h处表达量较对照(0 h)分别降低38%和58%; 然而, 25和150 mmol/L NaCl的加入使叶中SsHAK2的表达显著增加, 且在处理6 h后, 较对照(0 h)分别增加了80%和51% (图8C和D)。以上结果表明, SsHAK2的表达受介质中K+和Na+的共同调节。
迄今为止, 已经从很多植物如大麦[14]、玉米(Zea mays)[19]、胡椒(Piper nigrum)[20]、冰叶日中花[21]、葡萄[22]、番茄(Solanum lycopersicum)[23]等中克隆到KT/HAK/KUP家族部分成员基因, 然而, 该家族的结构仍未研究清楚。虽然KT/HAK/KUP家族并不具备完全相同的功能保守域, 但在氨基酸序列上都含有1个明显的特征GVVYGDLGTSPLY (加粗字母为在所有基因中都十分保守)[24]。本研究得到的SsHAK2氨基酸序列中同样包含这一保守序列(图4)。此外, Gupta等[25]的研究发现, 水稻KT/HAK/KUP家族成员(除OsHAK22外)中都含有3个很保守的区域, 经过对比, 在盐地碱蓬中, 同样有这样的保守区域存在(图2), 表明SsHAK2与水稻中这些蛋白的结构和功能可能存在相似之处。研究表明, 高等植物中KT/HAK/KUP家族蛋白成员含有1014个跨膜区域[26]。经过TMHMM在线软件分析可见, SsHAK2含有12个跨膜区(图3), 与大麦和水稻等中的研究结果一致。KT/HAK/KUP家族根据系统发生分析可划分为4个亚族:亚族Ⅰ 包括拟南芥AtHAK5、水稻OsHAK1和大麦HvHAK1等, 主要介导高亲和性K+转运过程; 大麦HvHAK2、拟南芥AtKUP1和AtKUP2属于亚族Ⅱ 成员, 在单子叶植物中经常转运低亲和性K+吸收, 而在双子叶植物中表现出不同的转运活性[24]; 亚族Ⅲ 和Ⅳ 成员的研究相对较少。本研究中, 我们将拟南芥13个和水稻27个KT/HAK/KUP家族成员与盐地碱蓬SsHAK2进行了系统进化分析(图5), 结果显示, SsHAK2属于亚族Ⅱ 成员, 与拟南芥AtKUP2、水稻OsHAK8和OsHAK9位于同一进化分枝, 表明SsHAK2可能具有与AtKUP2等类似的K+转运功能和特征。以上结果均表明, 本研究克隆到的SsHAK2编码KT/HAK/KUP家族K+转运蛋白。
Ahn等[27]对拟南芥KT/HAK/KUP家族13个成员进行组织表达特异性分析发现, 亚族Ⅱ 基因成员AtKUP1、AtKUP2、AtKUP4、AtKUP6和AtKUP8在根和叶中均有高丰度表达。Su等[21]发现, 亚族Ⅱ 基因成员McHAK1和McHAK4在冰叶日中花根、茎叶中有高丰度表达。与这些结果相一致, 本研究中, SsHAK2在盐地碱蓬的根和叶中均表达(图7), 表明其可能在根和叶中发挥重要的作用。研究表明, KT/HAK/KUP家族的亚族Ⅱ 成员在不同的双子叶植物中表现出不同的转运活性。Rigas等[28]发现, AtKUP4介导拟南芥高亲和性K+吸收过程。然而, AtKUP6和AtKUP2则被证实介导拟南芥低亲和性K+吸收过程[27, 29]。更有趣的是, AtKUP1介导兼性K+吸收过程, 在酵母K+吸收缺陷突变株中表达时, 于不同K+浓度条件下均增加菌株的K+吸收能力, 当外部K+浓度在100200 μ mol/L之间时发生从高亲和性到低亲和性K+吸收的相变[30]。然而, Osakabe等[31]对拟南芥三突变体atkup2/6/8的研究发现, KT/HAK/KUP家族的亚族Ⅱ 成员AtKUP2、AtKUP6和AtKUP8可能参与拟南芥的K+外流过程。本研究中, 0.01和2.50 mmol/L K+处理均诱导根和叶中SsHAK2的表达(图7), 表明SsHAK2在盐地碱蓬体内K+吸收及转运过程中可能发挥重要作用。
Li等[32]在研究K+营养对盐胁迫下盐地碱蓬幼苗生长影响的过程中, 发现100和400 mmol/L NaCl处理下, 提高介质中K+浓度可明显增加植株的水分、干鲜重、生长速率, 表明K+对盐地碱蓬的耐盐性至关重要。本研究初步分析了不同浓度K+和Na+处理下盐地碱蓬SsHAK2表达模式的变化(图8)。不同浓度Na+处理对盐地碱蓬SsHAK2表达的影响受介质中K+浓度的调节(图8), 表明SsHAK2可能参与盐处理下的盐地碱蓬体内K+吸收及转运过程。Rubio等[33]对拟南芥的研究发现, K+缺失引起根中AtHAK5的表达下调, 却显著增加其在叶中的表达, 可见, AtHAK5可能在不同的组织部位中发挥不同的作用, 但是具体的原因尚不清楚。Su等[21]研究发现, 高盐处理(400 mmol/L Na+)显著诱导冰叶日中花McHAK1和McHAK4的表达, 利用原位杂交在成熟根和叶的脉管组织中观测到极强的McHAK1和McHAK4的杂交信号, 推测它们可能会通过脉管组织中的装载/卸载影响植物K+的长距离运输, 从而调节根中的K+吸收过程。本研究中, 低K+ (0.01 mmol/L)条件下, 不同浓度Na+ (25和150 mmol/L)的添加抑制盐地碱蓬根中SsHAK2的表达, 却显著诱导叶中SsHAK2的表达; 2.5 mmol/L K+处理下, 不同浓度Na+ (25和150 mmol/L)的添加也引起根和叶中SsHAK2表达的变化不同。我们推测, 盐处理下, SsHAK2在盐地碱蓬根和叶中发挥不同的功能, 且可能在叶中发挥的作用更大, 具体机制有待更深一步研究。
综上所述, SsHAK2编码KT/HAK/KUP家族K+转运蛋白, 在根和叶中均有高丰度表达, 转录丰度受外界K+和Na+浓度的调节, 可能参与盐地碱蓬体内K+的吸收和转运过程, 且根和叶中可能发挥不同的功能。该研究为进一步分析SsHAK2在盐地碱蓬中的功能提供了分子基础。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [32] |
|