作者简介:袁进成(1970-),男,河北张家口人,副教授。E-mail: nkxyjc@163.com。宋晋辉(1978-),女,河北安国人,硕士。E-mail: nkxsjh@163.com。**共同第一作者These authors contributed equally to this work.
ABI3 (abscisic acid insensitive 3) 是编码 ABA 信号转导途径中的重要调控因子,广泛地存在于玉米、小麦、水稻等谷类作物中。本研究从玉米中获得一个新的 ABI3-like 基因,命名为 ZmABI3 -L,该基因全长1735 bp,开放阅读框1212 bp,编码蛋白含404个氨基酸。同源比对表明ZmABI3-L和谷子、高粱的同源蛋白相似性高,分别为64%和58%。基因的表达分析表明该基因是组成型表达,在幼胚、穗子和花丝中表达量较高,同时基因的转录水平可以为盐、ABA、干旱和冷所诱导。将 ZmABI3 -L基因转化到拟南芥中,对T3代转 ZmABI3 -L基因拟南芥进行抗逆性分析,结果显示 ZmABI3 -L基因可以增强拟南芥的耐盐和抗旱能力。在150 mmol/L高盐培养基中转基因拟南芥的根和茎长度分别为对照的 8.6 和 1.4 倍,在50 mmol/L甘露醇的渗透培养基中转基因植株的发芽率是74.5%,而对照仅为 33.6%。研究表明 ZmABI3 -L是一个对干旱和盐损伤均有响应而显著上调的基因,同时该基因可以增加拟南芥的抗旱和耐盐性。
The abscisic acid insensitive 3 gene ( ABI3) has been widely studied in cereals such as wheat, maize and rice however, the functions of ABI3 have not been fully described. In this paper, a novel maize ABI3 like gene was cloned and named ZmABI3 -L. This gene was predicted to encode a transcription factor with a distinct DNA-binding B3 domain. The full length of the gene was 1735 bp and with an opening read frame of 1212 bp and encoded 404 amino acids. Alignment of the ZmABI3-L proteins with other plants revealed similarities with ABI3 protein from other species. RT-PCR analysis showed ZmABI3 -L was up-regulated in maize by dehydration, salt, cold and ABA stress. Over-expression of ZmABI3 -L in Arabidopsis plants could enhance salt and drought stress tolerance compared to the wild type. The results suggest that ZmABI3 -L may be involved in salt and drought resistance signaling pathways in maize.
Abscisic acid insensitive 3 (ABI3) 属于具有 B3 结构域(B3 domain-containing protein family)基因家族的亚家族, 是参与ABA信号转导途径的重要信号因子[1]。ABI3家族基因最早在玉米中发现并命名为VP1, 该基因和拟南芥的ABI3基因为同源基因, 参与种子萌发调控、植物的生长和发育以及植物应答逆境胁迫反应等多种生命过程[2, 3]。ABI3蛋白含有4个结构域, 分别为A1、B1、B2和B3结构域, 其中A1结构域在酸性的N基末端, 是一个富含酸性蛋白的转录激活结构域; B1结构域可以结合ABI5、bZIP10、bZIP25和TRAB1等bZIP类转录因子; B2结构域结合G-box因子(CACGTG)或者ABA应答因子, 在参与细胞核定位和转录激活中起重要的作用; B3结构域在体外结合RY基序(CATGCA)[4, 5]。在拟南芥(Arabidopsis thaliana)中获得许多abi3突变体, 其中abi3-5的表型明显, 植株表现明显的持绿性。abi3-5种子对ABA敏感, 在种子萌发期表型显著, 和玉米(Zea mays)的vp1突变体一样也表现了早熟的特性。在拟南芥中表达ABI3增加了At2S3, AtCRC, AtEM1, AtSOM和AtEM6的表达量, 35S:ABI3转基因种子对ABA更加敏感[6]。
ABI3广泛地存在于多种植物中, 如玉米、拟南芥、小麦(Triticum aestivum)、燕麦(Avena sativa)和水稻(Oryza sativa)中均有发现, Wang等[7]通过生物信息学手段搜寻11个物种的B3家族基因, 结果显示ABI3虽然广泛存在, 但是含量较B3家族其他基因要少得多:如拟南芥中B3家族基因95个, 而ABI3家族仅具有3个, 棉花(Gossypium hirsutum)B3家族基因130个, ABI3家族具有3个, 高粱(Sorghum bicolor)B3家族基因80个, ABI3家族具有4个, 柑橘(Citrus reticulata)B3家族基因42个, ABI3家族具有5个。Wang等[7]在玉米基因组中搜索到81个B3基因, 其中ABI3基因仅有4个, Reidt等[8]仅在玉米中发现5个ABI3基因, 由上可见玉米中的ABI3基因不多, 而且多数的基因功能还未知[7, 8]。本课题获得玉米中一个新的ABI3基因, 并深入研究基因的功能, 可以为综合了解玉米ABI3基因的功能提供一些参考信息。
玉米自交系综31于2013年在河北北方学院农场种植, 正常田间管理。收集不同时期的组织, 液氮中迅速保存供后续RNA和DNA的提取。提取RNA和DNA的材料包括出苗10 d幼苗的根、茎、叶, 以及授粉期的花丝、穗子和授粉15 d的幼胚。拟南芥(哥伦比亚品种)由本实验室保存, 在光照培养箱中种植。
因为ZmABI3-L基因的一段EST序列是从玉米苗期干旱胁迫的cDNA文库获得, 为研究该基因是否响应逆境胁迫, 做了如下胁迫处理。将适量的水和蛭石搅拌均匀后装入花盆, 播种玉米, 盖上保鲜膜, 置温室培养。将发育10 d的幼苗转移到发芽盒中在水培条件下培养半天后, 再分别移入相应溶液中进行胁迫处理, 在不同时间点取样, 处理时间分别为0, 0.5, 1, 3, 6, 12, 18, 24和48 h, 收集玉米幼苗液氮中速冻保存供提取RNA用。不同胁迫处理液分别为(1)ABA(脱落酸)处理:加100 μ mol/L ABA溶液; (2)盐处理:加入250 mmol/L NaCl; (3)干旱处理:加入20%PEG(聚乙二醇); (4)低温处理:将生长在盆中的幼苗直接放在4℃冰箱中培养, 取材时间点同上。
根据NCBI提供的信息(GenBank:XM_008665221.1), 设计扩增ZmABI3-L基因的引物, 正向引物:5'-CATCCAACAGGGACAGGCAG-3', 反向引物:5'-GGTAGCGACGGAAGGAAGAA-3'。以玉米幼苗cDNA为模板, 利用pfu Taq mix (天根)进行PCR扩增, 20 μ L反应体系中包括10 μ L pfu Taq mix, 1 μ L cDNA, 正向引物和反向引物各1 μ L (10 μ mol/L), 7 μ L ddH2O。扩增条件为95℃变性 3 min, 随后35个循环, 循环条件为:95℃ (30 s), 59℃ (30 s), 72℃ (1 min), 循环后72℃延伸 5 min, 3次扩增结果进行测序。同时设计构建载体引物引入相应酶切位点, 正义:5'-ATCCccatggGACAGGCAG-3'(NcoⅠ 位点), 反义:5'-GGTggtgaccGAAGGAAGAA-3'(BstE II位点), 酶切PCR产物, 同时用相应的酶酶切植物表达载体pCAMBIA1300, 将基因连接到植物表达载体上, 在35S启动子驱动下表达。
利用RT-PCR分析基因在不同组织的表达量, 设计基因的特异性引物, 正义:5'-CGGGTCAAATACAGTCACACA-3'和反义:5'-CTCCTGCTCTTCCTCCTCTTT-3', 扩增出约380 bp的基因特异性片段, 同时扩增350 bp的玉米actin基因作为内参, 引物为正义:5'-CAGCAACTGGGATGATATGG-3', 反义:5'-ATTTCGCT TTCAGCAGTGGT-3'。利用pfu Taq mix (天根)进行PCR扩增, 20 μ L反应体系中包括10 μ L pfu Taq mix, 1 μ L cDNA, 正向引物和反向引物各0.5 μ L (10 μ mol/L), 8 μ L ddH2O。扩增条件为95℃变性 3 min, 随后28个循环, 循环条件为:95℃(30 s), 57℃ (30 s), 72℃ (1 min), 循环后72℃延伸5 min, 在1%凝胶电泳检测基因的表达情况。
利用real-time PCR研究基因的诱导表达特性, 在荧光定量PCR仪上分析(PTC200), 所用的引物为:正义:5'-CGGGTCAAATACAGTCACACA-3'和反义:5'-CTCCTGCTCTTCCTCCTCTTT-3', 同时扩增350 bp的玉米actin基因作为内参(引物同上), 利用High Capacity cDNA Reverse Transcription Kits及Power SYBR Green PCR Master Mix(ABI公司)试剂。20 μ L反应体系中包括10 μ L Power SYBR Green PCR Master Mix, 1 μ L cDNA (稀释后), 正向引物和反向引物各0.5 μ L (10 μ mol/L), 8 μ L ddH2O。采用的Real-time PCR程序为95℃ 30 s预变性, 40个扩增循环(95℃ 10 s, 59℃ 30 s), 从59℃加热到90℃的熔解过程, 每个样品设3次重复。
于2014年采用花序浸染法转ZmABI3-L基因到拟南芥中[9]。将T1代种子表面消毒后均匀铺洒在含有25 mg/L潮霉素的MS培养基上, 置22℃光照(光周期为16 h光照/8 h黑暗)生物培养箱中培养。选取正常生长15 d的幼苗移栽到培养土中继续生长直到收获种子, 结合PCR扩增验证, 共筛选2代直到得到纯合的转基因株系。RT-PCR对ZmABI3-L基因特异性引物进行扩增, 同时actin基因做内参(方法和引物同1.3)。选取ZmABI3-L基因表达量高的T3代纯合转基因拟南芥种子和野生型拟南芥种子点播在含有不同浓度的NaCl(0, 50, 100和150 mmol/L)和甘露醇(50 mmol/L)的MS固体培养基上, 以不含渗透剂的MS培养基培养对应种子为对照(CK), 每培养皿培养约50粒种子, 测定种子发芽率、幼根和幼茎的长度, 重复3次。
基因生物信息学分析用NCBI数据库和玉米基因组数据库(http://www.ncbi.nlm.nih.gov/BLAST/, http://www.maizesequence.org/index.html和http://maizegdb.org)。基因的进化树分析和同源性比对采用DNAMAN软件, 基因的保守位点和3维结构的构建利用swiss-modle软件。
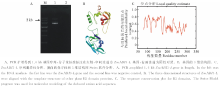
前期, 通过构建玉米苗期干旱胁迫的cDNA文库, 获得一段456 bp的EST序列, 用该序列在NCBI和玉米基因组数据库中查询[10]。结果表明玉米B73一段cDNA (XM_008665221.1)和我们获得的EST有99%的相似性, 同源搜寻显示该序列为ABI3-like基因, 属于B3家族ABI3亚家族, 查询结果显示该基因为一个新的ABI3基因, 目前还没有研究报道, 故设计引物, 扩增基因的全长, 并将该序列命名为ZmABI3-L, 进行深入研究。ZmABI3-L基因全长1735 bp, 开放阅读框1212 bp(图1A), 编码蛋白质大小为404 AA, 蛋白质分子量43.35 kD。通过蛋白质数据库(swiss-modle)对获得的ZmABI3-L蛋白进行保守位点和蛋白质结构预测, 蛋白的3维结构显示ZmABI3-L主要是螺旋-折叠-螺旋的结构(图1B)。同时, 我们研究了基因的序列趋异性, 与其他已知的ABI3蛋白进行比较, 从图中可见, 该蛋白保守性较低, 和其他的ABI3有很多的差异性残基, 这也意味着不同的ABI3基因具有不同的功能, 其功能差异也很大(图1C)。
同源查询及聚类分析表明 ZmABI3-L蛋白与谷子及高粱的ABI3蛋白相似性高, 聚在一起, 与谷子的同源蛋白(XM_004976535)相似性为64%, 和高粱的同源蛋白(XM_002448339)相似性为58%, 与大麦(Hordeum vulgare)的同源蛋白(AK374546)相似性为52%, 同时该蛋白和水稻的两个同源蛋白(XM_006647631和NM_001187130)、大麦(FP096459)、柏树(Selaginella moellendorffii)(XM_002991492)的同源蛋白具有较高的相似性(图2)。
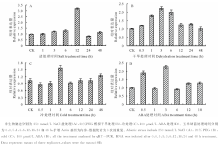
RT-PCR研究基因在不同组织的表达情况, 结果表明基因是组成型表达的, 在不同部位均检测到了基因的表达。其中根、茎和叶的表达量较低, 花丝、穗子和幼胚的表达量较高, 以幼胚的表达量最高(图3)。ZmABI3-L在不同组织的差异表达或许和其功能相关。提取不同胁迫处理玉米幼苗的RNA通过定量PCR分析ZmABI3-L基因的表达量, 结果表明ZmABI3-L基因的表达受冷、干旱、ABA和盐胁迫诱导上调表达(图4)。盐胁迫处理基因的表达量在处理后12 h表达量最高, 为对照的3.36倍, 随后表达量迅速下降到对照相近水平(图4A)。干旱处理基因的表达随着处理迅速提高, 到处理3 h时基因的表达量达到最高, 为对照的2.23倍, 随后表达量逐渐降低, 到48 h时表达量达到最低(图4B)。冷胁迫处理时, 基因在开始胁迫时表达量略有下降, 当达到3 h时表达量为对照的1.54倍, 随后开始下降(图4C)。ABA处理时基因迅速应答, 处理0.5 h时表达量就为对照的近1.85倍, 处理3 h时表达量达到最高, 为对照的2.34倍(图4D)。从基因的诱导表达特性可见ZmABI3-L基因是受多种非生物胁迫诱导表达的, 意味着它在应答胁迫反应中可能起重要作用。
从ZmABI3-L基因的表达特性可见, 该基因受多种胁迫诱导表达, 其可能在玉米抗逆境胁迫中起作用, 为深入研究其功能, 将该基因转到拟南芥中, 研究基因的作用。本实验共获得7株转基因植株, 经过2代筛选培养后, 得到5株T3代转基因纯合植株, RT-PCR检测基因表达量显示转基因株系的ZmABI3-L基因有较高的表达量(图5A), 选取ZmABI3-L基因表达最高的株系(line 5)进行深入研究。首先耐盐实验结果表明在不同盐浓度的培养基生长, 转基因植株和野生型植株的耐盐性不同。测量在不同浓度盐溶液中培养7 d植株的根和幼茎的长度(图5B), 结果显示在没有胁迫处理的培养基中(0 mmol/L), 转基因植株和野生型植株的根和茎长度差别不大, 而在不同浓度的盐溶液下两种植株生长差异显著。在 50 mmol/L的培养基对两种植株的幼茎影响不大, 野生型为0.73 cm, 而转基因植株为0.82 cm, 比野生型略长; 在100 mmol/L盐培养基中野生型为0.227 cm, 而转基因为0.313 cm, 150 mmol/L盐培养基对转基因和野生型都有较大的损害, 野生型的损害更加明显, 野生型为0.09 cm, 而转基因为0.127 cm, 为野生型的1.4倍。高盐对根的损伤也很明显, 在50 mmol/L盐培养基中野生型的根长为3.71 cm, 而转基因植株根长略高, 为4.02 cm, 100 mmol/L盐培养基对拟南芥的根损伤非常明显, 野生为1.31 cm, 转基因植株为2.11 cm, 150 mmol/L盐培养基野生型为0.23 cm, 而转基因植株为1.97 cm, 为野生型的8.6倍。
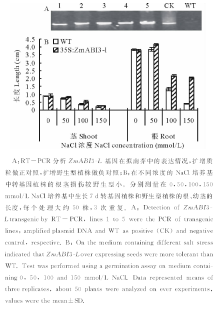 | 图5 转ZmABI3-L基因拟南芥耐盐性提高Fig.5 Enhanced salt tolerance of ZmABI3-L-over expressing Arabidopsis thaliana |
将转基因和野生型植株分别种植在50 mmol/L甘露醇的培养基上进行耐旱性鉴定, 结果可见无论从长势还是发芽率上转基因植株都要较野生型好, 在甘露醇渗透培养基中培养7 d, 转基因植株的发芽率为(74.5± 2)%(图6A), 而野生型为(33.6± 3)%, 大部分野生型种子没有萌发(图6B)。随机选取各种基因型10株植株进行测量(图6C), 结果显示转基因植株根的平均长度为(2.65± 0.3) cm, 茎的平均长度为(0.32± 0.11) cm, 而野生型根的平均长度为(0.43± 0.12) cm, 茎的平均长度为(0.21± 0.08) cm(表1)。转基因植株的幼苗健康、浓绿, 而野生型长势瘦弱、发黄。
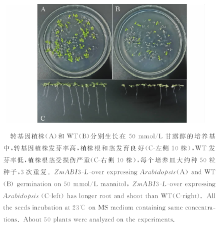 | 图6 ZmABI3-L基因提高拟南芥的抗旱性Fig.6 Germination assays of ZmABI3-L-over expressing plants under drought stress |
| 表1 转ABI3-L基因拟南芥在干旱胁迫下的发芽率和植株长度的变化 Table 1 The germination and plants length was changed under drought stress of ZmABI3-L-over expressing and WT plants |
ABA 是植物重要的激素, 在植物的生长发育、种子萌发、促进衰老等方面起重要作用, 随着对其研究的深入发现它在植物应答干旱、高盐、低温等逆境反应中也起重要的作用, 是植物的重要抗逆境因子[11]。越来越多的研究表明, ABA 在生物体内最主要的功能是其作为胁迫激素参与了植物对外界胁迫条件的应答[12, 13]。
ABI3家族是 ABA 信号途径中的重要信号因子, 属于B3转录因子家族, 在植物的生长发育中起重要的作用, ABI3可以和多个转录因子结合如LEC1, LEC2和FUS3, 这些因子同时也可以控制ABI3在植物体内的表达。研究表明ABI3的作用是多方面的, 如玉米的VP1基因在种子成熟中起作用, vp1突变体表现种子早熟性。拟南芥的ABI3在黑暗诱导植株顶芽的衰老中起重要的作用, 通过转基因已经证明ABI3/VP1同源蛋白在种子和胚的发育中起重要的作用; 拟南芥的LEC2基因和FUS3是ABI3最近的同源基因, 它们也参与调控种子发育过程和多种生命过程, 在植物发育的早期阶段, LEC2基因决定着胚柄细胞和子叶的发育, 在植物发育的晚期阶段, LEC基因可以使种子抗干燥的能力大大增加[14, 15]。ABI3的作用并不仅仅局限于种子发育的调控中, Brocard等[16]从拟南芥中分离鉴定出一种突变体, 可以使植株对ABA敏感性降低, 具有抑制细胞的伸长、阻止纤维素的合成、影响维管的分化等功能, 并且在气孔调节、胁迫应答基因表达调控方面出现障碍。花生(Arachis hypogaea)中发现的ABI3/NP1基因可以调控胚对脱落酸的敏感性、调控胚中叶绿素的降解和花青素的合成、使种子获得抗干燥能力和抑制不成熟种子的萌发等作用。水稻中克隆到ABI8基因, 是一个对干旱和盐害均有响应而显著上调的基因可能参与ABA和乙烯信号互作调控拟南芥根的生长[16, 17, 18]。
目前许多物种的ABI3基因还没有进行深入研究, 尤其是它们在ABA介导的信号通路中的作用还远远未知。本文的初期研究表明ZmABI3-L基因可以应答多种逆境胁迫因子, 同时转基因到拟南芥中可以增加拟南芥的抗性, 是一个潜在的胁迫耐受候选功能基因。ABA发挥特定生理功能的机制是非常复杂的, 对胁迫信号如何通过ZmABI3-L来精确应答, 还需要继续深入研究。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [10] |
|
| [11] |
|
| [17] |
|