作者简介:伍文宪(1988-),男,江西安福人,研究实习员,硕士。E-mail: wuwenxian07640134@163.com
尖孢镰刀菌从形态学和分子生物学上与属内多种菌难于区分,为准确鉴定豆科牧草上的尖孢镰刀菌,本研究基于尖孢镰刀菌与其他镰刀菌的核糖体DNA基因间间隔区IGS(intergenic spacer)序列间的差异,设计了一对特异性引物P1/P2,检测体系可以特异地从尖孢镰刀菌中扩增出一条1081 bp的条带;引物P1/P2对尖孢镰刀菌基因组DNA的检测阈值为100 pg,对土壤中尖孢镰刀菌分生孢子的检测灵敏度为100个孢子/g土;同时,引物P1/P2也可以对发病牧草根部组织中尖孢镰刀菌的存在进行特异性检测。检测体系可不经过室内病原菌的分离纯化即可有效的从土壤和病株中提取的DNA进行PCR检测鉴定,是一种快速有效的豆科牧草根腐病病原菌分子检测技术。
It is difficult to distinguish Fusarium oxysporum from other Fusarium species using traditional morphological observations or molecular analysis based on rDNA-ITS sequencing. In order to accurately identify F. oxysporumin legumes, a pair of primers named P1/P2 was designed based on differences in ribosomal DNA intergenic spacer (rDNA-IGS) sequences of the Fusarium genus, which can be used to amplify DNA from F. oxysporum by conventional PCR. More than 23 species of root rot pathogens were used to verify the specificity of the primers. P1/P2 could amplify a unique 1081 bp sequence from different biotypes of F. oxysporum while it could not amplify from other root rot pathogens. The sensitivity of P1/P2 was 100 pg for genomic DNA and 100 conidia/g soil for the root rot pathogens. Furthermore, this pair of primers could directly amplify sequences from the genomic DNA of F. oxysporum diseased plant samples without pathogen isolation, indicating that this is a rapid and effective legume root rot pathogen detection technology.
豆科牧草根腐病在世界各地均不同程度地发生, 严重时往往成为牧草生产的限制因素[1]。由镰刀菌引起的根腐病在我国各牧草产区均普遍发生, 其中, 尖孢镰刀菌(Fusarium oxysporum)、锐顶镰刀菌(F. acuminatum)、半裸镰刀菌(F. semitectum)等镰刀菌更是豆科牧草根腐病的优势种[2, 3], 这些根腐病优势种在土壤和病残体上可长期存活造成危害, 因此, 如何及时有效地对发病初期的牧草和带菌土壤进行快速诊断、如何快速准确地鉴定出致病镰刀菌种类, 对牧草根腐病防治至关重要[4]。
传统的病原菌形态学鉴定主要是通过病菌分离、纯化、回接和再分离途径来完成, 耗时费力, 已经不能满足对植物病原鉴定的要求, 而近年来随着PCR技术和测序技术的发展, 分子生物学技术为植物病原真菌的检测、鉴定和量化提供了新的方法和手段[5], 牧草上病害的诊断和鉴定方法也正在从传统的形态学鉴定方法发展到分子诊断水平。核糖体DNA(rDNA)的编码区序列具有保守性而非编码区变异丰富, 因此, 分析真菌核糖体基因是进行真菌分类鉴定和系统发育的有效方法[6, 7], 核糖体的内转录间隔区ITS(internal transcribed spacer)已广泛用于真菌种属的分类鉴定研究中[8], 同时在病原菌的分子检测技术中, 大多也都是基于特异性扩增核糖体DNA内转录间隔区(rDNA-ITS)片段而建立的[9, 10], 然而在植物病原菌分子检测中, 有些真菌rDNA-ITS序列在种间表现的差异性较小, 导致以rDNA-ITS序列为靶标, 并不能有效地对病原菌加以鉴定[11], 如小麦矮化腥黑穗病菌(Tilletia controversa)、小麦光腥黑粉菌(T. foetida)和小麦网腥黑粉菌(T. caries)之间相差不到10个碱基序列[12], 小麦印度腥黑穗病(T. indica)和黑麦草腥黑穗病菌(T. walkeri)的rDNA-ITS序列只有1个碱基的区别, 西瓜炭疽病菌(Colletotrichum orbiculare)和菜豆炭疽病(C. lindemuthianum)的rDNA-ITS序列也仅仅相差7个碱基[13, 14], 笔者在豆科牧草镰刀菌根腐病病原鉴定时也发现, ITS序列分析难以区分层生镰刀菌(F. proliferatum)和尖孢镰刀菌(F. oxysporum), 黄色镰刀菌(F. culmorum)和木贼镰刀菌(F. equiseti)等, 显然无法通过rDNA-ITS序列设计特异性引物对这些病原菌加以区分鉴定, 需要从其他途径寻找分子检测的靶标。
rDNA基因间间隔区IGS(intergenic spacer)具有丰度高、变异较快、在种内不同菌株间高度保守, 种间存在丰富变化等特点[15, 16], 正日渐用于同属真菌不同种间和种内不同群体间的比较[17, 18, 19]。有关豆科牧草根腐病原菌的分子快速鉴定方法的研究并不多见, 因此, 本研究以不同专化型尖孢镰刀菌种群及其他不同种属镰刀菌为研究对象, 采用IGS序列对比分析方法, 以期通过寻找新的分子靶标IGS特殊序列实现对尖孢镰刀菌进行特异性分子标记, 最终建立其准确和快速的分子检测技术。
供试菌株见表1, 部分菌株为从四川三州、成都、新津、眉山等豆科牧草种植区分离鉴定得到, 其他菌株源自实验室保存。将供试菌株置于铺有玻璃纸的PDA培养基, 25℃暗培养4 d, 小心刮取菌丝, 采用E.Z.N.A.Fungal DNA Mini Kit(OMEGA真菌基因组DNA提取试剂盒)提取供试菌株的基因组DNA。
| 表1 特异性引物P1/P2对供试菌株的验证 Table 1 Isolate of different fungi used to screen the primer specificity in the study |
完全液体培养基培养尖孢镰刀菌, 待产孢后, 将经血球计数板计数后的5× 107个分生孢子与1 g灭菌后的营养土混合, 用E.Z.N.A.Soil DNA Kit(OMEGA土壤基因组DNA提取试剂盒)提取含尖孢镰刀菌分生孢子的土壤基因组DNA, 终产物以50 μ L Elution Buffer溶解(相当于浓度为106 个孢子的DNA)[20], 未接孢子的灭菌营养土DNA作为空白对照。
将消毒后的由尖孢镰刀菌引起的根腐苜蓿(Medicago sativa)病株置于液氮预冷的研钵中, 研磨成粉状后转移至2.0 mL的Eppendorf 管中, 用E.Z.N.A.Plant DNA Kit(OMEGA植物组织基因组DNA提取试剂盒)提取植物病株基因组DNA, 用本方法提取健康苜蓿植株组织DNA作为空白对照, 而以接种锐顶镰刀菌引起的根腐苜蓿病株作为负对照。
于2014年10-12月, 对GenBank(http://www.ncbi.nlm.nih.gov/genbank)及Fusarium-ID(http://isolate.fusariumdb.org/wizard.php?a=db2)中不同专化型的尖孢镰刀菌种群及其他不同种属镰刀菌共计76株菌株的IGS序列经DNAMAN及MEGA6软件进行对比分析, 使用Primer 5设计了一对特异性引物P1/P2:P1, 5'-CAGGGTAGGCAGCTTAGATTTGG-3', P2, 5'-GACGGATTTGGCGAACCTACCCT-3', 由成都擎科梓熙生物技术有限公司合成, 并于2015年1月至3月对该特异性引物进行验证分析, 重复试验共计7次。
PCR 反应体系总体积为20 μ L:10 μ L 2× supermix(购自北京全式金生物技术公司), 引物P1/P2(10 μ mol/L)各0.5 μ L, 1 μ L模板DNA(50 ng/μ L), 灭菌水补足到总体积, 在BIO-RAD T100TM PCR 扩增仪进行扩增反应, 其反应程序为:95℃预变性5 min; 95℃变性30 s, 65℃退火30 s, 72℃延伸1 min, 共35个循环; 72℃延伸5 min。取全部扩增产物于1.0%琼脂糖凝胶中电泳, 在凝胶成像仪上检测。
将尖孢镰刀菌 DNA浓度从50 ng/μ L依次稀释为25 ng/μ L, 10 ng/μ L, 5 ng/μ L, 1 ng/μ L, 500 pg/μ L, 100 pg/μ L和50 pg/μ L共8个梯度, 分别取1 μ L为模板进行PCR反应, 反应体系及程序与1.4所述一致。
将土壤中尖孢镰刀菌DNA浓度从106个孢子/μ L依次梯度稀释10倍至1个孢子/μ L, 分别取1 μ L为模板进行PCR反应, 反应体系和扩增程序如1.4所述。
以接种尖镰孢菌、锐顶镰刀菌的发病组织和健康植株组织中提取的基因组DNA为模板进行常规PCR 反应, 反应体系和扩增程序如1.4所述, 终产物经1.0%琼脂糖凝胶电泳后成像检测。
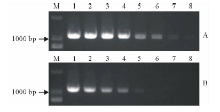
对GenBank和Fusarium-ID中不同专化型的尖孢镰刀菌种群及其他不同种属镰刀菌的IGS序列对比分析, 发现下游有一处约1100 bp左右区段的序列在不同专化型的尖孢镰刀菌高度保守, 而在其他镰刀菌种群间则保守型较差(图1), 根据该段特异性碱基序列设计了一对引物P1/P2, 对供试病原菌共23个菌株的基因组DNA进行了PCR扩增, 结果显示该对引物只能从尖孢镰刀菌中特异性地扩增出一条1081 bp左右的条带, 而其他供试菌株及空白对照均无扩增条带(图2), 表明该引物是尖孢镰刀菌种群特异性引物, 可用于尖孢镰刀菌的分子鉴定及分子检测。
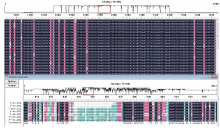 | 图1 不同专化型尖孢镰刀菌间及与其他部分镰刀菌IGS序列对比情况Fig.1 Sequence alignment of different biotypes F. oxysporum and some of other Fusarium spp. IGS sequences |
 | 图2 特异性引物P1/P2 PCR扩增供试菌株基因组DNA琼脂糖凝胶电泳Fig.2 Agarose gel electrophoresis of PCR amplified products with the specific primers P1 /P2 M: 2000 bp DNA标记; 1~23:表一菌株以P1/P2为引物的扩增结果; 24:阴性对照。M: 2000 bp DNA ladder; 1-23: the PCR products from the strains of Table 1; 24: negative control. |
常规PCR结果显示, 特异性引物P1/P2可稳定的从100 pg/μ L的尖孢镰刀菌基因组DNA模板中扩增得到一条1081 bp左右的条带, 而对土壤中病原菌的检测实验为, 在孢子浓度为100个孢子/g土时, 能清晰得到特异性条带(图3)。以上结果表明, 引物P1/P2对尖孢镰刀菌基因组DNA的检测灵敏度为100 pg/μ L, 对土壤中病菌孢子的检出阈值为100个孢子/g土。
对接种F. oxysporum后发病的苜蓿根部组织的基因组DNA进行常规PCR扩增, 该样品能扩增出1081 bp的特异性条带, 而接种F. acuminatum发病的苜蓿根组织及健康苜蓿植株基因组DNA均不能扩增得到该条带(图4), 说明P1/P2能用于尖孢镰刀菌引起的病害进行快速分子检测。
核糖体DNA(rDNA)基因间间隔区(IGS)位于rDNA基因18S、5.8S、26S rDNA基因相邻的两个重复单元之间[21]。IGS序列是目前研究报道中进化速率最快的序列, 已有的报道表明IGS序列的进化速率比ITS序列要快, 在研究系统发育关系中, IGS序列提供的信息位点是最多的, 比ITS多30%以上[22, 23, 24, 25, 26], 这就为将IGS序列分析应用于微生物种类鉴定与群落分析提供了理论基础。梁宏等[16]利用rDNA-IGS在属内种间序列差异将腥黑粉菌属3种检疫性真菌加以鉴定, 王永强等[15]甚至利用rDNA-IGS序列对中国不同地理来源的稻曲病菌加以区分归类。本研究以IGS序列为分子靶标, 对不同专化型的尖孢镰刀菌和其他引起牧草根腐病的镰刀菌的IGS序列进行了比较分析, 设计了对尖孢镰刀菌基因组DNA具有高度特异性的引物P1/P2, 建立了一套高效、快速、稳定的检测尖镰孢根腐病的分子检测体系, 该体系对不同专化型的尖孢镰刀菌的菌株均能扩增出特异性条带, 而属内其他镰刀菌无条带或无特异性条带。本研究建立的检测体系适用范围广, 适用于尖孢镰刀菌不同专化型的特异性检测以及尖孢镰刀菌与其他镰刀菌的区别鉴定, 同时, 基于IGS序列建立的检测体系对于发掘其他病原菌检测新靶标提供新思路。
王健生等[4]基于甾醇14α -去甲基化酶基因(CYP51C)也设计了一对特异性鉴定尖孢镰刀菌的引物, 但本研究相较他们的优点在于, rDNA-IGS在基因组中的丰度高, 意味着其检测阈值较低, 本研究表明检测体系对尖孢镰刀菌基因组DNA检测的灵敏度为100 pg/μ L, 同时操作非常简单, 仅需要一次常规的PCR就能得到稳定的实验效果, 这为根腐病尖孢镰刀菌的快速诊断并为之进行应急防控提供了可能。
由于该引物P1/P2还能针对土壤和发病植株特异性的鉴定出尖孢镰刀菌, 因此本研究可以不经过室内病原菌的分离纯化即可快速有效的从土壤和病株中提取的DNA进行PCR检测鉴定, 这对豆科牧草根腐病尖孢镰刀菌的实时监测和前期预警具有重要作用。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [8] |
|
| [9] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [20] |
|
| [21] |
|