作者简介:肖国增(1979-),男,湖南永州人,讲师,在读博士。E-mail:x_gz99@163.com
为研究匍匐翦股颖在盐胁迫下抗氧化酶活性与基因表达的影响机制,模拟盐胁迫条件,用0 mol/L(CK),0.2 mol/L的NaCl溶液对两种不同耐盐性的匍匐翦股颖Penncross和SeasideⅡ进行处理,测定了超氧化物歧化酶(SOD),过氧化氢酶(CAT),抗坏血酸过氧化物酶(APX)和过氧化物酶(POD)活性;用同源克隆的方法克隆了匍匐翦股颖 CytSOD, FeSOD, CAT, APX, POD的部分片段,并设计了5个基因的qRT-PC引物,对5个抗氧化酶基因表达量进行了荧光实时定量测定,分析了两种不同耐盐性的匍匐翦股颖在盐胁迫条件下,抗氧化酶活性与基因表达的变化规律。结果表明,盐胁迫对两种不同耐盐性的匍匐翦股颖抗氧化酶活性和基因表达的影响不同,在盐胁迫初期,盐敏感的Penncross SOD活性比耐盐的SeasideⅡ高,盐处理中、后期Penncross SOD活性快速下降,SeasideⅡSOD活性下降慢而且能保持相对稳定,在这一阶段SeasideⅡSOD活性显著高于Penncross;CAT,APX和POD活性随着盐处理的延长,酶活性增加,Penncross CAT和APX活性低于SeasideⅡ,POD活性两者差异不大。盐胁迫下,Penncross CytCu/ ZnSOD, CAT、 APX 和 POD表达量上调,而 FeSOD下调;SeasideⅡ5种抗氧化酶基因表达量上调, CytCu/ ZnSOD, FeSOD, CAT和 APX的表达量显著高于Penncross,而 POD表达量差异不大。两种匍匐翦股颖 CytCu/ ZnSOD、 CAT、 APX和 POD表达量变化与酶的活性变化较一致,而盐敏感的 FeSOD的表达量变化与SOD活性变化不一致。
The aim of this research was to investigate the antioxidant enzyme activity and gene expression mechanisms in creeping bentgrass ( Agrostis stolonifera) under salt stress. Two different salt-resistant creeping bentgrass cultivars, Penncross and SeasideⅡ, were treated with 0 (CK) and 200 mmol/L NaCl solutions. The activities of superoxide dismutase (SOD), catalase (CAT), ascorbate peroxidase (APX) and peroxidase (POD) were measured. The qRT-PCR primers for the CytSOD, FeSOD, CAT, APX and POD genes of creeping bentgrass were designed using partial gene segments, which were identified with homology cloning techniques. The gene expression levels of CytSOD, FeSOD, CAT, APX, and POD were measured and the activities of antioxidant enzymes and gene expression of the two different salt-resistant creeping bentgrass cultivars were analyzed. Salt stress had different effects on antioxidase activities and gene expressions on the two creeping bentgrass cultivars. At the beginning of salt stress, SOD activity of salt-sensitive Penncross was higher than that of salt-resistant SeasideⅡ. However, in the later stages of the treatment, the activity of Penncross SOD declined dramatically while the activity of SeasideⅡ SOD declined slowly and tended to be relatively stable, during which the activity of SeasideⅡ SOD was significantly higher than Penncross. The activities of CAT, APX and POD increased with salt treatment. The CAT and APX activities of Penncross were lower than those of SeasideⅡ, while POD activity was not different. Under the salt treatment, CytSOD, CAT, APX and POD expression of Penncross increased while FeSOD expression decreased. For SeasideⅡ, gene expression of the five antioxidases increased; CytSOD, FeSOD, CAT and APX gene expression were significantly higher in SeasideⅡ than Penncross, but POD was not different. The relative expression levels of CytCu/ZnSOD, CAT, APX and POD genes changed consistently with enzyme activities, but the relative expression level of the FeSOD gene in Penncross was not consistent with enzyme activity.
随着城市规模的不断发展, 淡水资源在城市中越来越缺乏, 因此, 大多数城市当中的园林绿地、软质运动场不得不选用城市再生水来浇灌草坪[1, 2]。然而, 长期用含盐量较高的再生水浇灌草坪, 不但会增加土壤的盐碱化, 也会对草坪草造成盐胁迫使草坪草受到伤害从而影响草坪质量[3]。
盐胁迫是过多的钠离子对植物造成脱水和渗透胁迫伤害, 影响了植物的正常生长和发育[4, 5], 为应对盐胁迫对植物造成的离子毒害和渗透胁迫, 植物演化出多种机制来使这种伤害降到最低。其中, 氧化应激是植物早期快速响应盐胁迫的机制之一, 此过程形成的活性氧(ROS)包括:超氧阴离子、过氧化氢和羟基自由基等[6]。活性氧(ROS)大量积累, 会对植物造成膜系统氧化损伤[7], 体内激素平衡被破坏[8], 蛋白质和核酸变性; ROS能激活质膜渗透性Ca2+和K+的离子通道蛋白, 催化Ca2+信号途径, 导致K+流失甚至引起植物细胞程序死亡[9, 10]。植物为了应对ROS的伤害, 形成了一套由抗氧化酶和非抗氧化酶组成的抗氧化体系[11]。抗氧化酶主要包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、抗坏血酸过氧化物酶(APX), 植物通过这些酶的作用减少或是清除ROS的积累, 减轻和抵御盐胁迫对植物细胞的伤害[12]。在清除ROS的机制中SOD是第一个激活酶, 它清除超氧阴离子产生过氧化氢和氧气, 随后CAT、APX和POD酶清除过氧化氢[13, 14]。
同时, 非生物胁迫也会对植物的抗氧化酶基因在转录水平上造成影响。在高温胁迫下, 水稻(Oryza sativa)开花期剑叶的SOD、CAT和POD基因表达量显著增加, 从而维持了较高的酶活性来应答高温胁迫[15]; 过量的镉积累增强了龙葵(Solanum nigrum)SOD、POD和CAT的转录水平[16]; 而随着镉对玉米(Zea mays)幼苗处理时间的增加, SOD的表达量受到抑制[17], 高钙处理苹果(Malus pumila)果实在12 h后SOD和CAT表达量增加[18]; 盐胁迫加强了CytCu/ZnSOD、CAT和POD等基因的表达[19], 因此, 研究抗氧化酶活性与转录水平调控对理解草坪草在非生物胁迫, 尤其是盐胁迫下的抗氧化机制具有重要作用。
匍匐翦股颖(Agrostis stolonifera)是优良的冷季型草坪草, 具有极耐低修剪、成坪快、草坪质量高的优点, 被广泛应用于城市园林绿化和运动场草坪, 但是较低的耐盐性[20]限制了其应用。目前, 在盐胁迫下对匍匐翦股颖抗氧化酶活性和基因表达方面的研究较少, 特别是抗氧化酶基因表达水平的研究还未见报道。因此, 本研究通过不同盐浓度处理两种不同耐盐性的匍匐翦股颖, 研究盐胁迫条件下匍匐翦股颖抗氧化酶活性及基因表达的变化规律, 揭示其在抗氧化酶系统及基因表达对盐胁迫的响应机制, 为草坪草在逆境生理与分子研究领域提供理论依据, 也为匍匐翦股颖在盐害方面的草坪管理提供指导。
供试两种匍匐翦股颖Penncross和SeasideⅡ 种子来源于实验室保存, 其中Penncross对盐敏感, 而SeasideⅡ 有很好的耐盐性[21]。试验于2014年8月-12月, 在苗圃温室和草坪实验室进行。苗圃温室气温为(22± 1) ℃/(16± 1) ℃(白天/黑夜), 相对湿度为65%~75%, 14 h平均光有效辐射(PAR)值为400 μ mol/(m2· s)。匍匐翦股颖Penncross和SeasideⅡ 按5 g/m2播种量, 均匀撒播于直径15 cm, 高13 cm的方形塑料花盆中, 基质为过筛的纯沙。种入时间为2014年8月1日, 出苗前用塑料薄膜覆盖。苗期进行间苗, 留下长势一致和分布均匀的苗株, 采用正常的养护管理, 每星期浇一次0.5强度(在原配方的基础上减半)的Hoagland营养液[22]直至从底部流出。
1.2.1 生理实验处理与取样 至2014年11月1日, 移入水培箱内培养。塑料水培箱:50 cm× 38 cm× 26 cm; 从花盆中取栽培3个月的健康草皮, 剪成直径为4 cm, 厚3 cm的草皮放于挂篮上, 再把挂篮放于黑色塑料板的孔中, 然后把黑色塑料板放于水培箱上, 使草皮与水充分接触, 挂篮直径5 cm, 一块板上平均分布20个。水培箱用增氧泵通气, 每星期换一次水, 换水时加入0.5强度的Hoagland营养液, 水培两周后进行处理。
用NaCl溶液进行盐处理, 共设两个盐梯度分别为0 mol/L(CK)和0.2 mol/L, 各处理均设4个重复, 两个匍匐翦股颖草种, 共16盆。第1次加盐时, 把相应盐浓度平均分4份, 每天加一次, 于11月16日加盐, 11月19日达到相应盐浓度。加盐前进行第1次取样, 达到相应盐浓度后每隔5 d取一次样, 取样时间分别为11月15日(0处理), 11月24日, 11月29日, 12月4日, 12月9日, 取样的叶片立即用锡箔纸包好, 编号后放入液氮中, -80 ℃保存。
1.2.2 分子实验处理与取样 分子实验材料取栽培3个月的Penncross和SeasideⅡ 移入人工气候箱, 生长条件与苗圃温室一致, 预培养两周后, 进行NaCl处理, 浓度梯度与生理实验一致, 4个重复。处理时分别用0 mol/L(蒸馏水, CK)和0.2 mol/L浓度的NaCl浇灌花盆, 浇灌时尽量避免盐水接触叶片, 直至溶液从花盆底部流出。取样时间分别为0 h(盐处理前), 1 h, 3 h, 6 h, 12 h, 24 h。取样的叶片立即用锡箔纸包好, 编号后放入液氮中, -80 ℃保存。
1.3.1 酶液的提取 称取0.15 g 叶片, 用液氮磨成粉末, 加2 mL 提取液研磨成匀浆, 于12000 r/min、4 ℃条件下离心20 min, 上清液即为粗酶液。提取液为含有1 mmol/L 的乙二胺四乙酸(EDTA)、1% 的聚乙烯吡咯烷酮(PVP-40)(w/v)、1 mmol/L 的二硫苏糖醇(DTT) 和1 mmol/L 的苯甲基磺酰氟(PMSF)的磷酸缓冲液(PBS 7.0)(50 mmol/L)[23]。
1.3.2 抗氧化酶活性测定 SOD活性用Giannopolitis等[24]的方法测定, CAT、POD和APX的活性采用Zhang等[23]的方法进行测定, 可溶性蛋白用Bradford[25]的方法测定。
1.4.1 匍匐翦股颖cDNA制备 采用TRIzol 试剂盒提取RNA, 并使用DNase(Turbo DNA-Free Kit; Ambion, Austin, TX)处理去除DNA 污染, 用反转录酶[PrimeScriptTM RT Reagent Kit (Perfect Real Time) Takara, Japan]反转录成cDNA, 用于后续实验。
1.4.2 抗氧化酶qRT-PCR引物设计 对匍匐翦股颖的SOD(CytCu/ZnSOD、FeSOD)、APX、CAT、POD 5个抗氧化酶基因采用同源克隆的方法进行基因克隆。通过NCBI中与匍匐翦股颖同源物种小麦(Triticum aestivum)、大麦(Hordeum vulgare)、二穗短柄草(Brachypodium distachyon)、玉米和水稻等相对应的抗氧化酶基因序列比对后的保守区域设计相应引物, 扩增抗氧化酶CytCu/ZnSOD(GenBank:KU966135)、FeSOD(GenBank: KU966136)、APX(GenBank:KU981301)、CAT(GenBank: KU966134)和POD(GenBank: KX034392)5个基因的部分序列。用所得基因序列和匍匐翦股颖Actin(GenBank:JX644005.1)序列设计相应基因的荧光实时定量反应(quantitativereal-time polymerase chain reaction, qRT-PCR)引物(表1), 经PCR和qRT-PCR验证后, 用于抗氧化酶基因荧光实时定量分析。
| 表1 qRT-PCR所用的引物 Table 1 Primers for qRT-PCR |
1.4.3 抗氧化酶基因表达量测定 匍匐翦股颖叶片抗氧化酶基因的表达分析采用qRT-PCR方法, 荧光定量试剂UltraSYBR Mixture (with ROX I)(CWBIO. Chain), 以两个盐处理梯度的相对应的cDNA为模版, 用Bio-RAD CFX connecttm Real-time system采用两步法, 20 μ L体系, 4个生物学重复, 以匍匐翦股颖Actin作为内参基因, 进行5个抗氧化酶基因CytCu/ZnSOD、FeSOD、APX、CAT和POD的荧光定量分析, 相对表达量用2-Δ Ct法计算, 其中Δ Ct=Ct(目的基因)-Ct(内参基因)。
采用SPSS 18.0进行数据单因素方差分析(ANOVA), 使用最小显著差异法(least significant difference, LSD)在0.05显著性水平进行差异显著性分析, 图表用Excel 10.0绘制。
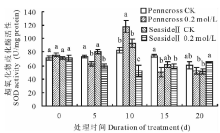
SOD是抗氧化保护系统清除ROS机制中首先被激活的酶, 把超氧阴离子分解成过氧化氢和氧气[13]。盐胁迫对两种不同耐盐性的匍匐翦股颖SOD活性的影响不同(图1)。盐敏感的Penncross在0.2 mol/L盐浓度处理下, SOD活性呈现先升高再降低的趋势。在第10天达到最高值, 是CK的142.3%, 差异显著。耐盐的SeasideⅡ 在0.2 mol/L盐浓度处理下的SOD活性呈现先降低, 后升高的趋势, 第10天达到最低值, 比CK值低43.8%, 其值是Penncross第10天的44.4%, 差异显著; 第20天SeasideⅡ 0.2 mol/L盐浓度处理下的SOD活性高于CK值和0.2 mol/L盐浓度处理下Penncross的SOD活性值。SeasideⅡ SOD响应盐胁迫比Penncross慢, 但随着盐胁迫时间的增加, SeasideⅡ SOD活性增强, 而Penncross SOD活性快速下降, 表明SeasideⅡ SOD比Penncross清除ROS的能力更持久, 能更好地保护细胞减轻盐害。
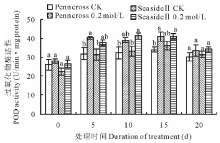
CAT在抗氧化保护机制中起到了重要作用, 它把SOD清除ROS产生的过氧化氢催化分解成水和氧气[26]。盐处理下两种匍匐翦股颖CAT活性变化都呈现上升的趋势, 盐处理期间两种草0.2 mol/L盐处理的CAT活性均比对照高(图2)。第5天SeasideⅡ 0.2 mol/L盐处理的CAT活性显著低于Penncross的CAT活性; 然而, 从第10天后SeasideⅡ 0.2 mol/L盐处理的CAT活性高于Penncross, 在第15天SeasideⅡ CAT活性是Penncross CAT活性的131.6%, 两者差异显著。这表明盐敏感的Penncross CAT响应盐胁迫比耐盐的SeasideⅡ 快, 但在盐处理中、后期SeasideⅡ CAT的响应逐渐加强, 活性显著高于Penncross, 表明SeasideⅡ CAT清除过氧化氢的能力更强。
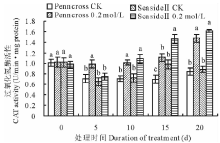 | 图2 盐胁迫对两种匍匐翦股颖CAT活性的影响Fig.2 Effects of different salinities treatments on CAT activities in two different creeping bentgrass cultivars |
在植物叶绿体内谷胱甘肽循环的第一步, APX使用电子供体的抗坏血酸清除过氧化氢[26]。在盐胁迫下, 两种匍匐翦股颖APX活性整体呈上升趋势(图3)。但是, 盐敏感的Penncross APX活性在第10天达到最高值, 是CK的149.5%, 差异显著, 随着盐处理时间的延长, APX活性缓慢下降。耐盐的SeasideⅡ APX活性盐处理后比CK和Penncross APX的活性都高, 而且呈一直上升的趋势, 在第10天达到最高值, 而后其活性趋于稳定, 在第20天其值是CK的118.2%, 是盐处理下Penncross APX的116.8%, 差异不显著; 这表明盐处理下SeasideⅡ 和Penncross APX清除过氧化氢的能力相近。
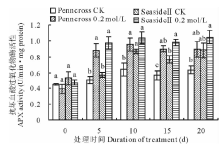 | 图3 盐胁迫对两种匍匐翦股颖APX活性的影响Fig.3 Effects of different salinities treatments on APX activities in two different creeping bentgrass cultivars |
植物体内的POD通过共基质的酚类抗氧化剂或化合物氧化来分解过氧化氢[26]。盐胁迫下, 两种匍匐翦股颖的POD活性差异不显著, 都呈先升高后下降的趋势, 在第15天POD的活性都达到最高值(图4)。两种匍匐翦股颖在盐处理下的POD活性都高于CK, 除了第0天和第20天不显著以外, 其他的盐处理时间0.2 mol/L盐处理和CK差异显著。
2.2.1 抗氧化酶基因qRT-PCR引物设计与验证 根据确定的匍匐翦股颖CytCu/ZnSOD、FeSOD、APX、CAT和POD五个基因的序列设计相应的qRT-PCR引物, 用PCR和qRT-PCR验证扩增产物。5个基因的PCR产物都在300 bp以下, 而且目的条带单一, 明亮; qRT-PCR溶解曲线图的溶解峰单一, 同一个抗氧化酶盐处理的多个样品出现溶解峰的温度较一致。因此, 设计的5个匍匐翦股颖抗氧化酶基因的qRT-PCR引物, 可以用于荧光实时定量分析。
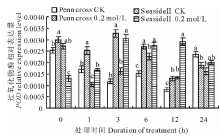
2.2.2 盐胁迫对抗氧化酶基因表达的影响 以匍匐翦股颖内源AsActin作为内参基因, 将0 h处理设为参照, 在盐胁迫下, 两种匍匐翦股颖CytCu/ZnSOD相对表达量的变化趋势有所不同(图5)。盐敏感的Penncross随着盐处理时间的延长, CytCu/ZnSOD相对表达量先升高后降低; 在第3 h达到最高值, 是CK的169.1%, 差异显著, 而后表达量下降。耐盐的SeasideⅡ 随着盐处理时间的延长, CytCu/ZnSOD相对表达量呈上升趋势, 其表达量在第3 h盐处理与CK差异显著, 但相对表达量低于盐处理Penncross的相对表达量, 两者差异显著; 但盐处理SeasideⅡ 在第24 h达到最大值, 是Penncross的167.1%, 差异显著。
 | 图5 盐胁迫下对两种匍匐翦股颖CytCu/ZnSOD相对表达量的影响Fig.5 Gene expression of CytCu/ZnSOD in two different creeping bentgrass cultivars under salt treatment |
盐胁迫下, 两种匍匐翦股颖FeSOD相对表达量变化趋势不同(图6)。盐敏感的Penncross随着盐处理时间的延长, FeSOD相对表达量下调。耐盐的SeasideⅡ 随着盐处理时间的延长, FeSOD相对表达量呈先下调后上调的趋势, 其值高于CK和盐处理的Penncross; 在第12 h达到最高值, 是盐处理Penncross的324.6%, 差异显著。
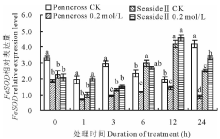 | 图6 盐胁迫下对两种匍匐翦股颖FeSOD相对表达量的影响Fig.6 Gene expression of FeSOD in two different creeping bentgrass cultivars under salt treatment |
盐胁迫下, 两种匍匐翦股颖CAT相对表达量变化趋势相同(图7), 都上调, 在第24 h达到最大值, SeasideⅡ CAT的表达量是Penncross 的265.3%, 是CK的214.9%, 差异显著。在盐处理的时间里, SeasideⅡ CAT表达量均高于CK和Penncross, 差异显著。
 | 图7 盐胁迫下对两种匍匐翦股颖CAT相对表达量的影响Fig.7 Gene expression of CAT in two different creeping bentgrass cultivars under salt treatment |
盐胁迫下, 两种匍匐翦股颖APX相对表达量变化趋势见图8, 盐敏感的Penncross随着盐处理时间的延长, APX相对表达量先升高后下降; 在第3 h达到最大值; 耐盐的SeasideⅡ 随着盐处理时间的延长, APX相对表达量呈先上升后下降的趋势, 在第12 h达到最大值, 是CK的208.9%, 是盐处理Penncross的251.7%, 差异显著。
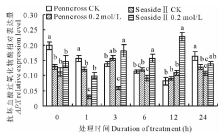 | 图8 盐胁迫下对两种匍匐翦股颖APX相对表达量的影响Fig.8 Gene expression of APX in two different creeping bentgrass cultivars under salt treatment |
盐胁迫下, 两种匍匐翦股颖POD相对表达量变化趋势大致相同(图9), 都先升高后降低。盐处理的Penncross和SeasideⅡ POD相对表达量在第3 h达到最高值, 两者差异不显著; 盐处理的两种匍匐翦股颖POD相对表达量均高于CK, 差异显著。耐盐的SeasideⅡ POD相对表达量在第12 h的表达是盐处理Penncross的225.0%, 显著高于CK和Penncross。
植物体内存在ROS生成与清除机制, 在正常情况下两类机制处于平衡状态, 但植物在遭受外界环境胁迫时, 这种平衡受到破坏, 积累过多的ROS会引起植物的氧化伤害[27], 在这种机制中抗氧化酶SOD、CAT、APX、POD在保持细胞内ROS动态平衡发挥了重要作用。本研究在盐胁迫下, 对两种耐盐性不同的匍匐翦股颖抗氧化酶SOD、CAT、APX、POD的活性和基因表达量的变化进行了较系统分析。
在0.2 mol/L盐胁迫下, 两种匍匐翦股颖SOD活性和转录水平响应不同, 盐敏感的Penncross SOD活性先升高再降低, 与刘凤歧等[28]对盐胁迫下燕麦(Avena sativa)的SOD变化一致; 耐盐的SeasideⅡ SOD活性先降低后升高到较稳定状态。盐处理前期Penncross SOD活性比SeasideⅡ 高, 而盐处理后期Penncross SOD活性比SeasideⅡ 低。这表明盐敏感的Penncross对盐胁迫响应更快, 随着盐处理时间的增加, SOD的活性降低, ROS的动态平衡被打破, 过多的ROS导致了Penncross对盐胁迫的抵抗力下降; 而在盐处理后期, 耐盐的SeasideⅡ SOD显著高于Penncross, SOD活性高有利于清除ROS[29], 从而增加植物对盐害的抵抗力。在0.2 mol/L盐胁迫下, 两种匍匐翦股颖抗氧化酶CAT、APX和POD的活性都增加[30, 31], 而且耐盐的SeasideⅡ 比Penncross CAT、APX和POD的活性更高, 这与Puyang等[32]对草地早熟禾在盐胁迫下抗氧化酶的影响研究结果一致。
在0.2 mol/L盐胁迫下, 盐敏感的Penncross CytCu/ZnSOD、APX和POD先上调后下调, CAT上调; 耐盐的SeasideⅡ CytCu/ZnSOD、FeSOD、CAT、APX和POD都上调, SeasideⅡ 比Penncross抗氧化酶基因表达量高, 这与两种匍匐翦股颖在盐胁迫抗氧化酶活性的变化趋势一致。这表明在盐胁迫下转录水平上, 上调抗氧化酶基因表达量可以激活抗氧化酶的活性, 能更有效地减少ROS的积累, 维持细胞膜稳定性和生理平衡[18]。对盐胁迫下大麦的研究表明FeSOD活性没变化, 甚至有的大麦基因型在盐处理下FeSOD活性降低[33]。本研究的Penncross FeSOD在盐胁迫下基因表达量下调, 而SOD活性升高, 酶活性与FeSOD基因表达量不一致, 表明在盐胁迫下SOD的活性可能是受除FeSOD以外的其他的基因调控。因此, 草坪草抗氧化酶活性与基因编码调控之间的相互作用机制还有待更深入的研究。
综上所述, 本研究从生理与分子转录水平上, 分析了两种不同耐盐性的匍匐翦股颖抗氧化酶在盐胁迫下的响应机制。在盐胁迫下, 两种匍匐翦股颖除SOD外其他3个抗氧化酶活性变化较一致。0.2 mol/L盐处理匍匐翦股颖的Penncross和SeasideⅡ CAT和APX活性呈上升趋势, POD活性呈先升高后下降的趋势; Penncross SOD活性先升高后下降, 而SeasideⅡ SOD先下降后升高。在盐处理后期SeasideⅡ SOD、CAT和APX活性都比Penncross高, POD活性两者差异不大。分子水平上, 两种匍匐翦股颖CytCu/ZnSOD、CAT、APX和POD变化与酶的活性变化较一致, 而盐敏感的匍匐翦股颖FeSOD的基因表达与酶活性变化不一致。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [8] |
|
| [12] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [20] |
|
| [27] |
|
| [28] |
|
| [29] |
|