作者简介:马乐元(1984-),男,甘肃武威人,在读博士。E-mail:119256800@gsau.edu.cn
本研究以小冠花幼苗叶片为材料,用0.25,0.5,1和2 mmol/L外源水杨酸(SA)对植株进行叶面喷施,通过盆栽模拟干旱胁迫处理,测定幼苗叶片在连续干旱下膜脂过氧化指标、抗氧化酶活性和非酶抗氧化物含量,研究外源水杨酸对干旱胁迫下小冠花幼苗活性氧水平及抗氧化系统的影响。结果表明,0.5~2.0 mmol/L的水杨酸显著降低了干旱胁迫下小冠花叶片中超氧阴离子(O2-·)的产生速率、过氧化氢(H2O2)含量、丙二醛(MDA)含量及细胞膜透性,显著提高了过氧化氢酶(CAT)、过氧化物酶(POD)、超氧化物歧化酶(SOD)活性,提升了抗氧化指数,但对抗坏血酸(ASA)和谷胱甘肽(GSH)含量的影响不显著。在干旱胁迫第11天,1 mmol/L SA处理的小冠花叶片O2-·产生速率、MDA含量、细胞膜透性显著低于干旱处理79.78%,34.42%,36.96%( P<0.05);CAT酶活性显著高于干旱处理2.45倍( P<0.05);到干旱胁迫第 16天,SOD、POD酶活性比干旱处理提高了3.85和3.63倍。表明外源水杨酸能够降低干旱胁迫下小冠花叶片的活性氧水平,提高小冠花叶片抗氧化能力,缓解干旱胁迫造成的细胞膜脂过氧化损伤,提高了小冠花的抗旱性,尤其以1 mmol/L水杨酸效果最佳。
The aim of these experiments was to determine whether exogenous salicylic acid (SA) could protect Coronilla varia seedlings against drought stress. Leaves of C. varia seedlings grown in pots were sprayed with salicylic acid at four concentrations (0.25, 0.5, 1 and 2 mmol/L) and then the membrane lipid peroxide index, antioxidant enzyme activity, and the contents of non-enzymatic antioxidants in seedling leaves were determined during a drought stress treatment. At concentrations of 0.5-2.0 mmol/L, SA decreased the superoxide anion (O2-·) production rate, hydrogen peroxide (H2O2) content, malondialdehyde (MDA) content, and cell membrane permeability, and increased the activities of the antioxidant enzymes catalase (CAT), peroxidase (POD), and superoxide dismutase (SOD), which increased the antioxidant index capacity. However, at concentrations of 0.5-2.0 mmol/L, SA did not affect the ascorbate acid (ASA) and glutathione (GSH) contents in seedling leaves. At 11 days of drought stress, the O2-· production rate, MDA content, and cell membrane permeability were 79.78%, 34.42%, and 36.96% lower, respectively, and CAT activity was 2.45-fold higher in seedlings treated with 0.5 mmol/L SA than in untreated seedlings ( P<0.05). At 16 days of drought stress, the SOD and POD activities were 3.85-fold and 3.63-fold higher, respectively, in seedlings treated with 0.5 mmol/L SA than in untreated seedlings. These results demonstrated that exogenous SA could improve the drought resistance of C. varia by reducing reactive oxygen levels under drought stress, increasing the activity of the antioxidant system, and alleviating oxidation damage to cell membranes resulting from drought-induced membrane lipid peroxidation. The most effective concentration of SA was 1 mmol/L.
干旱是影响植物生存和生长的主要非生物胁迫因子之一[1]。在正常条件下, 植物体内自由基的形成与清除保持一种动态平衡, 但受到干旱胁迫后, 诱导体内活性氧(包括
邻羟基苯甲酸, 又称水杨酸(salicylic acid, 简称SA), 是一种植物体内产生的简单酚类化合物, 能作为信号分子参与植物体内多种代谢调控, 被认为是一种新的植物激素[7, 8]。大量研究表明, SA可诱导逆境相关蛋白的表达、激活植物超敏反应和系统获得性抗性, 提高植物对重金属镉[9]、高温[10]、盐分[11]和干旱胁迫[12]的耐受能力。近年来, 国内外学者发现SA可以提高干旱胁迫下小麦(Triticum aestivum)[13]、苹果(Malus pumila)[14]、丹参(Salvia miltiorrhiza)[15]、毛竹(Phyllostachys edulis)[16]等植物细胞CAT、POD、SOD等抗氧化酶活性和GSH、ASA等的含量, 降低细胞活性氧水平。水杨酸还能够降低干旱胁迫下番茄(Lycopersicon esculentum)叶片MDA积累和细胞膜透性, 进而增强其抗旱性[17]。
小冠花(Coronilla varia)为豆科小冠花属多年生牧草, 原产于欧洲和地中海地区[18]。其根系发达、抗逆性强、营养价值高, 可作为饲草、绿化、水土保持、观赏及绿肥植物等。我国于1973年将其作为新型牧草及水土保持作物首次引入陕西省[19], 之后在西北、华北等地区推广种植, 对发展当地农业经济和改善生态环境起到了重要作用。由于我国小冠花主要种植区域降雨少且分配不均, 土壤水分缺乏[20], 对小冠花的生长和繁殖产生影响, 因此研究提高小冠花抗旱性问题具有重要意义。
目前, 关于小冠花的研究主要集中于栽培技术[21]、遗传育种[22]等方面, 而关于外源SA对干旱胁迫下小冠花活性氧清除的研究还未见报道。本研究以盆栽控水模拟干旱条件, 用不同浓度的外源SA对干旱胁迫下小冠花幼苗进行叶面喷施处理, 测定小冠花叶片膜脂过氧化指标、抗氧化酶活性和非酶抗氧化物含量, 探讨SA对干旱胁迫条件下小冠花抗氧化能力的影响和诱导小冠花耐旱响应的生理机制, 为合理利用水杨酸解决小冠花栽培中的干旱问题和培育抗旱小冠花品种提供一定科学依据。
供试小冠花品种为绿宝石, 由甘肃创绿草业科技有限公司提供, 该品种抗逆性强, 已在我国西北地区广泛种植。试验于2015年5-8月在兰州甘肃农业大学旱区生态研究所实验室盆栽条件下进行。所用塑料花盆上口径直径25 cm, 下口径直径20 cm, 高20 cm, 每盆装过3 mm筛的田园土4.5 kg。选取饱满、大小一致的小冠花种子均匀播于塑料盆中, 出苗后每盆保留5株, 之后进行常规管理, 待幼苗平均株高长到20 cm左右时(8月1日)进行干旱胁迫和SA处理。
试验设置正常供水(CK)、逐步干旱(DS)和4个浓度(0.25, 0.5, 1和2 mmol/L)SA处理后逐步干旱(DS+SA0.25、DS+SA0.5、DS+SA1、DS+SA2), 共计6个处理, 每处理3次重复, 每重复8盆。8月1日17: 00对SA处理统一叶面喷施4个浓度等量SA溶液[23, 24], 对照和干旱处理用蒸馏水替代。自处理之日起, 对干旱及水杨酸处理停止浇水, 依靠自然蒸发形成逐步干旱处理的梯度。对照正常浇水, 通过称重法使土壤相对含水量始终保持在(75± 3)%。参照Hsiao等[25]提出的水分胁迫梯度划分标准, 土壤相对含水量在55%~60%为轻度胁迫、40%~45%为中度胁迫、30%~35%为重度胁迫。干旱胁迫后, 分别在第2、6、11、16 天和复水12 h后(实测土壤相对含水量分别为74.45%、60.12%、45.38%、32.44%和71.36%)采集测定样本。采样时间为早上7:00-8:00, 随机选择植株顶部生长状况基本一致的幼苗叶片用于测定各项指标[26]。
1.3.1 叶片
H2O2含量测定:采用二甲酚橙法, 按照 Jana等[28]的方法测定。
1.3.2 叶片过氧化伤害程度
MDA含量测定:采用硫代巴比妥酸显色法测定[29]。细胞膜透性用DDS-11A型电导仪参照王关林等[30]的方法测定其电导率值。
抗氧化指数测定:取0.3 g新鲜叶片, 剪碎, 加入5 mL 80%乙醇溶液, 用研钵研磨成匀浆, 过滤, 滤渣用5 mL 80%乙醇洗涤, 过滤, 合并滤液于225 mL容量瓶中, 加塞, 静置20 min后可测定。采用β -胡萝卜素-亚油酸乳化液氧化法测定[29]。
1.3.3 叶片抗氧化酶活性
超氧化物歧化酶(SOD)活性:取0.5 g新鲜叶片, 置于研钵中, 加入5 mL提取液(50 mmol/L磷酸缓冲液, 内含100 μ mol/L EDTA, 1% PVP, 5 mmol/L DTT, pH 7.2), 冰浴研磨, 匀浆在4000 r/min、4 ℃下离心20 min, 上清液为酶提取液。SOD活性采用氮蓝四唑法测定[29], 单位(U/g FW)。
过氧化氢酶(CAT)活性:取0.1 g新鲜叶片, 加入5 mL 4 ℃下预冷的pH 7.8的磷酸缓冲溶液(内含1% PVP), 研磨成匀浆, 转移至25 mL容量瓶中。置于4 ℃冰箱中静置10 min, 取5 mL上清液于4000 r/min离心15 min, 上清液即为酶提取液。CAT活性采用紫外分光光度法测定[29], 单位[U/(g FW· min)]。
过氧化物酶(POD)活性:取0.5 g新鲜叶片, 加入10 mL 20 mmol/L KH2PO4, 于研钵中研磨成匀浆, 3000 r/min离心15 min, 上清液即为酶提取液。POD活性采用愈创木酚比色法测定[29], 单位[U/(g FW· min)]。
1.3.4 抗氧化物质含量
用SPSS 19.0软件对数据进行单因素方差分析(ANOVA), 使用最小显著差异法(least significant difference, LSD)在0.05显著性水平进行差异显著性分析, 利用Excel 2007软件作图。图表中数据为平均值± 标准误。
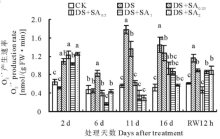
2.1.1
试验期间, 对照小冠花叶片的
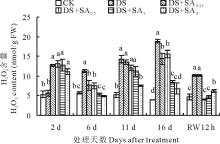
2.1.2 H2O2含量
干旱处理下小冠花叶片H2O2含量在第6天开始迅速上升(图2)。处理第16天达到最大值18.89 nmol/g FW, 显著高于对照(P< 0.05); 干旱胁迫第2天, 4个浓度SA处理H2O2含量均显著高于干旱处理和对照(P< 0.05), 随后开始降低, 胁迫处理第6天, 4个浓度SA处理的叶片H2O2含量分别比干旱低31.73%(DS+SA0.25)、33.24%(DS+SA0.5)、53.69%(DS+SA1)和56.80%(DS+SA2)。胁迫第16天, 1 mmol/L和2 mmol/L SA处理后的小冠花叶片H2O2含量分别为8.50和6.86 nmol/g FW, 较干旱处理减少了55.00%和63.68%。复水12 h后, 各处理的H2O2含量均恢复至较低水平, 但干旱和0.25 mmol/L SA处理仍显著高于其他处理(P< 0.05), 0.5和1.0 mmol/L SA处理的与对照无显著差异(P> 0.05), 2 mmol/L SA 处理显著高于对照(P< 0.05)。
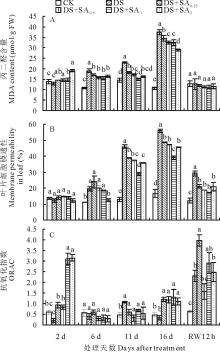
2.2.1 MDA含量
干旱处理下小冠花叶片MDA含量逐渐升高, 在胁迫第6、11、16天MDA含量分别比对照高了76.62%、58.69%和250.19%(图3A)。干旱胁迫第6天, 4个浓度SA处理均显著高于对照但显著低于干旱处理(P< 0.05), 处理第16天, 4个浓度SA处理的叶片MDA含量分别为34.41 μ mol/g FW (DS+SA0.25)、32.48 μ mol/g FW (DS+SA0.5)、32.42 μ mol/g FW (DS+SA1)和28.99 μ mol/g FW (DS+SA2), 分别显著(P< 0.05)比干旱处理低7.99%(DS+SA0.25)、13.16%(DS+SA0.5)、13.32%(DS+SA1)和22.49%(DS+SA2)。复水12 h后, 各处理的MDA含量均恢复至较低水平且与对照无显著差异(P> 0.05)。
2.2.2 细胞膜相对透性
随干旱胁迫的持续, 干旱处理和SA处理下的小冠花叶片细胞膜透性均逐渐升高, 在胁迫第6、11、16天干旱处理小冠花叶片细胞膜透性分别比对照高了81.82%、253.85%和229.41%(图3B)。在第11天, SA处理下的小冠花叶片细胞膜透性分别为38.72%(DS+SA0.25)、37.28%(DS+SA0.5)、28.92%(DS+SA1)和35.65%(DS+SA2), 均显著低于干旱胁迫(P< 0.05); 第16天, 4个浓度SA处理的叶片细胞膜透性显著低于干旱处理, 分别比干旱处理低了14.29%(DS+SA0.25)、16.07%(DS+SA0.5)、32.14%(DS+SA1)和17.86%(DS+SA2), 但仍显著高于对照(P< 0.05)。复水12 h后, 各处理细胞膜透性降至较低水平, 但干旱处理仍显著高于其他处理, 4个浓度SA处理间无显著差异但显著高于对照(P< 0.05)。
2.2.3 抗氧化指数
试验中, 对照小冠花叶片的抗氧化指数基本稳定在0.5~0.6之间(图3C); 干旱胁迫处理的叶片抗氧化指数在第6天开始急速上升, 第 11天达到最大值1.06, 显著高于对照(P< 0.05), 之后下降, 第16天仅为0.34。说明重度干旱胁迫下小冠花抗氧化能力减弱; SA处理的小冠花抗氧化指数呈现先下降后上升的趋势; 在胁迫第2天显著高于干旱处理和对照(P< 0.05), 之后开始降低, 第16天4个浓度SA处理的叶片抗氧化指数分别高于干旱处理3.50(DS+SA0.25)、3.47(DS+SA0.5)、3.85(DS+SA1)和3.26(DS+SA2)倍, 但SA各处理间差异并不显著。复水12 h后, 各处理抗氧化指数继续升高, 其中, 0.25 mmol/L SA处理显著高于干旱处理(P< 0.05), 其他SA处理与干旱处理无显著差异(P> 0.05)。
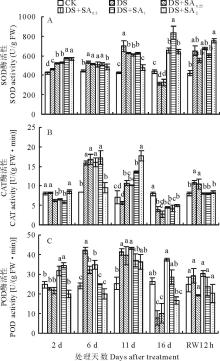
2.3.1 SOD活性
干旱处理小冠花叶片SOD酶活性于胁迫处理的第6天开始急速上升(图4A), 第 11天达到最大值698.14 U/g FW, 显著高于对照64.62%(P< 0.05), 之后下降, 第16天仅为314.02 U/g FW, 显著低于对照(P< 0.05); 干旱胁迫第2天, 4个浓度SA处理下SOD酶活性均显著高于干旱处理和对照(P< 0.05), 随后开始缓慢上升, 第11天SA处理均显著低于干旱处理(P< 0.05); 第16天0.5 mmol/L及以上浓度的SA处理的小冠花叶片SOD活性分别达到653.61 U/g FW(DS+SA0.5)、834.13 U/g FW(DS+SA1)、641.01 U/g FW(DS+SA2), 比对照显著高了49.43%(DS+SA0.5)、90.85%(DS+SA1)和46.68%(DS+SA2)(P< 0.05), 干旱和0.25 mmol/L SA处理显著低于对照(P< 0.05)。复水后2 mmol/L SA处理显著高于对照(P< 0.05), 其他SA处理与对照和干旱处理无显著差异(P> 0.05)。
2.3.2 CAT活性
干旱胁迫下小冠花叶片CAT酶活性呈先上升后下降的趋势(图4B), 干旱处理第6天小冠花叶片CAT酶活性达到15.87 U/(g FW· min), 比对照增加了88.25%, 随后开始降低, 胁迫处理第16天, 叶片CAT酶活性为3.96 U/(g FW· min), 比对照低了50.13%; 在胁迫第2天, 2 mmol/L SA处理小冠花叶片CAT酶活性与对照和干旱处理无显著差异(P> 0.05), 其他SA处理均显著低于对照和干旱处理; 胁迫第11天, 4个浓度SA处理的小冠花叶片CAT活性显著高于干旱处理91.94%(DS+SA0.25)、82.08%(DS+SA0.5)、144.98%(DS+SA1)和217.20%(DS+SA2)(P< 0.05), 之后开始降低, 胁迫处理第16天, 4个浓度SA处理的叶片CAT活性显著(P< 0.05)低于对照, 分别比对照低65.24%(DS+SA0.25)、43.45%(DS+SA0.5)、46.47%(DS+SA1)和37.41%(DS+SA2), 4个浓度SA处理与干旱处理无显著差异(P> 0.05)。复水后, 各处理下的小冠花CAT活性恢复, 0.25 mmol/L SA处理与干旱处理仍显著高于对照和其他SA处理(P< 0.05)。
2.3.3 POD活性
对照小冠花叶片的POD酶活性基本稳定在25.00 U/(g FW· min)左右(图4C); 干旱胁迫下, 叶片POD酶活性于第2天开始急速上升至第11天达到最大值41.34 U/(g FW· min), 显著高于对照63.65%(P< 0.05); SA处理的小冠花叶片POD酶活性先升高后降低, 在胁迫第6天显著低于干旱处理(P< 0.05), 胁迫处理第11天, SA处理小冠花的叶片POD酶活性与干旱处理无显著差异(P> 0.05)。在干旱胁迫第16天, 各处理POD酶活性均下降, 其中干旱处理和0.25 mmol/L SA处理小冠花叶片POD酶活性仅为7~10 U/(g FW· min), 显著低于对照(P< 0.05); 其他SA处理小冠花的叶片POD酶活性显著高于干旱处理(P< 0.05), 分别是干旱的3.77(DS+SA0.5)、2.63(DS+SA1)和1.14(DS+SA2)倍。复水12 h后, 干旱和4个浓度SA处理下的小冠花POD活性恢复至对照水平, 各处理间无显著差异(P> 0.05)。
2.4.1 抗坏血酸含量
随干旱胁迫程度的加剧, 小冠花叶片抗坏血酸含量逐渐升高。在胁迫第6、11、16天干旱处理小冠花叶片ASA含量分别比对照高61.79%、56.49%和71.56%(图5)。胁迫第2天4个浓度SA处理的小冠花叶片ASA含量显著高于对照和干旱处理(P< 0.05); 胁迫第6天后, SA处理与干旱处理无显著差异(P> 0.05)。复水12 h后, 各处理ASA含量降低但仍显著大于对照(P< 0.05), 0.25和2 mmol/L SA处理与干旱处理无差异, 0.5和1 mmol/L SA处理显著低于干旱处理11.56%和9.25%(P< 0.05)。
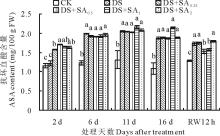 | 图5 干旱胁迫下外源水杨酸处理小冠花叶片抗坏血酸含量Fig.5 Effects of exogenous salicylic acid on ASA content in the seedling leaves of C. varia under drought stress |
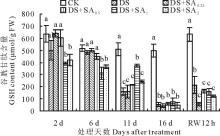
2.4.2 谷胱甘肽含量
试验期间, 对照小冠花叶片的谷胱甘肽含量基本稳定在500~600 μ mol/g FW(图6)。但干旱处理和SA处理小冠花叶片GSH含量均持续下降, 在干旱胁迫第2天和第6天, 1和2 mmol/L SA处理显著低于干旱处理(P< 0.05)。胁迫处理第16天, SA处理下的小冠花叶片GSH含量显著低于对照91.51%(DS+SA0.25)、88.13%(DS+SA0.5)、84.54%(DS+SA1)和90.11%(DS+SA2)(P< 0.05); SA处理与干旱处理无差异(P> 0.05)。复水12 h后, 各处理GSH含量有所回升, 但均显著低于对照(P< 0.05)。
植物在正常的生长条件下, 体内活性氧物质的产生与清除处于一种动态平衡, 一般不会导致植物受到伤害[32]。但当植物受外界环境胁迫伤害后, 细胞膜受到破坏, 膜透性增大, 体内会产生大量的活性氧自由基(· OH、
当植物受到逆境胁迫时, 细胞内活性氧自由基迅速积累, 引起细胞膜过氧化, MDA是膜脂过氧化作用的最终产物, 它的增加表明膜脂过氧化的程度加重, 导致细胞膜脂破坏, 电解质外渗, 使外渗液的相对电导率增加[37], 表明细胞受到了损伤。在本研究中, 随着活性氧的迅速积累, 小冠花MDA含量和细胞膜透性开始增加, 在胁迫第16天(土壤相对含水量为32.44%)时达到37.40 μ mol/g FW和55.96%, 均显著高于对照, 这与井大炜等[38]对杨树(Populus)幼苗的研究结果一致。经1 mmol/L SA处理的小冠花叶片MDA含量和细胞膜透性均显著低于干旱处理, 这与陆晓民等[39]用0.5 mmol/L SA显著降低了毛豆(Glycine max)叶片MDA含量和细胞膜透性的结果相一致。表明干旱胁迫显著增加了叶片的相对电导率和膜脂过氧化产物MDA的含量, 而 SA 处理能降低干旱胁迫下小冠花叶片的相对电导率, 缓解膜脂过氧化产物MDA的产生, 对叶片膜结构具有一定的保护作用。抗氧化指数表示植物抗氧化能力的大小, 根据郭鸰等[40]和田迪英等[41]的研究发现, 抗氧化指数越高, 植物的抗氧化能力越强。本试验中, SA处理的小冠花叶片抗氧化指数在胁迫第16天(土壤相对含水量为32.44%)时均显著高于干旱处理, 其中1 mmol/L SA处理的小冠花叶片抗氧化指数比干旱处理增加了2.85倍。表明适宜浓度的SA处理, 可以提高干旱胁迫下小冠花叶片抗氧化指数, 从而降低干旱胁迫对小冠花幼苗造成的伤害。
植物为保护自身免受活性氧的伤害, 在长期的进化过程中演化出了一套适应机制和策略, 主要包括CAT、POD、SOD等抗氧化酶类和ASA-GSH循环系统, 抗氧化酶类可以通过清除自由基, 保护膜系统, 避免植物受到胁迫伤害[42]。SOD, POD和CAT组成抗氧化防御系统, SOD催化
本研究表明, 在干旱胁迫下对小冠花进行一定浓度的水杨酸处理, 可以提高小冠花叶片抗氧化能力, 降低小冠花叶片活性氧积累, 抑制膜脂过氧化, 减轻干旱胁迫对小冠花生长的危害。综合不同浓度SA在干旱胁迫下对小冠花各指标影响的分析, 本试验认为, 在小冠花生产中, 如遇干旱胁迫, 可考虑喷施1 mmol/L SA以起到减轻伤害、降低生产损失的作用。但是, SA 缓解干旱胁迫是一个复杂的调控机制, 还需进一步研究探讨。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|