作者简介:张咏梅(1974-),女,甘肃武威人,副研究员,博士。E-mail:zym824@sina.com
为了了解植物细胞结构与抗病性的关系。以豌豆白粉菌( Erysiphe pisi)接种2个抗性不同的紫花苜蓿品种,对接种后0、3、7、10 d的叶片制作了石蜡切片,显微观察叶片细胞横切结构。本研究首次发现:病原菌侵染后,抗病品种庆阳苜蓿叶片栅栏细胞由长圆形变为多个近圆形细胞,细胞分布均匀,排列紧凑,叶肉细胞由侵染前的4~5层变为7~8层细胞;感病品种德宝苜蓿栅栏细胞结构变化向两个方向发展:一是长圆形栅栏细胞变为多个卵圆形小细胞,但细胞分布不匀,部分细胞间出现较大间隙;二是叶片维管束之间的栅栏细胞由长圆形变为卵圆形小细胞,而在维管束处的栅栏细胞仍为长圆形,紧靠维管束,排列在一起,细胞间隙小。
To explore the relationship between plant cell structure and disease resistance, two alfalfa ( Medicago sativa) cultivars with different levels of resistance were analyzed after inoculation with the powdery mildew fungus, Erysiphe pisi. Leaves were harvested at 0, 3, 7, and 10 days after inoculation, embedded in paraffin, and cut into sections to observe cell structural changes. The cellular structure of palisade tissue changed after infection with E. pisi. Palisade cells of the resistant alfalfa line changed from a single long cylindrical cell into several subrotund cells that were distributed evenly and arranged compactly. The mesophyll cell layer increased from 4-5-cells thick before infection to 7-8-cells thick after infection. There were two notable changes in the palisade cell structure of susceptible alfalfa. One was that long cylindrical palisade cells changed into several subrotund cells with a non-uniform distribution and more space between cells. The other was that palisade cells near vascular bundles retained their long cylindrical shape and stayed in a compact arrangement with only small spaces between cells.
苜蓿(Medicago sativa)是一种产量高、品质优、耐刈割的优良豆科牧草, 对于我国国民经济和畜牧业发展具有重要作用。其根系发达, 具有根瘤菌, 更是改良土壤和水土保持的重要植物[1, 2]。由于苜蓿的大面积种植, 粗放型经营, 为病害的猖獗创造了条件。据不完全统计, 全国的苜蓿病害大约有数十种[3, 4], 严重影响苜蓿的产量和饲用品质(营养成分降低, 有害物质增加), 进而影响家畜健康, 降低畜产品质量[5]。近年来, 随着我国草地畜牧业的发展和农业产业结构的调整, 苜蓿种植面积进一步扩大, 病害问题严重影响我国畜牧业和草产业的长足发展。
植物受到病原菌侵染后, 其形态、结构和生理生化特征常常发生改变, 这些变化大多与植物的抗病性有关。小麦(Triticum aestivum)叶片受白粉菌侵染后, 叶肉细胞中叶绿体的形状由原来的椭圆形变成了圆球形, 叶绿体的膜可能由于解体变得模糊[6]; 杉苗叶片受炭疽病菌(Colletotrichum gloeosporioides)侵染后, 在受害程度不同的寄主细胞中, 叶绿体、线粒体、细胞壁、细胞质、高尔基小泡和质膜的结构、大小及内含物有不同程度的变化[7]; 甘薯(Dioscorea esculenta)被薯瘟菌(Ralstonia solanacearum)侵染后, 感病品种‘ 胜利百号’ 叶片的细胞膜完整性被破坏, 叶绿体数目减少、膨胀模糊、基粒片层松散解体以及淀粉粒变小; 而抗病品种‘ 湘薯75-55’ 细胞膜结构完整, 叶绿体基粒片层排列整齐。近年来, 人们对于病原微生物侵染对植物细胞内超微结构的研究较多[6, 8-12]。其实, 细胞才是植物应对病原物侵染的基本单位。目前, 对病原菌侵染植物后, 植物细胞学变化的研究相对较少。有报道, 黑腐病原菌 YL-17 菌种侵染大白菜(Brassica camperstris)后, 幼苗叶肉细胞变大, 细胞数目变少, 尤其是栅栏组织细胞排列逐渐疏松, 细胞内叶绿体由原来的贴壁分布变为混乱分布, 且数量逐渐变少[13]。
为了掌握植物细胞结构变化与抗病性的关系, 及其在植物抵御病害侵染中的作用。依据李敏权等[14]和金娟等[15]对紫花苜蓿抗白粉病评价的研究成果, 选择德宝(Derby)作为高感品种(S), 庆阳(Qingyang)苜蓿作为高抗品种(R), 以叶部病害、活体营养型真菌-豌豆白粉菌(Erysiphe pisi)接种, 研究了白粉菌侵染抗病和感病紫花苜蓿品种后, 叶片细胞结构的变化, 对于明确苜蓿白粉病的侵染机理和过程, 了解细胞变化在植物抗病性中的积极作用, 培育和利用抗病品种防治苜蓿白粉病具有一定的意义。
紫花苜蓿材料“ 德宝” 和“ 庆阳苜蓿” 种子由甘肃农业大学曹致中教授馈赠。
本研究试验材料于2015年7月在甘肃农业大学东南角试验基地种植。选取籽粒饱满的苜蓿种子播种于直径30 cm的花盆中, 浇透水, 并覆以PE薄膜(0.01 mm)保湿。出苗后, 于黄昏时去掉薄膜。待幼苗长至5 cm高时, 进行疏苗, 每盆保留15株左右健壮幼苗。每个材料各种植15盆。
紫花苜蓿白粉菌病原采自甘肃农业大学兰州牧草试验站。以水玻片法, 光学显微镜观察, 螺旋测微尺湄时, 观察计测白粉菌病原的闭囊壳、子囊、子囊孢子、附属丝、分生孢子等形态特征。根据郑儒永等[16]、李敏权等[17]、Boesewinkel[18]及Hanson[19]的研究成果, 通过形态学性状比较, 本白粉菌病原应属于豌豆白粉菌(Erysiphe pisi)。鉴定后, 在位于甘肃农业大学中部的牧草试验基地甘农3号紫花苜蓿上隔离繁殖。
豌豆白粉菌采自甘肃农业大学兰州牧草试验站, 经鉴别确定无误后在位于甘肃农业大学中部的牧草与草坪草试验基地隔离生长的甘农3号紫花苜蓿上繁殖。2015年8月25日收集新鲜菌丝体和分生孢子配制成悬浮液采用喷涂法进行接种。接种后搭小拱棚并覆以PE膜保湿。
分别于接种后0、3、7、10 d取样, 取苜蓿小叶置5 mL离心管中加入卡诺液固定, 观察菌丝生长情况, 并制作石蜡切片对叶片组织解剖学做显微观察。
紫花苜蓿小叶剪下后浸入卡诺固定液(乙醇∶ 冰乙酸=3∶ 1)中, 叶绿素浸出后, 更换卡诺固定液至叶片完全亮白, 转入70%乙醇中保存。系列复水, 然后以0.05%锥虫蓝(乳酸∶ 甘油∶ 水=1∶ 1∶ 1)对菌丝体染色, 观察菌丝长度、分枝数和吸器。
采用常规石蜡切片技术。将卡诺液固定的材料, 经酒精系列脱水, 二甲苯透明, 石蜡包埋后, Leica RM2265旋转切片机(德国)切片。切片厚度为5 μ m, 充分烤片后, 进行番红-固绿双染色。ZEISS Imager A2型显微摄像生物显微镜(德国)下观察。Axio Cam MRc5系统进行图像采集。
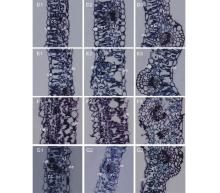
苜蓿叶片具有典型的异面叶结构, 由上、下表皮细胞和叶肉细胞组成(图1)。接种E. pisi前, 健康叶片的表皮细胞为单层细胞, 呈圆形或长圆形, 排列紧密, 无细胞间隙(图1 A1-A3)。上、下表皮细胞之间是结构明显不同的两种叶肉细胞— — 长圆形的栅栏组织细胞和卵圆形的海绵组织细胞(图1 A1-A3)。栅栏细胞1层或1~2层, 排列整齐像一道篱笆位于叶片近轴面, 细胞间隙小; 远轴面的海绵细胞约3~4层, 体积较小, 分布均匀, 排列较为疏松, 有较大的细胞间隙(图1 A1-A3); 叶肉细胞内, 沿细胞内壁排列的蓝绿色小点即为叶绿体(图1)。
病原菌侵染3 d后, 栅栏组织细胞形态发生了巨变。细胞扭曲变形, 细胞间隙增大(图1 B1, B3); 有些栅栏细胞从中断开形成新的细胞, 使栅栏细胞由长圆形变为短圆形细胞(图1 B2)。侵染7 d后, 栅栏细胞由一个长圆形细胞变为多个偏圆形小细胞 (图1 C1-C3)。叶肉细胞— — 栅栏组织细胞和海绵组织细胞— — 由侵染前的4~5层细胞变为7~8层细胞, 卵圆形小细胞分布均匀, 排列紧凑。叶肉细胞内, 叶绿体仍紧贴细胞内壁分布在四周。
感病品种德宝苜蓿的健康叶片与抗病品种庆阳苜蓿叶片类似。无色(由于不含叶绿体)的上、下表皮细胞间是排列规范的叶肉细胞(图2 D1-D3), 栅栏组织排列整齐紧密, 其下是细胞间隙疏松的海绵组织。E. pisi侵染叶片后, 栅栏细胞变得细长, 细胞间隙变大(图2 E1, E3); 有些栅栏细胞变形, 致使气孔细胞下腔出现大的空隙(图2 E2)。随着病原菌丝的扩展, 栅栏细胞结构变化向两个方向发展:一是长圆形栅栏细胞变为多个卵圆形小细胞(图2 F1-F3), 且细胞分布不匀, 部分细胞间出现较大间隙; 二是叶片维管束之间的栅栏细胞由长圆形变为卵圆形小细胞(图2 G1, G3), 而在维管束处的栅栏细胞仍为长圆形, 紧密地排列在一起, 细胞间隙小(图 2 G2)。叶肉细胞内, 叶绿体仍紧贴细胞内壁分布在四周。
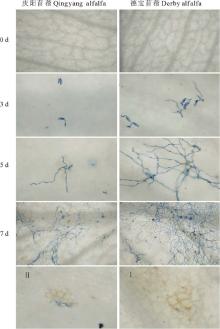
以锥虫蓝染色病原菌丝体, 对E. pisi在紫花苜蓿叶片上的扩展进行观察(图3)。接种3 d, 分生孢子产生吸器, 寻找适宜的入侵点; 德宝叶片上吸器发育迅速, 菌丝伸长生长, 有些菌丝出现分枝, 分枝向外围扩展, 进而形成更多的吸器吸收营养(图3, 3 d); 至7 d, 菌丝伸长生长, 分枝更多(图3, 5 d); 观察发现, 植物细胞过敏反应坏死处, 菌丝扩展受到较明显的抑制(图3 H, I), 其他部位随着病原菌的进一步扩展、侵染, 菌丝覆盖至整个叶面, 密结成网(图3, 7 d)。
杨若林等[6]报道白粉菌侵染小麦后, 叶肉细胞排列变得比较松散, 细胞及叶绿体的轮廓变得模糊不清, 部分叶绿体还从细胞周边迁移到细胞的中央; 维管束鞘和维管束细胞的壁变厚, 维管束鞘的细胞之间、维管束鞘与维管束的细胞之间以及维管束内细胞之间的界限也变得模糊不清; 维管束鞘内层和外层的细胞萎缩或解体。白粉菌侵染使小麦叶片表皮细胞遭受破坏, 对叶肉和维管束组织也产生了一定的影响。黑腐病原菌 YL-17 菌种侵染大白菜幼苗叶片后, 大白菜幼苗叶肉细胞变大, 细胞数目变少, 细胞排列逐渐疏松, 尤其是栅栏组织细胞; 细胞内叶绿体由原来的贴壁分布变为混乱分布, 且数量逐渐变少[13]。李海英等[20]在对大豆(Glycine max)灰斑病的研究中发现, 抗病大豆品种叶片的栅栏组织层数相对较多, 且排列整齐紧密, 并且第一层栅栏组织比感病品种显著肥厚。冯丽贞等[21]在对桉树(Eucalyptus robusta)焦枯病的研究中发现, 高抗桉树品种的叶片栅栏组织细胞排列整齐、紧密, 且层数相对较多, 海绵组织细胞间隙小。前人的研究认为栅栏组织可能在抵抗病害侵染中扮演着重要角色[22], 栅栏组织发达可能是植物抗逆性叶的结构特征[23]。
本人研究结论不同于前人报道。首次发现, 接种E. pisi后, 紫花苜蓿叶片的栅栏组织细胞由一个长圆形细胞变为多个偏圆形小细胞, 增加了进行光合作用的叶肉细胞层数。结构决定功能。这种变化或许可以解释为E. pisi侵染后, 苜蓿将营养物质和光合作用功能局域化, 光合单位最小化, 这可能是苜蓿抵御病原菌侵染的策略之一。栅栏组织细胞含有大量的叶绿体, 是植物光合作用的重要场所, 其体积大, 在上表皮细胞下只有1层或1~2层。一旦病原菌侵染成功, 损害栅栏组织细胞的光合作用功能, 可能对植物造成巨大伤害。苜蓿叶片栅栏组织细胞的形态学改变可能规避这种风险, 将病原菌对植物叶片光合作用的损害降低到最小, 将功能发挥到最大。
一般认为, 寄主植物的抗病性是植株在形态结构和生理生化等方面所表现的综合结果。前者主要通过寄主形态结构的差异产生物理上的阻碍, 或通过诱导寄主形态结构发生改变而机械地阻碍病原菌的侵染; 后者则主要是当病菌侵入寄主时或侵入后, 诱导寄主的生理生化过程发生改变而抵抗病原物的侵染。本文的研究或许可以补充这一结论, 寄主植株在形态结构方面的变化不仅仅增加了病原菌入侵的机械阻碍, 而且通过保持细胞的基本功能正常运转来减轻病原菌的伤害。
紫花苜蓿受白粉菌侵染后, 无论抗性强弱, 叶片叶肉细胞, 尤其是栅栏组织细胞结构发生了改变。这种叶片内叶肉细胞结构和形态的变化可能对植物抗病性具有积极作用。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|