作者简介:舒必超(1982-),男,湖南桃源人,讲师,硕士。E-mail: sbc244@163.com
以耐寒性差异较大的杂交狗牙根品种运动百慕大、天堂419和普通狗牙根品种保定狗牙根为试验材料,分析了昼夜温度为适温(30 ℃/25 ℃)、亚适温(18 ℃/12 ℃)、冷害(8 ℃/4 ℃)和冻害(4 ℃/-4 ℃)4种温度处理下,低温对狗牙根生长速率和草坪质量、MDA含量、叶绿素荧光( Fv/ Fm)、光合作用( Pn、 Gs、 Ci、 Tr)、H2O2和
In order to investigate the effects of low temperature stress on the plant growth rate, turf quality, MDA content, Fv/ Fm, photosynthesis [ Pn (net photosynthetic rate); Gs (stomatal conductance); Ci (intercellular CO2 concentration); Tr (transpiration rate)], H2O2 and
低温是影响植物生长发育主要的非生物因素之一。低温胁迫常引起植物体内
低温常诱导一系列耐寒相关基因的表达, 从而提高植物的耐低温能力。植物抗寒能力的获得, 在分子水平上是植物对逆境产生迅速应答、逆境信号在体内转导, 由此调控应答和抵御基因表达综合作用的结果[3]。在植物体内的低温逆境信号转导通路中, CBF类转录因子在增强植物适应和抵御低温的能力中具有重要作用。CBF通过感受上游传递的低温信号, 并将信号向下游COR基因传递, 而COR基因编码的蛋白可直接或间接的激活下游多种编码低渗物质的基因表达, 进而增加可溶性糖, 如蔗糖、果糖、葡萄糖、棉籽糖等的含量, 增强植株的抗冻性[4]。另外, COR15a 调控了编码亲水的LEA蛋白的表达, 从而增强了植株忍耐脱水的能力, 并且COR15a 编码蛋白是一种亲水多肽, 具有α -螺旋亲水区, 定位于叶绿体中, 可直接作为抗冻多肽保持叶绿体被膜的结构, 防止冰冻低温下叶绿体结构的伤害[5]。
狗牙根(Cynodon dactylon)是暖季型草坪草中使用最广泛的草种之一, 由于其具有植株低矮、草坪质量优异、抗旱、耐践踏等优良特性而广泛应用于热带、亚热带及温带地区的公共绿地、运动场草坪、高尔夫球场、护坡草坪的建植[6]。温度是影响狗牙根分布和生长发育的重要环境因子, 其最适生长温度为25~35 ℃, 当日均温度≤ 12 ℃时生长减缓, 7~10 ℃时枯黄, 随后进入休眠期[7]。由于狗牙根对低温抵抗能力差, 我国目前推广应用的狗牙根品种通常表现为在南方地区绿色期较短, 在过渡带地区易受到低温伤害而出现死亡, 在北方地区则不能安全越冬等问题, 极大地降低了狗牙根的坪用价值和限制了狗牙根的推广应用[6, 7, 8, 9]。因此, 进行抗寒机理的探索已成为狗牙根研究的重要内容。此外, 选育抗寒性强的狗牙根品种也成为新品种选育的最重要育种目标之一。以往国内外围绕狗牙根抗寒性鉴定、自然低温或实验室低温处理对狗牙根草坪质量、根形态特征、膜结构、酶活性、蛋白合成、光合和呼吸、内源激素和碳水化合物等生理生化过程的影响开展了较多的研究[6, 7, 8, 9, 10, 11, 12], 而对不同抗寒性狗牙根品种在不同低温胁迫下抗氧化酶基因以及与抗寒性密切相关基因的表达差异缺乏探讨。本研究以3个不同耐寒性的狗牙根品种为试验材料, 探讨梯度降温处理下低温胁迫对不同耐寒性狗牙根品种的生长、光合作用、抗氧化酶活性及其基因表达、抗寒相关基因的表达差异变化及其与狗牙根抗寒性的关系, 为不同抗寒性狗牙根品种的选择、狗牙根在寒冷地区的栽培应用及其抗寒育种提供理论指导。
本研究依据前期研究结果[13], 选择采用了3个耐寒性不同的狗牙根品种, 分别为运动百慕大(C. dactylon× C. trasvalensis cv. Tifsport)(耐寒性较强)、天堂419(C. dactylon× C. trasvalensis cv. Tifway)(耐寒性较弱)和保定狗牙根(C. dactylon cv. Baoding)(耐寒性弱)。其中, 保定狗牙根引自河北农业大学, 其他2个狗牙根品种引自湖南天泉生态草业工程有限公司。
各狗牙根品种分别于2015年6月用草茎种植于湖南农业大学校内教学实习基地。2015年9月, 挖取成坪后的狗牙根草皮块洗净其根部泥土, 种植于上口径25 cm、下口径15 cm、高20 cm的塑料盆中, 栽培基质为市售花土和河沙, 按重量比1∶ 1混合均匀, 每盆用土1.4 kg。每个品种种植4盆, 共计20盆, 放置于温室大棚内进行培养。
培养约45 d待根系和冠层基本建成后, 将各盆栽材料转入人工气候箱中分别进行梯度降温处理:1)适温处理。初始温度30 ℃/25 ℃(昼/夜)处理7 d; 2)亚适温处理。经初始处理后的材料再将气候箱温度降为18 ℃/12 ℃(昼/夜)处理7 d; 3)冷害处理。初始和亚适温处理后的材料再经8 ℃/4 ℃(昼/夜)处理7 d; 4)冻害处理。经初始、亚适温和冷害处理后的材料再转入温度为4 ℃/-4 ℃的生长箱中处理48 h。人工气候箱相对湿度设为65%~75%, 12 h光照时间和12000 lx的光强。各处理设4次重复(4 盆), 在各梯度降温处理结束时进行冠层高度、叶绿素荧光(Fv/Fm)和光合作用的测定, 同时每盆取成熟狗牙根植株功能叶片混匀后, 液氮速冻, 保存于-80 ℃冰箱, 用于各生理指标和基因表达的测定分析。
1)生长速率:降温处理前将冠层修剪整齐并测定高度, 然后在各梯度温度处理结束时用直尺测定冠层高度, 两者之差再除以处理天数为生长速率, 单位为cm· d-1。
2)
3)抗氧化酶活性测定:采用pH 值7.8的磷酸缓冲液(PBS)提取酶液。根据Hu 等[14]的方法, 用硫酸钛法测定H2O2含量, 羟胺氧化反应法测定
4)叶绿素荧光:采用美国OPTI-sciences OS-5p 便携式脉冲调制叶绿素荧光仪测定叶片暗适应30 min后的Fv/Fm值。
5)光合作用测定:在10:00-14:00, 用Licor-6400光合仪测定狗牙根倒数第3片叶的净光合速率, 蒸腾速率和气孔导度, 测定条件设定为380 μ mol· mol-1 CO2, 400 μ mol· m-2· s-1的光照强度。
6)基因表达分析:采用Trizol试剂盒提取黑麦草叶片总RNA, 用Nanodrop 2000检测浓度和纯度, 用1%琼脂糖凝胶电泳检测完整性。根据Fermentas cDNA synthesis 试剂盒说明书进行反转录合成cDNA。参考TaKara 公司的SYBR System操作手册, 采用ABI 7500实时荧光定量PCR仪进行PCR扩增。反应程序为:95 ℃预变性30 s, 95 ℃ 5 s, 52~55 ℃ 20 s, 40个循环。每个处理设3个重复。基因特异性引物为F/R, 以Actin基因为内参, 序列参考Hu等[15]的方法进行合成(表1)。根据得到的CT值, 利用2-Δ Δ CT法, 分别计算目标基因在不同处理下的相对表达量。
采用SAS for Window 9.0软件进行试验数据统计方差分析, 采用单因素方差分析和Duncan多重比较检验不同处理间的差异(P< 0.05)。
从表2可看出, 在适温条件下3个狗牙根品种间的生长速率无显著性差异, 保持在2.0~2.2 cm· d-1。随着生长温度的降低, 3个狗牙根品种的生长速率均显著下降。在亚适温条件下, 运动百慕大、天堂419和保定狗牙根的生长速率分别下降至适温的73%, 66%和60%, 而温度下降至冷害时, 生长速率则分别下降至适温的25%, 17%和11%。冻害温度下, 3个狗牙根品种均停止生长, 生长速率为零。
| 表2 低温胁迫对狗牙根生长速率的影响 Table 2 Effect of low temperature stress on growth rate in bermudagrass (cm· d-1) |
从表3可知, 随着温度的降低, 3个狗牙根品种叶片的Fv/Fm值均呈下降趋势, 但不同耐寒性品种其Fv/Fm值下降程度不一样。在适温条件下, 3个狗牙根品种叶片的Fv/Fm值无显著性差异; 在亚适温条件下, 运动百慕大的Fv/Fm值与天堂419间无显著性差异, 天堂419与保定狗牙根差异不显著; 当温度下降至冷害和冻害时, 运动百慕大的Fv/Fm值均显著高于天堂419和保定狗牙根两个品种, 但在冷害温度时天堂419和保定狗牙根间无显著性差异, 当温度下降至冻害时天堂419的Fv/Fm值显著高于保定狗牙根。
| 表3 低温胁迫对狗牙根叶绿素荧光的影响 Table 3 Effect of low temperature stress on Fv/Fm in bermudagrass |
2.3.1 对净光合速率的影响 由表4可知, 3个狗牙根品种叶片的净光合速率(Pn)均随着温度的降低而显著下降, 但不同耐寒性品种其Pn下降程度不同。在亚适温条件下, 运动百慕大、天堂419和保定狗牙根的Pn分别下降至适温对照的69%, 56%和47%; 温度下降至冷害时, 则分别下降至适温的35%, 21%和14%。在冻害温度下, 3个品种的净光合速率则下降至0.6~1.7 μ mol CO2· m-2· s-1, 分别仅为适温对照条件下的10%, 6%和4%。在适温条件下3个品种的净光合速率无显著差异, 但在亚适温、冷害和冻害条件下, 运动百慕大显著高于天堂419和保定狗牙根。
| 表4 低温胁迫对狗牙根净光合速率的影响 Table 4 Effect of low temperature stress on net photosynthetic rate (Pn) in bermudagrass (μ mol CO2· m-2· s-1) |
2.3.2 对气孔导度的影响 在适温条件下, 3个狗牙根品种叶片气孔导度(Gs)无显著差异(表5)。随着温度的降低, 3个狗牙根品种叶片Gs均呈显著下降趋势, 但下降程度差异较大, 其中以保定狗牙根叶片Gs下降幅度最大, 其次为天堂419, 运动百慕大在3个品种中下降程度相对较小。在亚适温条件下, 运动百慕大、天堂419和保定狗牙根叶片Gs分别下降至适温对照的56%, 41%和32%; 在冷害温度下则分别下降至适温对照的39%, 25%和16%; 当温度下降至零下后, 运动百慕大、天堂419 和保定狗牙根叶片Gs 急剧下降, 分别仅为适温的9%, 7%和5%。
| 表5 低温胁迫对狗牙根叶片气孔导度的影响 Table 5 Effect of low temperature stress on leaf stomotal conductance (Gs) in bermudagrass (mol H2O· m-2· s-1) |
2.3.3 对胞间CO2浓度的影响 由表6可知, 在适温、亚适温和冷害条件下, 3个狗牙根品种叶片的Ci随着温度的下降而降低, 在冻害温度下3个品种的Ci与对照相比则显著上升。在适温条件下3个狗牙根品种叶片的Ci无显著性差异, 但在亚适温条件下, 运动百慕大的Ci显著高于天堂419和保定狗牙根; 在冷害下, 天堂419的Ci与运动百慕大和保定狗牙根差异不显著, 但运动百慕大的Ci显著高于保定狗牙根。在亚适温条件下, 运动百慕大、天堂419和保定狗牙根的Ci分别下降至适温对照的76%, 68%和62%, 温度下降至冷害时3个品种的Ci则分别下降至适温对照的64%, 57%和48%。在冻害条件下, 运动百慕大、天堂419和保定狗牙根的Ci则分别下升高了13.9%, 17%和18.9%。
| 表6 低温胁迫对狗牙根叶片胞间CO2浓度的影响 Table 6 Effect of low temperature stress on leaf intercellular CO2 concentration (Ci) in bermudagrass (μ mol CO2· mol-1) |
2.3.4 对蒸腾速率的影响 由表7可知, 3个狗牙根品种叶片Tr均随着温度的下降而降低, 其中以保定狗牙根下降幅度最大, 运动百慕大下降幅度最小, 天堂419居中。在亚适温条件下, 运动百慕大、天堂419和保定狗牙根的Tr分别下降至适温对照的61%, 45%和43%, 温度下降至冷害时3个品种的Tr则分别下降至适温对照的21%, 13%和10%。当温度下降至冻害时, 运动百慕大、天堂419和保定狗牙根的Tr分别下降至适温对照的11%, 7%和4%。
| 表7 低温胁迫对狗牙根叶片蒸腾速率的影响 Table 7 Effect of low temperature stress on leaf transpiration rate (Tr) in bermudagrass (mmol H2O· m-2· s-1) |
由表8可知, 随着处理温度的下降, 3个狗牙根品种叶片的
| 表8 低温胁迫对狗牙根叶片 |
由表9可知, 3个狗牙根品种叶片的H2O2含量均随着温度的下降而显著升高, 但升高程度不同。在亚适温条件下, 运动百慕大、天堂419和保定狗牙根叶片的H2O2含量分别升高至适温对照的1.4, 1.6和1.6倍; 在冷害处理下, 3个品种叶片的H2O2含量分别升高至适温对照的2.1, 2.9和3.5倍; 当温度下降至冻害时, 3个品种叶片的H2O2含量分别升高至适温对照的3.4, 4.6和4.9倍。
| 表9 低温胁迫对狗牙根叶片H2O2含量的影响 Table 9 Effect of low temperature stress on leaf H2O2 content in bermudagrass (μ mol· mg-1 protein) |
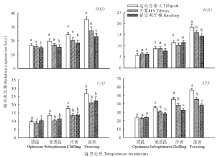
2.5.1 对SOD活性的影响 从表10可以看出, 随着处理温度的下降, 运动百慕大叶片SOD活性呈显著上升趋势, 在亚适温、冷害和冻害条件下均显著高于适温对照, 而天堂419和保定狗牙根叶片SOD活性在亚适温下与适温对照差异不显著, 在冷害和冻害条件下显著高于适温对照。在适温和亚适温处理条件下, 3个狗牙根品种间叶片SOD活性无显著差异, 在冷害和冻害条件下, 运动百慕大叶片SOD活性显著高于天堂419和保定狗牙根, 其中保定狗牙根的活性最低。
| 表10 低温对狗牙根叶片SOD活性的影响 Table 10 Effect of low temperature stress on leaf SOD activity in bermudagrass cultivars(U· min-1· mg-1 protein) |
2.5.2 对POD活性的影响 从表11可以看出, 3个狗牙根品种叶片的POD活性均随着处理温度的下降而呈上升趋势, 其中以运动百慕大上升幅度更大, 保定狗牙根上升幅度最小。在适温和亚适温处理条件下, 3个狗牙根品种间叶片POD活性无显著差异, 在冷害条件下, 运动百慕大叶片POD活性显著高于保定狗牙根, 但与天堂419无显著差异, 在冻害条件下, 运动百慕大叶片POD活性显著高于天堂419和保定狗牙根, 其中保定狗牙根的活性最低。
| 表11 低温对狗牙根叶片POD活性的影响 Table 11 Effect of low temperature stress on leaf POD activity in bermudagrass cultivars (U· min-1· mg-1 protein) |
2.5.3 对CAT活性的影响 从表12可以看出, 随着处理温度的下降, 3个狗牙根品种的CAT活性均呈显著升高趋势。在适温和亚适温处理条件下, 3个品种间叶片CAT活性无显著性差异, 但在冷害和冻害条件下, 运动百慕大的CAT活性最高, 保定狗牙根的CAT活性最低, 天堂419居中。在亚适温条件下, 运动百慕大、天堂419和保定狗牙根叶片的CAT活性分别升高至对适温对照的1.24, 1.21和1.22倍, 在冷害温度下, 3个品种的CAT活性分别升高至适温对照的1.74, 1.61和1.59倍, 当温度下降至冻害时, 3个品种的CAT活性分别升高至适温对照的2.19, 1.89和1.73倍。
2.5.4 对APX活性的影响 从表13可以看出, 随着处理温度的降低, 3个狗牙根品种叶片的APX活性均呈上升趋势, 其中运动百慕大上升幅度最大。在冷害处理下, 运动百慕大、天堂419和保定狗牙根叶片APX活性分别升高至适温对照的1.39, 1.31和1.48倍, 当温度下降至冻害时, 3个品种的APX活性分别升高至适温对照的1.62, 1.42和1.55倍。在适温和亚适温处理条件下, 3个狗牙根品种间叶片APX活性无显著差异, 但是在冷害和冻害处理下, 运动百慕大叶片APX活性显著高于天堂419和保定狗牙根。
2.6.1 对抗氧化酶基因表达的影响 由图1可以看出, 低温诱导了3个狗牙根品种叶片抗氧化酶基因的上调表达, 且随着处理温度的下降, 其表达水平呈上升趋势, 但不同品种上调表达的幅度不同, 其中在运动百慕大中上调表达幅度最大。在亚适温和冷害温度处理条件下, 除了POD酶基因外, 运动百慕大叶片SOD、CAT和APX酶基因的表达水平均显著高于天堂419和保定狗牙根; 在冻害温度处理下, 运动百慕大叶片SOD、POD、CAT和APX酶基因的表达水平均显著高于天堂419和保定狗牙根, 而保定狗牙根叶片SOD和APX酶基因表达量又显著低于天堂419。
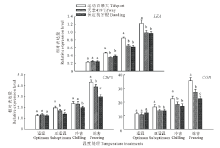
2.6.2 对耐寒相关基因表达的影响 由图2可知, 低温胁迫诱导了3个狗牙根品种叶片LEA, CBF1和COR基因的表达量显著上调, 且随着处理温度的下降, 其表达水平均呈显著上升趋势, 尤其是在耐寒性较强的运动百慕大中上调表达幅度更大。在亚适温、冷害和冻害处理下, 运动百慕大叶片LEA基因的表达量显著高于天堂419和保定狗牙根, 但天堂419和保定狗牙根间无显著差异; 在亚适温和冻害处理下, 运动百慕大叶片的CBF1基因表达水平显著高于另外2个品种, 并且天堂419的表达水平显著高于保定狗牙根, 但在冷害处理下, CBF1基因的表达水平在运动百慕大和天堂419间无显著差异, 但都显著高于保定狗牙根; 在亚适温、冷害和冻害处理下, 运动百慕大叶片COR基因的表达量显著高于天堂419和保定狗牙根, 但在亚适温和冷害条件下天堂419和保定狗牙根间无显著差异, 而在冻害条件下, 天堂419叶片COR基因的表达水平显著高于保定狗牙根。
光合作用既是植物生长发育的基础, 也是所有生物的能量来源。植物的光合作用是低温对植物影响的主要生理过程之一[16], 而光合作用的各个环节包括光能吸收、气体交换、碳同化过程等最易受低温胁迫的影响[17]。因此, 在一定程度上光合作用的高低反映了植株生长势的大小和抗逆性的强弱[18]。本研究结果表明, 随着处理温度的降低, 3个狗牙根品种的Pn、Ci、Gs和Tr均显著下降, 但是在运动百慕大中下降较为缓慢, 而在保定狗牙根中下降较快, 表明低温胁迫影响了狗牙根的光能吸收、气体交换、碳同化等光合作用过程, 造成光合作用原料(CO2)供给不足, 产物运输受阻, 净光合速率(Pn)降低, 植株生长势减弱, 而且耐寒性较强的品种在低温下能维持相对较高的光合作用, 这与在茄子(Solanum melongena)、番茄(Lycopersicon esculentum)、玉米(Zea mays)、西瓜(Citrullus lanatus)、黄瓜(Cucumis sativus)等作物中的研究结果一致[19, 20, 21, 22]。在亚适温和冷害处理下, 3个狗牙根品种的Pn皆随着Ci的下降而降低, 表明Pn的下降由气孔因素引起, 而在冻害处理下, Pn显著下降而Ci却显著升高, 表明Pn的下降不是由气孔因素造成, 而可能是由叶绿体结构破损、光合酶活性和CO2同化速率降低等非气孔因素导致, 以造成气孔关闭及胞间CO2的积累, 这与国内外有关研究结论类似[21, 22, 23, 24, 25]。该现象可能与低温胁迫程度有关, 轻度和中度低温胁迫导致光合速率降低的原因是气孔限制, 重度低温胁迫导致净光合速率降低的原因为非气孔因素限制。
光抑制是植物普遍存在的现象, 发生光抑制时过剩的光能会对叶片光合机构造成伤害, 致使Fv/Fm下降[26]。叶绿素荧光参数Fv/Fm常被用作研究逆境胁迫对植物造成伤害程度的重要指标[27]。Fv/Fm值的高低可反映PSⅡ 原初光能转换效率的快慢, 其值降低表明植物受到光抑制, 且低温处理下变化幅度越小说明植株耐低温能力越强[28]。何勇等[29]研究结果表明, 低温弱光下辣椒幼苗光合作用减弱, 最大光化学效率下降, 且随着胁迫时间的延长, 降幅逐渐增大。樊治成等[30]对西葫芦(Cucurbita pepo)进行低温处理, 结果表明, 不同品种西葫芦的Fv/Fm与温度呈极显著负相关, 并且温度越低恢复能力越差, Fv/Fm可作为西葫芦品种抗冷性筛选的鉴定指标。本试验结果表明, 随着温度的下降, 3个狗牙根品种叶片Fv/Fm呈下降趋势, 表明低温胁迫使狗牙根叶片光系统Ⅱ (PSⅡ )活性中心受损, 抑制了光合作用的原初反应, 这与Hu 等[15]、杨猛等[21]、侯伟等[22]、陈梅等[31]、Carrasco等[32]和莫亿伟等[33]所得的研究结果一致。Fv/Fm随着低温胁迫程度的增加而显著降低, 但在相同低温处理下运动百慕大> 天堂419> 保定狗牙根, 因此可判断保定狗牙根对低温相对较敏感, 叶片PSⅡ 受损较严重, 耐寒较弱, 而运动百慕大下降幅度相对较小, 耐寒性则较强, 天堂419居中, 这与在玉米[28]、甘蔗(Saccharum officinarum)[34]、南瓜(Cucurbita moschata)[35]、茶树(Camellia sinensis)[36]、烟草(Nicotiana tabacum)[37]等植物的研究结果一致。
在正常生长条件下, 植物体内的活性氧(reactive oxyen species, ROS)产生与清除处于动态平衡而不会导致植物细胞膜受到伤害。但是在逆境条件下这种平衡常被打破, 产生大量的活性氧而造成细胞膜脂过氧化反应, 导致膜系统损伤和细胞氧化[38]。植物为保护自身免受ROS的伤害, 体内存在着超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)等内源抗氧化防护系统, 使体内活性氧保持动态平衡, 从而减轻或缓解逆境伤害[39]。本研究显示, 在低温处理条件下, 3个狗牙根品种叶片中的H2O2含量以及
CBF(C-repeat binding factor)转录因子家族在植物低温信号通路中发挥重要作用[44]。在低温信号传递过程中, CBF是感受上游信号并将外界低温信号向下游传递的重要信号传递体。在低温驯化过程中, CBF1基因的表达受到低温条件的快速诱导, 超表达某些CBF1基因家族成员, 可使其调控的下游基因表达增强, 植株的抗低温能力得到改善[45]。低温下可溶性糖的积累, 提高了细胞的渗透势, 有利于细胞的渗透调节和保护膜结构的完整性与稳定性, 从而提高了抗寒性。本研究结果显示, 低温诱导了CBF1、COR和LEA基因在3个狗牙根品种叶片中的上调表达, 并且表达水平随温度的降低而显著增加, 表明CBF1、COR和LEA基因的表达水平与受胁迫程度密切相关, 并且在耐寒的运动百慕大中表达水平更高, 而在前期的研究中发现低温下果聚糖、果糖和蔗糖等可溶性糖含量显著升高且在耐寒性强的狗牙根中更明显[13], 表明低温诱导CBF1、COR和LEA基因的表达可直接或间接地激活下游多种编码糖合成基因的表达, 进而增加可溶性糖的含量, 从而增强了植株的抗冻性[46]。迄今, 对CBF1作用的下游基因研究以COR基因较多。同时, COR15a 调控编码亲水的LEA蛋白的表达, 以增强植株抵抗冰冻低温下叶绿体结构的伤害[47]。本研究结果显示, 低温胁迫下, 也诱导了COR和LEA基因在3个狗牙根品种叶片中的上调表达, 而且在运动百慕大中的表达水平显著高于另外两个品种, 同时运动百慕大在低温下具有较高的叶绿素含量、Fv/Fm和光合作用, 表明低温诱导COR和LEA基因的显著上调表达有助于减轻低温对植物叶绿体结构的破坏, 从而缓解因低温而造成的光抑制和光合作用的降低, 从而增强了植株的抗冻性[46]。
低温胁迫下狗牙根草坪质量、生长速率、Fv/Fm和光合作用显著下降, 叶片MDA和H2O2含量及
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|