作者简介:刘书(1993-),男,山西大同人,在读硕士。E-mail: liushu15@mails.ucas.ac.cn; 刘盼盼(1990-),女,河南周口人,硕士。E-mail: a947148754@163.com。**共同第一作者These authors contributed equally to this work.
前期实验表明,变温处理(28 ℃ 12 h/16 ℃ 12 h)可显著提高羊草种子的萌发率,且羊草种子萌发中的第1天是接受变温信号的关键时期。以此为研究基础,结合羊草种子变温萌发的转录组测序数据,针对羊草种子萌发初期对变温处理的响应筛选出与种子萌发、休眠及低温相关的基因24个,利用测序结果中这些基因的RPKM值制作基因表达热图并分析其表达差异。以萌发率高、低的两种羊草种质的种子为材料,对24个基因在恒温12 h(28 ℃)和变温1 d(28 ℃ 12 h/16 ℃ 12 h)萌发处理中的表达分别进行了定量分析。结果表明,与恒温对照相比,变温处理12 h后,表达明显上调的基因有 SAIN1, PP2 C62, EXPB3, EXPB4, GA3 ox, EXPA2和 EXPA7,而表达明显下调的基因有 bHLH49, GID1, ABI8, Chi1,11833, CBF3, NAC2, PP2 C72, SAIN2和5423。通过进一步分析相关基因在高、低萌发率两个种质中表达的差异,筛选出其中可能与羊草种子萌发相关的基因有几丁质酶基因 Chi1,转录因子基因 CBF3,羊草新基因5423,赤霉素合成基因 GA3 ox,细胞松弛素蛋白基因 EXPB4和羊草新基因 SAIN1,将为下一步阐明羊草种子萌发的分子作用机理奠定基础。
Previous studies have suggested that the variable temperature (28 ℃ 12 h/16 ℃ 12 h) can significantly increase the germination rate of Leymus chinensis seed, and that the first day of germination was key for responses to variable temperature. A transcriptome analysis of L. chinensis seed germination under variable temperature treatment was performed. Based on sequencing, 24 genes related to seed germination, low temperature and dormancy were selected for heat map analysis using the reads per kilo base per million mapped reads (RPKM) value. In addition, under the treatment of constant temperature (28 ℃) for 12 h and variable temperature (28 ℃ 12 h/16 ℃ 12 h) for 1 d, the relative expression of the selected genes in two L. chinensis genotypes (high and low germination rate) were quantified by qRT-PCR. Our results indicated that the expression of SAIN1, PP2 C62, EXPB3, EXPB4, GA3 ox, EXPA2 and EXPA7 were significantly up-regulated in the seeds treated at 16 ℃ for 12 h, while the expression of bHLH49, GID1, ABI8, Chi1, 11833, CBF3, NAC2, PP2 C72, SAIN2 and 5423 were significantly down-regulated, compared with the constant temperature (28 ℃) control. Further analysis of the gene expression in the two genotypes suggested that Chi1, CBF3, GA3 ox, EXPB4, 5423 and SAIN1 were the putative genes related to germination in L. chinensis.This research may lay the foundation for further studies on the molecular mechanisms in seed germination of L. chinensis.
种子的萌发需要适宜的温度条件, 有些植物种子的萌发需要变化的温度[1]。种子的活力和相关代谢对温度信号的响应是萌发的关键, 温度能够直接影响种子萌发或间接地通过调节种子休眠以影响种子萌发。种子在开始萌发的过程中, 低温信号可导致种子内部激素含量的变化, 调控种子萌发[2]; 温度的变化也能够影响种子休眠, 较高的环境温度中种子休眠度深, 而低温对于种子破除休眠有着非常关键的作用[3]。
种子萌发调控中, 激素之间的协同和拮抗有重要作用[4]。ABA与GA是关键的两种萌发调控激素, 其各自的合成与代谢形成的种子内激素含量的平衡决定种子的生理状态, 以温度为代表的环境信号通过一系列信号转导途径作用于激素的合成代谢途径, 导致激素含量的变化, 从而影响种子的萌发[5]。在植物体内, GA和ABA的合成代谢基因及信号转导相关基因已被大量鉴定。GA促进种子萌发的过程中, 调控GA合成的关键基因是GA3ox1和GA3ox2[6], 而GA2ox调控GA的降解, GID1是GA信号通路中的关键基因[7]。ABA抑制萌发, 拮抗GA的促进作用[8, 9], 玉米黄质环氧化酶(zeaxanthin epoxidase, ZEP)和9-顺式-环氧类胡萝卜素双加氧酶(9-cis-epoxy-carotenoid oxygenase, NCED)是ABA合成途径中的两个关键酶, 而CYP707A2是ABA降解的关键基因[10, 11], PP2Cs在ABA信号转导中有重要作用[12]。有研究表明, 低温能上调GA合成代谢基因(AtGA20ox1、AtGA20ox2和AtGA3ox1)和下调GA分解代谢基因(AtGA2ox2), 从而提高种子内活性GA的含量, 进而促进萌发[13]。高温使ABA合成相关基因NCED2, NCED5和NCED9的表达上调, 导致ABA水平上升, 并抑制GA合成途径基因的表达, 使种子萌发受到抑制[14, 15]。此外, 细胞壁松弛蛋白能够软化胚乳组织, 促进细胞壁解聚, 帮助胚根伸出[16]。已有研究表明细胞壁松弛蛋白编码基因EXPA1, EXPA2, EXPA3, EXPA8, EXPA9和EXPA20等在吸涨的种子中表达量显著提高, 因此细胞壁松弛蛋白在促进种子萌发中有着非常重要的作用[17, 18]。
羊草(Leymus chinensis)是我国重要的禾本科牧草[19], 应用价值高, 但种子萌发率偏低限制了羊草种子的生产应用[20]。已有研究表明变温能够促进羊草种子萌发, 而恒温不利于其萌发[21, 22, 23, 24, 25, 26, 27]; 并且本实验室已对羊草种子的萌发条件进行了大量实验, 发现相较恒温28 ℃条件, 变温(28 ℃ 12 h/16 ℃ 12 h)可显著提高羊草种子萌发率。本研究在确定羊草种子响应变温信号敏感期的基础上, 结合前期变温处理羊草种子萌发的转录组测序数据, 对初选的24个可能与种子萌发、休眠及低温响应与激素代谢等相关的基因进行定量分析, 筛选出与变温萌发有关的关键基因, 并对其在种子萌发初期的表达进行了初步分析, 旨在为羊草种子萌发早期的分子机理研究奠定基础。
本研究所用的羊草种质为SF2-1和XQ10-1, 本研究组前期研究已表明其萌发率存在显著差异。羊草材料均种植于中国科学院植物研究所(北京)羊草种质资源圃, 在自然条件下生长, 于2014年收获种子供试。
1.2.1 羊草种子萌发不同时段变温处理 取直径9 cm铺有浸湿滤纸的玻璃平皿, 将人工挑选的50粒饱满种子均匀地排列在滤纸上, 平皿中加入5 mL蒸馏水使滤纸充分吸水湿润, 4次重复。将皿盖倾斜45° 盖于平皿上, 平皿和皿盖一起放入托盘内, 托盘内倒入1 cm深的蒸馏水。将托盘放入人工气候箱(相对湿度65%)。对处于28 ℃恒温条件下进行萌发的SF2-1和XQ10-1种子, 在不同的时间段(第0~12 h、12~24 h、24~36 h、36~48 h、48~60 h、60~72 h)以16 ℃低温处理12 h后, 继续放入恒温培养箱中萌发12 d。以持续处于恒温28 ℃条件下萌发的种子作为对照, 测定各处理中最终的种子萌发率(变温处理后的第12天), 4次重复。发芽标准为胚根伸出1 mm。
1.2.2 羊草种子总RNA提取与cDNA合成 以1.2.1的羊草种子萌发的方法, 取恒温(28 ℃)1 d和变温(28 ℃ 12 h/16 ℃ 12 h)处理1 d后的羊草种子, 用滤纸吸干种子表面水分, 液氮处理后, 保存于-80 ℃超低温冰箱备用。
采用植物总RNA提取试剂盒(TIANGEN)分别提取各温度处理的羊草种子中的总RNA, 利用DNase I (TIANGEN)消化基因组DNA。用1%的琼脂糖凝胶电泳检测RNA完整性, 并使用Biodropsis BD-2000测定RNA浓度和纯度。使用TaKaRa公司PrimeScriptTM RT reagent Kit(Perfect Real Time 编号:RR037Q)进行cDNA合成, 反应体系为10 μ L:5× PrimeScript® Buffer(2 μ L), PrimeScript® RT Enzyme Mix I(0.5 μ L), OligodT Primer(50 μ mol· L-1)(0.5 μ L), Random 6 mers(100 μ mol· L-1)(0.5 μ L), Total RNA(500 ng), RNase-Free ddH2O(补足至10 μ L)。反转录反应条件为:37 ℃, 15 min; 85 ℃, 5 s。合成后的cDNA存贮于-20 ℃冰箱备用。
1.2.3 羊草种子萌发变温处理转录组测序 前期研究组选取萌发率较高的羊草种质SF2-1的种子, 以恒温(28 ℃)12 h萌发的种子作为对照组, 变温(28 ℃ 12 h/16 ℃ 12 h)1 d和恒温(28 ℃)24 h萌发种子作为实验组, 进行转录组测序, 并对转录组测序数据深度分析。
结合转录组数据的初步分析结果, 筛选与高等植物种子萌发过程中的生理变化和激素代谢, 以及与低温响应相关的24个候选基因(表1), 并以转录组测序数据中这24个基因在不同温度条件下的RPKM值利用R语言制作基因表达热图。
| 表1 候选基因及其定量引物序列 Table 1 Selected genes and the primers used in qRT-PCR |
1.2.4 基因表达定量分析 根据转录组测序数据初步筛选的24个候选相关基因的CDS序列设计荧光定量引物, 以羊草Actin基因序列设计内参引物(表1), 以恒温处理为对照, 通过定量PCR(qRT-PCR)分析相关基因在高、低萌发率羊草种质于变温处理下萌发中的表达变化。定量PCR体系和条件按照TaKaRa公司SYBR® Premix Ex TaqTM II (TliRNaseH Plus)试剂盒说明书进行操作。反应程序为:95 ℃, 30 s; 45个循环(95 ℃, 5 s; 68 ℃, 30 s)。技术重复3次。定量PCR反应完成后, 采用2-Δ Δ Ct方法对所得数据进行相对定量分析[28]。
采用SPSS 17.0和Microsoft Excel 2010软件完成统计分析, 图表制作使用Microsoft Excel 2010和Origin 8.0软件。采用单因素方差分析和LSD最小显著差异法检验不同变温时段羊草种子萌发率以及各基因相对表达量的差异性。使用R语言制作基因表达热图。
为了探究羊草种子萌发过程中对变温信号的响应, 以12 h为梯度的变温处理萌发实验结果表明:与对照相比, 不论是高萌发率种质SF2-1, 还是低萌发率种质XQ10-1, 在萌发的第12 h之后的任何时段进行低温处理, 其萌发率均极显著(P< 0.01)提高, 表明羊草种子在萌发的第12 h已经开始响应变温信号。在低萌发率种质XQ10-1中对各低温处理时段的LSD分析表明, 第12~24 h进行低温处理的萌发率与恒温对照以及第0~12 h低温处理相比, 均有极显著提高(P< 0.01), 而在第12~24 h之后的12 h时段低温处理后的萌发率与第12~24 h处理相比差异不显著; 在高萌发率种质SF2-1中进行LSD分析, 在第12~24 h低温处理极显著地提高了萌发率, 但相比于第12~24 h, 在第24~36 h低温处理仍表现出萌发率的显著提高(P< 0.01), 且在各时段处理中的调高幅度最大。通过两个种质中不同时段低温处理后的萌发率差异可以得出, 第12~24 h是羊草种子响应低温信号的关键时段, 详见图1。
依据羊草种子萌发不同时段变温处理实验结论“ 第12~24 h是羊草种子响应低温信号的关键时段” , 选取了高萌发率种质SF2-1的种子进行了变温处理转录组测序, 利用转录组数据分析得到的各基因的RPKM值, 对初步筛选的24个可能与羊草种子萌发、休眠及低温相关的基因进行热图分析, 得到不同温度条件下基因的差异表达情况(图2)。
结果表明:与恒温(28 ℃ 12 h)对照相比, 16 ℃低温处理12 h后, 表达明显上调的基因有SAIN1, PP2C62, EXPB3, EXPB4, GA3ox, EXPA2和EXPA7, 而表达明显下调的基因有bHLH49, GID1, ABI8, Chi1, 11833, CBF3, NAC2, PP2C72, SAIN2和5423。与恒温28 ℃ 12 h对照相比, 恒温28 ℃处理24 h后, 表达明显上调的基因有SAIN1, PP2C62, PYL8, GID8, ABI8, SPATULA和ROS1, 而表达明显下调的基因有GA2ox, ZEP, EXPA5, EXPB16, Chi1, 11833, CBF3, NAC2, PP2C72和5423。与对照相比, 两组不同的温度处理中, 表达均明显上调的基因有SAIN1, PP2C62和EXPB3, 而在两种温度处理中表达均明显下调的有Chi1, 11833, CBF3, NAC2, PP2C72和5423。
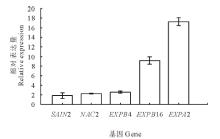
以恒温处理为对照, 对各基因在变温处理后的SF2-1和XQ10-1羊草种子中的表达进行PCR荧光定量分析。结果表明:变温处理1 d后, 在两种材料中表达量都上调的基因有SAIN1, NAC2, EXPB4, EXPB16和EXPA2等5个。在萌发率高的SF2-1的材料中, 还有11个基因分别有不同程度上调(图3), 其中, EXPA2和PP2C72这两个基因的上调明显, 分别较对照上调13.7和9.0倍。而在萌发率低的XQ10-1的材料中, 仅有上述5个基因的表达量上调(图4)。在两个种质中均上调表达的5个基因中, SAIN1基因在SF2-1中上调较XQ10-1明显, 而其他4个基因在XQ10-1中的上调更加明显。
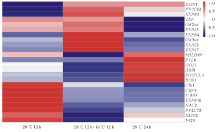 | 图2 羊草种子萌发相关基因表达热图Fig.2 The heat map of expression of the genes related to germination in L. chinensis |
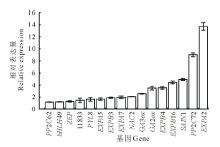 | 图3 SF2-1种子变温处理后上调基因Fig.3 The up-regulated genes in SF2-1 L. chinensis seeds after variable temperature treatment |
变温处理1 d后, 在SF2-1和XQ10-1中的表达量都下调的基因有Chi1, CBF3, 5423和SAIN2。在SF2-1中, 有8个基因的表达出现不同程度的下调(图5), SPATULA和Chi1基因下调均在5倍以上。在XQ10-1中, 有6个基因出现不同程度的下调(图6), 且与在SF2-1中的表达相比, Chi1、5423、CBF6、SAIN2在XQ10-1中的表达下调更加明显。
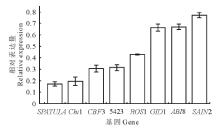 | 图5 SF2-1种子变温处理后下调基因Fig.5 The down-regulated genes in SF2-1 L. chinensis seeds after variable temperature treatment |
 | 图6 XQ10-1种子变温处理后下调基因Fig.6 The down-regulated genes in XQ10-1 L. chinensis seeds after variable temperature treatment |
通过基因表达的分析挑选高萌发率种质SF2-1中表达差异显著的11个基因, 与低萌发率种质XQ10-1中的表达量分别进行比较分析(如图7, 其中下调基因的表达量用负倒数表示)。结果表明, Chi1, CBF3, 5423在两个种质中的表达均下调; 而NAC2, EXPB4, EXPB16和EXPA2在两个种质中的表达均上调。
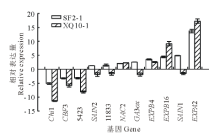 | 图7 在SF2-1和XQ10-1中均特异表达的基因Fig.7 Genes specifically expressed in both of the seed genotypes SF2-1 and XQ10-1 |
依据各基因在不同温度处理下萌发的种质中表达的情况, 以相对表达量上调或下调大于2倍为基准, 筛选出9个相关基因, 分别是Chi1、CBF3、5423、NAC2、GA3ox、EXPB4、EXPB16、SAIN1和EXPA2。对上述基因在高萌发率SF2-1种质和低萌发率种质XQ10-1中的表达量进行分析, 若基因在SF2-1中上调倍数大于XQ10-1或在SF2-1种质中下调倍数小于XQ10-1, 则表明该基因与种子萌发相关, 进而明确各基因与变温和萌发的相关程度(表2)。结果表明, 这9个基因在变温条件下均差异表达, 表明这些基因均与变温相关, 而其中6个基因与高萌发率与低萌发率的两个种质均有关。因此, 筛选得到变温影响羊草种子萌发的6个关键基因:Chi1, CBF3, 5423, GA3ox, EXPB4和SAIN1。
| 表2 与变温或萌发相关的基因 Table 2 The genes related to variable temperature treatment or germination |
种子萌发是一个复杂的生理生化过程, 其中相关酶的活性、膜的通透性、膜结合蛋白的活力以及种子内GA和ABA的合成代谢均受温度影响。种子的萌发需要适宜的温度。前人的研究表明, 恒温不利于羊草种子的萌发, 低温和变温都能显著提高种子萌发率。本课题组在对羊草种子萌发的前期研究表明, 恒温(16、20、22、28、37 ℃)处理下羊草中种子萌发率均较低(小于20%), 而在不同的变温(28 ℃ 12 h/16 ℃ 12 h)条件下, 羊草种子萌发率显著升高。 在此基础上, 系统地研究了变温对羊草种子萌发的效应, 通过不同时段的变温处理改变种子萌发的温度条件, 发现羊草种子萌发的第1天(第12~24 h)经低温处理可显著提高种子萌发率, 该时段(第12~24 h)可以说是羊草种子萌发中对响应低温信号的关键时段。
细胞壁松弛素家族基因在变温处理后的萌发期羊草种子中表达变化较普遍, 上调较明显。已有研究表明, 在萌发中的拟南芥(Arabidopsis thaliana)种子中, 相比于在拟南芥中编码细胞松弛蛋白的其他35个基因, EXPA2的表达量极高, 并已证实了EXPA2是种子萌发所必需的, 且EXPA2对萌发的作用受到GA的调控[29]。前人在番茄(Lycopersicon esculentum)的研究中发现, LeEXP4在胚乳的珠孔端特异表达, 种子萌发过程中mRNA累积水平与胚乳珠孔端的软化程度保持一致, 通过软化胚乳促进胚根的伸出, 进而参与调控种子萌发[30, 31]。本研究中的羊草种子变温处理1 d后, EXPA2表达量上调了13.7倍, EXPB4和EXPB16在变温处理后的表达也有明显的上调, 据此可以初步判断细胞壁松弛素家族基因在羊草种子萌发中有重要作用。
植物激素参与对种子萌发的调控, 其中, GA和ABA的作用较为关键。GA促进种子萌发。已有研究表明, 拟南芥种子经低温处理后, AtGA3ox1及AtGA3ox2的表达量提高, 参与GA的合成代谢[13]。羊草种子经变温处理后, GA3ox的表达量也明显上调, 可见羊草种子接受变温信号后增强GA的合成, 从而促进萌发。GA2氧化酶参与GA的分解代谢, 我们发现羊草种子在变温处理后其GA2ox的表达也表现为上调, 这可能是种子萌发初期活跃的激素合成与代谢平衡的表现。GA3ox1和GA3ox2的转录受SPATULA抑制, SPATULA通过影响GA代谢而调控萌发, 且受低温层积下调表达[32]; 发现羊草种子变温处理后, SPATULA的表达下调, 进而可能通过GA效应作用于萌发。ABA维持种子休眠, 抑制萌发。ABA在高等植物中的合成途径中, ZEP可能起关键性作用[33]; 本实验中经变温处理后的羊草种子, ZEP基因的表达量上调, 可能说明变温萌发中ABA的效应在一定程度上受到抑制。ABI8是ABA信号通路的一个重要调控因子, 在拟南芥中有通过调节细胞纤维素合成影响细胞壁合成的功能[34], 在本研究中发现, 羊草种子变温处理后, ABI8的表达量有小幅的下调, 可能表明在此过程中ABA含量降低或ABA效应受阻, 降低ABA对种子萌发的抑制效应。
植物中几丁质酶参与植物发育和环境胁迫响应, 目前关于植物几丁质酶基因的研究主要集中在植物的抗病性[35]。Chi1在羊草种子萌发过程中可能由响应低温信号而表达下调, 其在萌发中具体功能有待进一步研究。转录因子CBF基因包括CBF1、CBF2和CBF3, 在植物冷适应与植物抗冷抗冻性中有重要作用, 已有研究表明CBF突变体表现出对低温冷害的极度敏感[36]。在羊草种子接受低温信号后, CBF3的表达明显下调, 与植物冷适应过程相反, 在此过程中可能由于CBF3表达的下调提升种子内对低温信号的响应, 从而使低温进入种子萌发相关的信号通路, 促进种子萌发。在羊草种子中, NAC2的表达在低温诱导后的下调明显; 而NAC2在花生(Arachis hypogaea)中参与ABA信号途径, 而且在拟南芥中过量表达NAC2可导致根生长及种子萌发对ABA过度敏感[37]。SAIN1和5423是在本研究组已有研究中发现的羊草新基因[38], 在羊草种子变温萌发中的表达分析表明, SAIN1和5423可能与种子萌发有关, 且可能受低温诱导。
本研究在确定羊草种子响应变温的敏感期及关键时间点的基础上, 探究羊草种子萌发过程中变温响应关键时期的基因表达变化, 并初步筛选出可能与羊草种子萌发及变温相关的关键基因, 为深入研究种子萌发、变温响应相关基因的具体功能及种子萌发分子机理奠定了一定的基础。
羊草种子萌发中的第一天是接受变温信号的关键时期。本研究对前期羊草种子转录组测序数据深度分析, 筛选与羊草种子萌发、休眠、低温等相关基因24个, 并对这些基因在变温萌发过程中的表达进行分析, 筛选出一些可能与变温处理及种子萌发相关的关键基因。由分析结果得到与变温相关但与萌发无关的基因有转录因子基因NAC2和细胞松弛素编码基因EXPB16、EXPA2; 筛选得到6个与变温处理和萌发均相关的基因, 分别是几丁质酶基因Chi1、低温响应基因CBF3、赤霉素合成相关基因GA3ox、细胞松弛素编码基因EXPB4和羊草新基因SAIN1、5423。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|