作者简介:徐畅(1993-),男,安徽安庆人,在读硕士。E-mail:allenxu1993@126.com
根据NCBI中紫花苜蓿1型金属硫蛋白基因( MET1, 登录号:AF189766.1)cDNA序列设计一对特异性引物,以紫花苜蓿品种“农菁1号”的cDNA为模板,利用PCR技术克隆出的一个基因,命名为 MsMT1,测序发现该基因全长228 bp,编码75个氨基酸。通过碱基序列比对发现 MsMT1与 MET1的相似度为99%。通过氨基酸序列分析和进化树分析,发现与其他植物的1型金属硫蛋白基因具有较高的同源性。利用qRT-PCR对 MsMT1在苜蓿不同器官中的表达进行分析,发现该基因在根和子叶中表达量较高。将苜蓿幼苗进行不同浓度NaCl、Na2CO3、NaHCO3及不同pH值胁迫处理后, 观察 MsMT1基因的表达,发现 MsMT1的表达量随盐碱处理液浓度和pH值变化发生改变,说明 MsMT1与植物的抗逆性相关。采用农杆菌介导法将 MsMT1导入苜蓿植株体内,卡那抗性的筛选和Northern blot结果显示 MsMT1基因能够在转基因苜蓿中高效表达。用不同浓度NaCl、NaHCO3处理野生型和转化 MsMT1基因的苜蓿幼苗,观察幼苗受胁迫后的表型,发现转基因的苜蓿幼苗比未转基因的苜蓿幼苗抵抗力高。本研究表明 MsMT1基因能够增加苜蓿对胁迫的抗性。
A gene sequence was obtained from Medicago sativa “Nongjing No. 1” cDNA via PCR amplification using specific primers designed from the cDNA sequence of Type 1 Metallothionein gene ( MET1, GenBank accession number: AF189766.1) in M. sativa. This gene is assigned as MsMT1. The total length of this gene fragment is 228 bp and it encodes 75 amino acids. The nucleotide sequence of MsMT1 has 99% homology with MET1. Multiple sequence alignment and the phylogenetic tree showed a high similarity between the MsMT1 and the MT1 in other plants. MsMT1 gene expression was analyzed in different organs of M. sativa by qRT-PCR, with higher quantities found in roots and cotyledons. MsMT1 gene expression was examined in M. sativa seedlings under different concentrations of salt solution and pH values. The results revealed that the expression quantity of MsMT1 gene changed with the saline or alkaline solution concentration, indicating that MsMT1 is associated with stress tolerance. The MsMT1 gene was transformed into M. sativa plant through Agrobacterium tumefaciens-mediated method. The positive transformation was further confirmed by the kanamycin resistance test and the Northern blot test confirmed that MsMT1 was successfully expressed in the transgenic M. sativa. Wild type and transgenic M. sativa seedlings were treated with different concentrations of NaCl or NaHCO3 which revealed that the transgenic plants had higher stress tolerance than wild type plants. The results of this study highlight the MsMT1 gene can increase plants tolerance to stress.
金属硫蛋白(metallothionein, MT) 是一类普遍存在于生物体内的富含半胱氨酸, 具有结合金属能力和高诱导特性的低分子量蛋白质[1]。1957年, Margoshes等[2]在马的肾脏外皮细胞中首次发现了金属硫蛋白, 该蛋白可能与Cd的生物代谢过程有关。1977年, Casterline等[3]首先从大豆(Glycine max)根中发现植物MTs, 植物MT研究从此得到了快速的发展。
MTs根据半胱氨酸残基位置和排列顺序的不同可以分为3类(ClassⅠ , Ⅱ , Ⅲ ), 大部分植物MTs都属于II类MTs。进一步根据蛋白序列中半胱氨酸残基位置与排列顺序的不同分为4个亚型(type 1~4)[4], 典型的MT1在N-末端结构域中有6个Cys残基, MT2有8个, MT3含4个, C-末端具有高度保守的共有序列CXC, C为Cys 残基, X为任意氨基酸残基, 该序列在整个植物MTs中通用。
植物MT基因表达具有组织器官特异性和发育阶段特异性, 植物MT1主要在根和叶中表达[5], MT2主要在叶片中表达[6], MT3多在成熟组织表达[7], MT4主要在种子表达[8]。植物MT基因表达具有可诱导性, 研究最多的是金属离子对植物MT基因表达的影响, 大麦(Hordeum vulgare)MT受Fe离子诱导[9], 小麦(Triticum aestivum)MT受Al离子诱导[10], 白菜(Brassica pekinensis)MT受Al离子诱导[11], 盐碱也能诱导植物MT基因的表达, 枣(Ziziphus jujuba)1型金属硫蛋白基因ZjMT在NaCl处理后基因表达上调[12], 水稻(Oryza sativa)[13]和大麦[14]在盐和干旱条件下, 金属硫蛋白的转录水平显著上调, 说明该基因与盐有一定的应答关系。
紫花苜蓿(Medicago sativa)素有“ 牧草之王” 的美称, 是世界上利用最早、栽培最广的一种优良豆科牧草[15], 黑龙江省是畜牧业大省, 然而, 随着土地盐渍化, 紫花苜蓿的种植面积逐渐减少, 并对其产量构成了严重威胁。“ 农菁1号” 苜蓿是适合东北地区种植的优质、抗寒、抗病、生物产量高的紫花苜蓿新品种[16]。从“ 农菁1号” 紫花苜蓿中克隆出一个1型的金属硫蛋白基因, 通过研究发现该基因能提高植物的抗盐碱性, 对紫花苜蓿中耐盐碱基因的研究, 将为培育优良的耐盐碱品种, 增加盐碱地区紫花苜蓿的种植面积和提高产量具有重要意义。
本实验所用材料紫花苜蓿为黑龙江省农业科学院草业研究所培育的紫花苜蓿品种“ 农菁1号” 。
实验于2013年1月到2016年12月在东北林业大学盐碱地资源与环境中心进行, 采用Trizol法提取苜蓿总RNA, 使用RT-PCR试剂盒(Takara生物公司)进行反转录获得苜蓿cDNA, 以cDNA为模板, 根据NCBI中紫花苜蓿1型金属硫蛋白基因(AF189766.1)序列设计的一对特异性引物:MsMT1F和MsMT1R(表1)为引物, 进行PCR扩增, PCR反应条件为:94 ℃预变性3 min; 94 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸30 s, 30个循环; 72 ℃补充延伸10 min。扩增产物电泳检测后用胶回收试剂盒(康为世纪生物科技有限公司)进行胶回收, 将回收片段连接到PMD-18T载体(Takara公司)并转化大肠杆菌DH5α 感受态细胞, 涂布在含有氨苄青霉素的LB平板上, 37 ℃过夜培养, 挑取单克隆摇菌, PCR鉴定阳性单克隆的菌液送公司测序。
| 表1 实验中所用到的引物序列 Table 1 Sequence of primers used in the experiment |
将测序结果输入DNA Man软件查询该基因的ORF区, 然后将克隆基因的碱基序列输入NCBI中进行blast分析并寻找出相似度较高的其他物种金属硫蛋白的氨基酸序列, 利用DNA Man软件进行蛋白质同源氨基酸序列对比, 最后通过MEGA3.1构建进化树, 观察苜蓿金属硫蛋白基因与其他金属硫蛋白的亲缘关系的远近。
分别提取新鲜紫花苜蓿根、茎、叶、种子、子叶的RNA, 反转录成cDNA。根据MsMT1基因和18S rRNA序列(KJ507198)设计两对引物(表1)。利用UltraSYBR Mixture试剂(北京康为世纪生物科技有限公司)进行实时荧光定量qRT-PCR检测, 每个样品做3个平行实验。 PCR反应体系为20 μ L(2× SYBR Green mix 10 μ L; 10 μ mol· L-1上下游引物各0.5 μ L, cDNA模板1.0 μ L; ddH2O 8.0 μ L); 反应条件为:95 ℃预变性10 min, 95 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 1 min, 40个循环。得到苜蓿各器官中MsMT1基因的表达量, 利用SPSS软件进行方差分析。
将苜蓿种子消毒后置于含有MS培养基的平板中培养。一周后, 将长出子叶和根的苜蓿幼苗转移到未加入任何胁迫处理的MS培养基(CK)和含有NaCl(150、200、250 mmol· L-1)、Na2CO3(50、75、100 mmol· L-1)、NaHCO3(50、75、100 mmol· L-1)、酸碱度(pH值7、8、9、10)的MS培养基上培养24 h后, 分别提取根和子叶的RNA。将RNA反转录为cDNA, 利用qRT-PCR分析MsMT1基因在逆境处理后的苜蓿根和子叶中的表达情况, 最后利用SPSS进行方差分析。
苜蓿MsMT1基因构建到植物表达载体PBI121后, 转化到农杆菌菌株EH105中, 利用农杆菌介导法将苜蓿MsMT1基因转入紫花苜蓿本体中, 将过表达MsMT1的紫花苜蓿种子和野生型紫花苜蓿的种子播种在MS培养基上, 培养两周后提取植物总RNA, 以MsMT1基因全长做成杂交探针, 通过Northern杂交方法[17]进行MsMT1基因过表达紫花苜蓿植株的分子检测。将检测后的MsMT1过表达株系与种子野生型的紫花苜蓿种子分别放置滤纸上发芽, 一周后选取长势一致的MsMT1过表达株系与野生型的紫花苜蓿幼苗分别移栽到底部打孔的含有草炭土∶ 蛭石=3∶ 1的塑料营养钵中, 各分7组, 每钵种5株苗, 设3个重复。分别用水(CK)、NaCl(200、300、400 mmol· L-1)、NaHCO3(50、100、200 mmol· L-1)进行胁迫处理, 每盆苗浇40 mL处理液, 每2 d补加40 mL处理液, 15 d后观察表型, 每个处理重复3次。
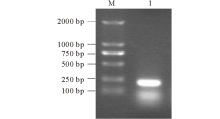
以紫花苜蓿cDNA为模板, 以MsMT1F, MsMT1R为引物, 进行PCR扩增, PCR产物经琼脂糖凝胶电泳显示成功获得一条约为200 bp大小的DNA条带(图1)。将条带回收纯化, 连接到PMD-18T载体(Takara公司), 转化到大肠杆菌DH5α 中, 挑取单克隆进行PCR检测, 将检测的阳性单克隆送公司测序。
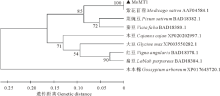
将基因的碱基序列输入NCBI中进行Blast分析, 发现该基因与紫花苜蓿1型金属硫蛋白基因(AF189766.1)相似度达到了99%。利用DNA Man软件翻译的氨基酸序列, 在NCBI中找到与克隆出的基因氨基酸序列相似度高的其他物种的1型金属硫蛋白, 利用DNA Man软件将从紫花苜蓿中克隆出的基因的氨基酸序列与其他物种的1型金属硫蛋白(MsMET1:紫花苜蓿 Medicago sativa MT1 AAF04584.1; CaMT1: 鹰嘴豆Cicer arietinum MT1 XP004506573.1; PsMT1:菜豌豆Pisum sativum MT1 BAD18382.1; VfMT1:蚕豆Vicia faba MT1 BAD18380.1; GmMT1:大豆Glycine max MT1 XP003550282.1; VrMT1:绿豆Vigna radiata MT1 BAD18374.1; VaMT1:红豆Vigna angularis MT1 BAD18378.1; LpMT1:扁豆Lablab purpureus MT1 BAD18384.1; CcMT1:木豆Cajanus cajan MT1 XP020202997.1; GaMT1:木本棉Gossypium arboreum XP017643720.1; MnMT1:川桑Morus notabilis MT1 XP010106473.1)的氨基酸序列进行比对, 发现该蛋白的氨基酸序列与其他植物的1型金属硫蛋白具有较高的同源性以及相似的保守区, 所以可以断定实验中克隆出的基因为苜蓿1型金属硫蛋白(图2), 将该基因命名为MsMT1。
利用MEGA3.1构建进化树, 根据进化关系发现MsMT1蛋白与紫花苜蓿、菜豌豆、蚕豆、大豆等豆科植物的MT1亲缘关系较近, 与木本棉的MT1亲缘关系较远(图3)。
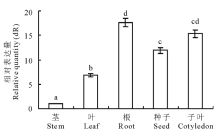
运用高灵敏度的qRT-PCR检测MsMT1基因在苜蓿不同器官的表达特异性, 发现3组重复的表达量差异不大, 说明数据具有可靠性。本研究中MsMT1基因在苜蓿的根和子叶中表达量较高, 其次是种子、叶, 在苜蓿茎中表达量较低(图4)。
不同浓度NaCl处理24 h下苜蓿根和子叶中MsMT1基因表达的定量比较, 苜蓿根中的MsMT1基因表达量随NaCl浓度增加而增加(图5)。苜蓿子叶中MsMT1基因表达量在0~150 mmol· L-1时随NaCl浓度增加而增加, NaCl浓度为200 mmol· L-1表达量降低(图5)。
 | 图5 在不同浓度NaCl处理的苜蓿根和子叶中MsMT1基因的相对表达量Fig.5 Quantitative comparison of MsMT1 gene expression in roots and cotyledons of M. sativa under NaCl stress |
不同浓度NaHCO3处理24 h下苜蓿根和子叶中MsMT1基因表达的定量比较, 苜蓿根中的MsMT1基因表达量随NaHCO3浓度增加而增加(图6)。苜蓿子叶中MsMT1基因表达量先降低后升高(图6)。
 | 图6 在不同浓度NaHCO3处理苜蓿根和子叶中MsMT1基因的相对表达量Fig.6 Quantitative comparison of MsMT1 gene expression in roots and cotyledons of M. sativa under NaHCO3 stress |
不同浓度Na2CO3处理24 h下苜蓿根和子叶中MsMT1基因表达的定量比较, 苜蓿根和子叶中的MsMT1基因表达量在50 mmol· L-1 Na2CO3处理时表达量提高, 之后逐渐下降(图7)。
 | 图7 不同浓度Na2CO3处理苜蓿根和子叶MsMT1基因的相对表达量Fig.7 Quantitative comparison of MsMT1 gene expression in roots and cotyledons of M. sativa under Na2CO3 stress |
不同pH值处理24 h下苜蓿根和子叶中MsMT1基因表达的定量比较, 苜蓿根中的MsMT1基因表达量在pH 7到pH 9时缓慢上升, 趋势不明显, 在pH 10时上升明显(图8)。苜蓿子叶中的MsMT1基因表达量先上升, 然后下降, 趋势不明显, pH 9和pH 10时表达量明显上升(图8)。
 | 图8 不同pH处理苜蓿根和子叶MsMT1基因的相对表达量Fig.8 Quantitative comparison of MsMT1 gene expression in roots and cotyledons of M. sativa under pH value stress |
通过以上研究发现, 不同浓度盐碱处理下, MsMT1基因的相对表达量发生变化, MsMT1基因不同程度上受盐碱胁迫的诱导, 推测MsMT1基因对盐碱胁迫能产生应激反应。
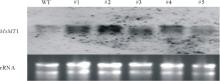
将过表达MsMT1的紫花苜蓿种子和野生型紫花苜蓿的种子播种在1/2MS培养基上, 培养两周后提取总RNA, 按照Northern杂交方法, 利用地高辛标记MsMT1基因的特异性探针进行Northern杂交(图9), 均检测到一条明显的杂交信号, 与野生型紫花苜蓿植株杂交信号相比, #1、#2、#3、#4的杂交信号比野生型强, 说明#1、#2、#3、#4为MsMT1基因过表达株系, 其中#2株系信号最强。
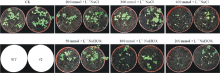
用#2转基因株系作为实验材料, 野生型为对照。分别用水(CK)、NaCl(200、300、400 mmol· L-1)、NaHCO3(50、100、200 mmol· L-1)进行胁迫处理。15 d后观察到CK组野生型与#2株系无明显差异(图10); 在200 mmol· L-1 NaCl处理下, 野生型与#2株系生长均受到抑制; 在300 mmol· L-1 NaCl处理下, 野生型与#2株系叶片均开始变黄, 野生型开始出现枯萎; 在400 mmol· L-1 NaCl处理下, 野生型全部枯萎死亡, #2株系有部分存活植株; 在50 mmol· L-1 NaHCO3处理下, 野生型叶片开始变黄, 部分枯萎, #2株系受胁迫不明显; 在100 mmol· L-1 NaHCO3处理下, 野生型受胁迫严重, 仅一株存活, #2株系生长也受到抑制; 在200 mmol· L-1 NaHCO3处理下, 野生型全部枯萎, #2株系部分存活。由胁迫后的表型可以看出过表达MsMT1基因能够提高紫花苜蓿对盐碱的抗性。
植物MT因不同植物物种、不同组织器官而表达特性各异[18], 拟南芥(Arabidopsis)衰老叶片中MT1a表达明显提高[19], 欧洲油菜(Brassica napus)MT1在绿叶中检测不到表达[20], 而MT1在幼苗中的表达量高[21, 22], 海州香薷(Elsholtzia haichowensis)1型EhMT1在根中的表达要明显高于叶片[23], 本研究中的紫花苜蓿MsMT1在根和子叶中表达量比较大, 这说明MT1 在不同植物器官的表达有一定的差别, 或许与MT1在不同植物器官中发挥不同的功能有关系, 这还需要进一步的实验加以证明。
虎尾草(Chloris virgata)[24]、碱茅(Pucclinellia distans)[25]和碱蓬(Suaeda glauca)[26]中克隆出的2型金属硫蛋白基因在酵母细胞中表达并且能提高转基因酵母的抗性。刚毛柽柳(Tamarix hispida)3型金属硫蛋白也在转基因酵母中提高了对NaCl的抗性[27]。盐角草(Salicornia europaea)2型金属硫蛋白在转基因烟草中提高了对逆境的抗性[28]。水稻2型金属硫蛋白基因[29]和中国枣1型金属硫蛋白ZjMT基因[12]能提高转基因拟南芥的抗盐碱性, 从以上的研究报道中已知金属硫蛋白能提高植物的抗盐碱性。本研究的苜蓿1型金属硫蛋白基因表达量在胁迫条件下发生明显的变化, 过表达该基因的苜蓿比未遗传转化的苜蓿明显提高了抗盐碱的能力, 说明苜蓿1型金属硫蛋白和其他的金属硫蛋白一样, 能够提高植物的抗性。曾经报道金属硫蛋白基因有清除活性氧的功能, 可以清除在胁迫条件下植物产生的多余活性氧保护植物不受伤害[30], 将MsMT1基因遗传转化到苜蓿体内, 可能由于该基因的过量表达, 使转基因苜蓿在胁迫条件下清除活性氧的能力比未遗传转化的苜蓿能力增强, 从而提高了苜蓿的抗盐碱能力。另外也可能是MsMT1基因的表达激活其他与逆境相关基因的转录和表达, 多个基因共同在逆境条件下发挥作用, 从而提高了转基因苜蓿的抗逆性。
本实验从紫花苜蓿品种“ 农菁1号” 中克隆出一个1型的金属硫蛋白基因, 命名为MsMT1。利用qRT-PCR技术分析出MsMT1基因在紫花苜蓿的根和子叶中表达量较高, 并且在胁迫处理条件下MsMT1的表达量发生了变化。卡那抗性的筛选和Northern blot结果显示MsMT1基因能够在转基因苜蓿中高效表达。NaCl和NaHCO3处理后的转基因苜蓿幼苗比野生型抗逆能力高, 说明MsMT1基因在苜蓿中的过表达能够增加苜蓿对胁迫的抗性。实验结果表明MsMT1基因是提高植物逆境抗性的一个重要功能基因。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|