作者简介:才华(1979-),女,黑龙江哈尔滨人,副教授,博士。E-mail: caihuaneau@gmail.com
DREB (dehydration responsive element binding protein)转录因子是一个干旱应答元件的结合蛋白,它能特异结合启动子中含有DRE/CRT顺式元件,激活逆境诱导基因的表达,调控植物对干旱、低温、高盐、高温等胁迫的耐逆性。大量研究表明DREB转录因子在信号传导、作用机理及基因表达方面存在复杂性。为了野生大豆来源 GsDREB2基因能更有效地发挥功能,人工突变该基因的负向调节结构域(negative regulatory domain, NRD,140~204),经改造命名为 GsDREB2- mNRD。在酵母中比较全长基因( FLDREB2)和 GsDREB2- mNRD转录激活和与DRE元件结合的能力,并验证GsDREB2-mNRD核定位情况。分别将FLDREB2和GsDREB2-mNRD转化拟南芥,通过拟南芥幼苗期盐胁迫和渗透胁迫试验,比较 GsDREB2- mNRD和 FLDREB2在提高植物耐盐和渗透胁迫方面的差异。结果表明, GsDREB2基因内部存在着负向调节结构域(NRD),抑制了 GsDREB2转录激活功能和DRE元件结合的特性;经改造的 GsDREB2基因依然能定位在细胞核;超量表达 GsDREB2- mNRD基因的拟南芥耐盐和渗透胁迫能力明显强于非转基因对照,也高于 FLDREB2基因超表达的拟南芥;野生大豆来源的 GsDREB2基因NRD结构域的缺失可增强该基因在植物耐盐、渗透胁迫等逆境胁迫下的功能。
The DREB transcription factor is a dehydration responsive element (DRE)-binding protein that specifically interacts with the DRE/CRT (C-repeat) cis-acting element in the promoter region of stress-inducible genes. This interaction controls the expression of many stress-inducible genes in plants and can increase plants’ tolerance to drought, low temperature, high salt, and heat. Many studies have reported on the complexity of DREB signal transduction, action, and expression. To explore the role of the DREB2 gene in Glycine soja ( GsDREB2), the nucleotides encoding the negative regulatory domain (NRD, amino acid residues 140-204) were deleted from GsDREB2. The transcriptional activation and DRE element-binding capacity were compared between proteins encoded by the full-length gene ( FLDREB2) and the truncated gene GsDREB2 -mNRD in yeast. The nuclear localization capacity of GsDREB2-mNRD was also evaluated. FLDREB2 and GsDREB2 -mNRD were each transferred into Arabidopsis. After screening and testing, the phenotype of the transgenic Arabidopsis lines was evaluated, and their stress tolerance level was determined by measuring their germination rate and fresh weight under salt and osmotic treatments. The results indicated that the amino acid region 140-204 negatively controls the transcriptional activation ability and DNA-binding capacity of DREB2. Both GsDREB2-mNRD and FLDREB2 were located in the nucleus. Transgenic Arabidopsis overexpressing GsDREB2 -mNRD showed increased tolerance to salt and osmotic stress. The transgenic plants overexpressing GsDREB2 -mNRD showed a higher germination rate and fresh weight than those of plants expressing FLGsDREB. These results demonstrate that GsDREB2 -mNRD, which encodes a mutated DREB2, can enhance plant tolerance to salt and osmotic stress.
转录因子DREB1A/CBF3 DREB(dehydration responsive element binding protein)和DREB2A可以与DRE顺式作用元件结合[1], 调控植物低温和干旱相关基因的表达, 在非生物胁迫信号传导中起到重要的调控作用[2, 3, 4]。有研究表明, 该基因的超量表达可以提高植物的耐盐性, 但会影响植株的正常生长[5, 6, 7, 8], 而且持续盐胁迫, 转基因植株的耐逆性并不十分理想[1, 9]。如何能最大限度地发挥DREB基因的功能, 为植物耐逆基因工程提供基因资源, 是科学研究的目标。
Liu等[1]在1998年首次通过酵母单杂交的方法分离拟南芥(Arabidopsis thaliana)CBF1、DREB1A和DREB2A基因。近十几年来, DREB转录因子一直是非生物胁迫分子生物学研究的热点。已经在多种植物中分离得到, 并在该基因的结构[10, 11]、功能[12, 13, 14, 15]、调控及相互作用网络等方面都做了大量研究, 结果表明DREB转录因子在植物对非生物胁迫反应中起到非常重要的调控作用。虽然DREB类的很多基因都能与DRE/CRT元件结合, 但其表达方式及调控基因并不相同。如AtDREB1是冷诱导表达, 调控冷胁迫响应的基因[1], 而AtDREB2是在干旱和高盐胁迫下诱导表达, 涉及干旱胁迫响应基因的转录调节[2]。且AtDREB1亚家族6个基因功能也各不相同[16], 之间还存在着反馈调节和转录后修饰。同样AtDREB2亚家族中8个基因的表达也存在差异, 仅DREB2A 和DREB2B在高盐和干旱下诱导表达, 而其他6个基因在胁迫下的表达量极低。并且发现, 在转基因植株中过量表达AtDREB2A基因会导致植株生长受限, 其耐逆性程度也是有限的[8]。以上研究表明, DREB转录因子家族基因的功能是极为复杂的, 其功能具有专一性, 并且家族基因内部还存在着自我调节, 甚至于转录后调控和激活, 例如泛素化[14]等。但其激活的机制尚不明确, 也限制了该类基因在耐逆基因工程中的应用。
Sakuma 等[8]发现, 拟南芥DREB2A转录因子的内部存在一个负向调节结构域(negative regulatory domain, NRD), 该结构域的存在影响DREB2A转录因子的结合和激活功能, 并且发现该结构域的缺失可以提高诱导型启动子调控的转基因植物对干旱的耐受性。本研究在2009年克隆了野生大豆(Glycine soja)的GsDREB2基因, 并深入研究了该基因的功能[17, 18]。但是在进行超量表达GsDREB2基因拟南芥和烟草(Nicotiana tabacum)的耐盐和干旱胁迫试验时发现, 该基因并没有显著提高转基因拟南芥或烟草的耐逆性。鉴于以上研究, 提出这样的疑问, GsDREB2基因内部是否也存在负向调节结构域, 该结构域的存在是否也影响GsDREB2基因的调节功能?本研究对GsDREB2基因的氨基酸序列进行分析, 推测NRD结构域, 并利用酵母试验验证NRD的抑制功能, 通过转化拟南芥, 比较全长基因FLDREB和缺失NRD的人工改造基因GsDREB-mNRD在转基因拟南芥中作用效果。
pGBKT7、pGADT7-Rec2、pHIS2酵母双杂交用载体, 酵母菌Y187购自clontech Takara Bio Company。诱饵载体pDRE-HIS2及含有该重组质粒的酵母菌株Y187/pDRE-HIS2由实验室前期构建并保存[17]。大肠杆菌DH5a 感受态细胞, 植物表达载体pBI121, 根癌农杆菌 LBA4404, EH105A感受态细胞, 用于核定位分析的本氏烟草, 用于转化的拟南芥哥伦比亚生态型均由本实验室保存。该研究于2013年实施, 2014年完成。
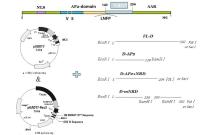
根据Sakuma等[8]所述, 用拟南芥AtDREB2A基因(At5g05410)与GsDREB2基因的氨基酸序列进行序列比对, 预测GsDREB2基因的结构域区域, 选择AP2结构域和转录激活区域之间的Ser 和Try氨基酸富集区域(140~204)为假设的NRD结构域。
根据预测的NRD位点, 设计不同缺失片段扩增的引物序列, 并添加相应的酶切位点, 以便于构建转录激活和转录结合的载体 pGBKT7与pGADT7-Rec2。按照图1中所述进行构建。
分别将图1所示4组片段连接pGADT7载体, 转化重组酵母菌Y187/pDRE-HIS2中, 涂布-/Leu-/Trp-平板, 在28 ℃下培养3~5 d。通过PCR检测的方法筛选同时含有2个质粒的阳性克隆。具体方法参照Yeast Protocol (clontech Takara Bio Company)并加以改进[17]。为了定量测算结合能力的大小, 借助Image J软件, 通过菌的浓度间接衡量结合能力的差异。
具体方法如下:将在为-/Leu-/Trp-平板上生长并鉴定阳性克隆的酵母菌, 在液体-/Leu-/Trp-培养基振荡培养, 并通过测定菌的OD600值, 调平菌液的浓度为0.6 mmol· L-1。菌液分别进行10, 100, 1000倍稀释, 如图2排列, 将稀释的菌液1 μ L 滴在含有60、80 mmol· L-1 3-AT 和HIS-/Leu-/Trp-缺陷培养基上, 28 ℃培养2~3 d。重复3次, 分别在3个相同的平板上, 按照相同的顺序点样。待菌落出现后, 在同一照相模式和光线情况下照相, 尽量保证图片的明暗度基本一致。使用IMAGE J软件, 调整一致的对比度, 选择一样的菌落大小面积, 对菌液的浓度进行分析。
将图1所示4组片段连接pGBKT7载体, 将不同片段连接的pGBKT7, 分别转化酵母菌株Y189, 涂布于SD/-Trp培养基上, 28 ℃培养3~5 d。利用PCR鉴定, 得到阳性转化子。将各阳性转化子在SD/Trp-培养基上划线。培养出菌落后, 参照Yeast Protocol (clontech takara bio company)[17]进行转录激活活性的定性和定量分析。
分别将GsDREB2-mNRD、FLDREB2与 pCAMBIA-1302 (GenBank 登录号为AF234298)连接, 构建融合GFP蛋白的瞬时表达载体pGDREBFL/pGDREBmNRD。将pGDREBFL/pGDREBmNRD转化根癌农杆菌 EH105ɑ , 利用农杆菌浸润法转化本氏烟草表皮细胞, 用激光共聚焦显微镜观察绿色荧光信号, 以空载体pCAMBIA-1302作为阴性对照[18]。
以pBI121为载体基本骨架, 利用原始载体上EcoRⅠ 和PstⅠ 酶切位点, 将Gus基因切除, 替换为GsDREB2-mNRD或FLDREB2, 分别构建植物表达载体。根据《植物生物技术实验指导》所述方法[19], 采用浸花法进行拟南芥的遗传转化, 用100 mg· L-1 卡那霉素筛选转化种子, 用T1代阳性拟南芥种子进行后续耐逆性实验。
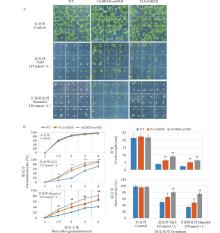
选取饱满的野生型拟南芥(哥伦比亚生态型)和转基因拟南芥种子, 用5%次氯酸钠消毒液消毒10 min后, 于4 ℃春化3~7 d, 播种于含有125 mmol· L-1 NaCl 或250 mmol· L-1 甘露醇的1/2 MS固体培养基上, 两周后观察表型, 计算萌发率(萌发率=萌发种子数/播种种子总数× 100%)和测量鲜重, 试验包括3次独立的生物学重复和3次技术重复, 萌发率和鲜重数值是3次生物学重复结果的平均值。
将pGADT7-Rec2空载体(简化为AD)与3个突变片段(命名为D-AP2, D-AP2+NRD, D-mNRD)和1个GsDREB2全长基因(简化为FL-D)与pHIS2-DRE共转化酵母菌, 并在含有60和80 mmol· L-1 3-AT的培养基上培养(图2A), 利用Image J软件, 对酵母菌斑点进行半定量分析, 以菌斑的明暗度评价菌的浓度(图2B)。当菌液浓度稀释1000倍以后, 仅含有AP2结构域和不含有NRD区的GsDREB2基因依然能够在含有80 mmol· L-1 3-AT浓度培养基上生长, 说明NRD的缺失大大增强了GsDREB2蛋白与DRE元件结合的能力, NRD的存在抑制了转录因子与元件的结合。由此可以判定, 与DRE元件结合起到决定作用的为AP2结构域, 只要有此结构域存在, GsDREB2转录因子便能够与DRE元件结合, 全长基因结合能力下降, 降低的原因仅是由于NRD的存在, 而GsDREB2转录因子的C-末端酸性活性区(AAR)存在与否对其结合能力并无影响。
将pGDKT7空载体(BD)与3个突变片段和1个GsDREB2全长基因转化酵母菌, 在同一个平板上进行培养, 观察菌的生长情况, 并测定β -半乳糖苷酶活性, 以此评价NRD对转录激活活性的影响。如图3所示, GsDREB2全长基因与NRD缺失的GsDREB2酵母菌组可显蓝色, β -半乳糖苷酶活性较高。而且NRD缺失的β -半乳糖苷酶活性更高。由此表明, NRD结构域负向调控GsDREB2转录激活活性。另外, D-AP2、D-AP2+NRD酵母菌组与对照BD一样, 只有本底的β -半乳糖苷酶活性, 并不具备转录激活活性。由此说明, GsDREB2转录因子转录激活结构域位于C端, 是转录激活所必需的。
NRD结构域的缺失增强了GsDREB2转录因子的结合能力和转录激活能力, 作为转录因子准确地定位细胞核是行使其功能的基本。因此, 对GsDREB2-mNRD的核定位情况进行了验证。如图4所示, NRD结构域缺失的融合蛋白(D-mNRD-GFP)与全长基因的融合蛋白一样, 在转基因烟草细胞核中均显现出绿色荧光, 说明NRD结构域的缺失并没有影响DREB2转录因子的定位情况, 与全长的GsDREB2基因一样, GsDREB2-mNRD仍可定位于细胞核。
将全长基因和NRD缺失的GsDREB2基因转化拟南芥。对转基因拟南芥进行高盐(125 mmol· L-1 NaCl)和高渗(250 mmol· L-1 甘露醇)胁迫处理, 以比较分析不同转基因型耐逆性的差别(图5)。 GsDREB2-mNRD超量表达拟南芥幼苗在盐和渗透胁迫条件下萌发率、鲜重及成活率均显著高于未转基因对照, 并都表现出极显著差异(P< 0.01), 而GsDREB2基因超表达植株虽然也有一定的耐盐和渗透胁迫的能力, 但幼苗萌发畸形比较严重, 后期成活率比较低。由此表明, NRD区域的缺失, 增强了转录因子与DRE结合的强度, 提高了转录因子的激活活性, 使转基因植株的耐盐和渗透胁迫能力增强。
很多研究均已证明DREB转录因子在提高植物抗逆性方面起到重要的作用[20, 21], 在多种植物中也已克隆出多个DREB基因[22, 23]。但是至今, 很少有利用该基因改善农作物抗逆性的理想的报道, DREB转录因子基因功能的复杂性是限制其应用的主要原因。Junya等[23]在大豆中分离到了1个DREB2A基因, 并对已克隆获得的多个大豆GmDREB2类的基因进行了聚类, 发现总共有3个亚型(subtype)。另外, 发现GmDREB2A基因与GmDREBa和 GmDREBc[23]相似性最高, 都属于同一亚型subtype1, 但是GmDREBa和 GmDREBc激活结构域很短, 功能上也存在不同, 除具有耐旱性外, 还具有耐高温的功能[21]。与之相似, 本研究克隆了来源于野生大豆的GsDREB2基因, 同样来源于大豆属的基因, 在基因序列、基因表达及生物学功能上却与GmDREB2A存在较大差异。在前期的研究中, 超量表达GsDREB2基因的烟草, 均未发现较为明显的抗旱性和耐盐性, 与GmDREB2A基因存在差异。
GsDREB2转录因子具有NLS 核定位信号、AP2-DNA 结合结构域和C末端酸性活性区等3部分基本结构, 用以在核中与DRE/CRT顺式作用元件结合激活下游基因表达, 行使其转录因子的转录调控功能。Sakuma等[2, 8]在拟南芥中发现C末端酸性活性区前面含有30个氨基酸(136~165)组成的负向调控区(NRD), 该区域的缺失, 解除了转录激活的抑制作用, 有效地提高了DREB2A基因在胁迫条件下和非胁迫条件下的调控作用。本研究基于此结果, 也获得了AP2-DNA结合结构域和C末端酸性活性区中间的65个富含Ser、Try 氨基酸的负向调控区(140~204), 经过酵母实验, 确定该区域的存在抑制了DNA结合功能和转录激活功能, 间接抑制了DREB基因的调控作用。经验证确定, 缺失NRD结构域的GsDREB2基因在转基因拟南芥耐盐和抗渗透胁迫反应中起到正调控作用。
然而, 天然的GsDREB2基因存在的生物学意义是什么?如果在正常的情况下, 由于NRD的存在抑制了该基因转录调控激活下游与干旱和盐相关的基因表达, 那么在胁迫条件下, 其又是如何行使功能的呢?这个问题还有待进一步深入研究。Qin等[14]发现, AtDREB2A转录因子在正常环境下, 参与泛素化降解的过程, 负向调节干旱响应蛋白的基因表达, 并且这种调控是比较严谨的, 与多种代谢途径是相关联的。或许NRD结构域的存在与基因转录后调控、蛋白修饰存在关系, 这还只是假设。但不可否认, DREB转录因子的调控是比较复杂的。
即便人工改造了该基因, 并且发现转基因植株的耐盐性和抗渗透胁迫的能力有所提高, 但尚不能直接应用。Sakuma[2, 8]的研究发现, 缺失NRD的AtDREB2A基因在诱导型rd29A启动子调控下, 才能发挥最好的提高转基因拟南芥耐盐的效果。因此, 后续野生大豆来源的GsDREB2基因的应用还要在启动子选用上加以考虑, 可以优先考虑rd29A诱导型启动子。
GsDREB2转录因子基因AP2结构域和转录激活区域之间存在65个氨基酸组成的Ser 和Try氨基酸富集区域, 该区域的存在抑制转录因子的结合特性和激活活性, 将该区域命名为负向调节结构域。突变缺失NRD结构域的GsDREB2基因依然可定位在细胞核, 并且可提高转基因拟南芥耐盐性和耐渗透胁迫的能力。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|