作者简介:姜寒玉(1980-),女,甘肃定西人,副教授。E-mail: 516147650@qq.com
以匍匐翦股颖品种“Penn-A4”为试验材料,侵染立枯丝核菌后,经丁二醇(BDO)诱导产生系统抗性(ISR),喷施不同浓度的乙烯合成抑制剂氯化钴(CoCl2)和促进剂1-氨基环丙烷羧酸(ACC)后,检测抗坏血酸-谷胱甘肽(AsA-GSH)循环中抗坏血酸(AsA)和还原型谷胱甘肽(GSH)含量及相关酶活性的变化,并观察匍匐翦股颖ISR反应中胼胝质沉积的变化。结果表明,乙烯抑制剂处理下,匍匐翦股颖幼苗中AsA含量较低,抗坏血酸过氧化物酶(APX)活性下降,大量GSH被催化还原为氧化型谷胱甘肽(GSSG),GSSG大量积累,同时谷胱甘肽还原酶(GR)活性较低,GSSG经GR少量还原为GSH。乙烯促进剂处理下,AsA含量较高,APX活性升高,GSSG在高活性GR作用下催化还原为GSH,使得GSH大量积累。因此在匍匐翦股颖ISR抗病反应中,高浓度乙烯促进AsA和GSH的大量积累,它们不仅参与了活性氧的代谢平衡,同时也作为信号分子在ISR抗病反应中起着重要作用。匍匐翦股颖感染褐斑病后,胼胝质主要沉积在厚壁细胞、韧皮部、木质部和表皮组织,其中厚壁细胞胼胝质沉积最多,表皮组织沉积最少。此外,胼胝质沉积面积在不同乙烯信号分子处理间存在差异,但随着处理时间的延长差异不显著。一定浓度的乙烯对ISR反应中胼胝质的沉积具有一定的影响,随着处理时间的延长显著增加,在100 μmol·L-1ACC处理5 d后,胼胝质沉积总面积仅为9.916 mm2,处理10 d后升至最高,为38.396 mm2,但在病害侵染后期,胼胝质数量减少,在100 μmol·L-1ACC处理15 d后,胼胝质沉积总面积降至20.052 mm2,反映了乙烯信号分子对胼胝质沉积的影响是一种短期效应,短期内可提高匍匐翦股颖植株抗病性,具有信号分子的短时效特点。研究结果为探清匍匐翦股颖ISR抗病响应中ET信号分子如何调控抗病生理特性提供了理论基础。
Creeping bentgrass seedlings cv. ‘Penn-A4’ infected with Rhizoctonia solani, which was produced by the induced-systemic-resistance (ISR) disease-resistance action induced by butanediol (BDO), was sprayed with different concentrations of the ethylene synthesis inhibitor, CoCl2 and ethylene synthesis promoter, 1-amino cyclopropane carboxylic acid (ACC). Subsequently, changes inascorbic acid (AsA) and glutathione (GSH) contents and related enzyme activity in theascorbate-glutathione (AsA-GSH) cycle in seedlings were measured. Paraffin sectioning and fluorescence microscopy techniques were used to assess the effects of ethylene on callose deposition during ISR disease-resistance reactions. Under low ethylene concentrations AsA content was low and ascorbate peroxidase (APX) activity was reduced. A large amount of GSH was catalytically reduced to oxidize glutathione (GSSG) which accumulated. Glutathione reductase (GR) activity was low; GSSG is reduced to GSH by GR, consequently GSH remained at low levels. However, under high ethylene concentrations, AsA content was high and APX activity was higher. GSSG was catalytically reduced to GSH which accumulated. Therefore, in ISR disease-resistance reaction, high concentrations of ethylene induced the accumulation of AsA and GSH, which involved not only in the metabolic balance of reactive oxygen species, but also acted as signaling molecules playing an important role in the disease resistance of ISR. Callose was mainly deposited in sclerenchyma cells, phloem, xylem tissues and epidermis seedling leaves in ISR reaction induced by BDO. Callose deposition was highest in sclerenchyma cell and least in the epidermis. Callose deposition areas had differences in ethylene signal compounds but became less significant with reduced treatment time. Ethylene concentration affected callose deposition in ISR reaction induced by BDO; callose deposition increased significantly with reduced treatment time. Areas of callose deposition occupied 9.916 mm2 under 100 μmol·L-1 ACC treatment after 5 d, and increased to 38.396 mm2 after 10 d. However, in the later stages of disease invasioncallose deposition area decreased to 20.052 mm2 under 100 μmol·L-1 ACC after 15 d. These results suggest that the ethylene molecular signalhas a short-term effect on callose deposition and increased the disease-resistance of creeping bentgrass. This research provides a theoretical basis for the exploration of ET signal molecules to control the physiological characteristics of resistance in ISR resistance response in creeping bentgrass.
匍匐翦股颖(Agrostis stolonifera)为禾本科翦股颖属(Agrostis)多年生草本植物, 属冷季型草坪草, 因其具有适应性强, 抗寒耐旱, 草质柔软细嫩, 生长迅速, 观赏性强等优良特性, 是高尔夫球场球道, 草地网球场等理想的高品质草坪草, 也是庭院、公园等养护水平较高的绿地首选草种。匍匐翦股颖不定根入土浅, 喜水, 抗病害能力差, 易感染币斑病、褐斑病、霜霉病和黑粉病等, 从而引起草坪品质、功能等方面的严重退化, 给草坪生产管理和经营带来巨大损失[1]。
在病原物的作用下, 植物产生的自我免疫基于一套高度灵活且复杂的响应机制, 植物首先利用最初产生的生理生化屏障, 其次激活某些可诱导的防御机制, 最终提高系统性响应免于病原物的进一步侵染。目前, 人们已了解几种生物诱导的系统性防御响应机制, 其一为系统获得性抗性(systemic acquired resistance, SAR), 它通常由病原物侵染诱导产生, 防止进一步感染[2], 另一种为诱导系统抗性(induced systemic resistance, ISR), 它往往由土壤根际的植物促生菌(PGPR)激活[3, 4]。现已在豆类、马铃薯(Solanum tuberosum)和拟南芥(Arabidopsis thaliana)等植物中都发现ISR反应, 其对细菌、真菌和病毒具有广谱抗性[5]。丁二醇(butanediol, BDO)是一种新型的抗病性诱导因子, 具有无毒、无污染和抗病性持久的优点。2010年加拿大学者Cortes-Barco等[6]对匍匐翦股颖的抗病性诱导作用进行了首次报道, 其能够诱导ISR抗病方式并有效抑制草坪叶病。随后, 研究发现BDO可诱导匍匐翦股颖产生抗病性, 其抗病效果优于通过SAR途径由苯并噻二唑(BTH)引致的抗病性[7]。
乙烯是ISR诱导系统中重要的信号分子, 为了进一步探清其在ISR信号途径中的作用, 有研究以乙烯信号突变型植株为试验对象, 发现通过根部施入荧光假单胞杆菌(Pseudcmonas fluoroscercs)WCS417r不能诱导植株对丁香假单胞菌番茄(Solanum lycopersicum)致病变种(Pst DC3000)的抗病性, 无ISR系统响应机制[8], 从而证实了乙烯信号通路与ISR机制的建立密切关联。在对拟南芥植株ISR系统的研究中发现, 茉莉酸-乙烯(JA/ET)响应型基因包括Lox1、Lox2、VSP2、PDF1.2、HEL、CHI-B和PAL1等, 这些基因均可被JA/ET信号激活得以表达, 表达产物能够对多种病原物产生抗性[9]。通过研究与乙烯抗病信号转导途径有关的ETR1、EIN2基因对植物防御素PDF1.2基因表达的影响发现, 乙烯与PDF1.2的合成有关, 外施乙烯能够提高PDF1.2基因的转录和翻译水平, 而SA不能诱导PDF1.2基因的表达[10, 11]。
当病原物侵染植物时, 细胞内开始积累大量的活性氧(reactive oxy gen species, ROS), 而ROS清除系统通过具有氧化还原性的酶和抗氧化物质协同作用。抗坏血酸-谷胱甘肽(ascorbate-glutathione, AsA-GSH)循环在该系统中发挥关键作用, 清除过程中引起了AsA、GSH及相关酶活性的变化, 诱导了植物的抗病性防御反应[12]。因此抗坏血酸过氧化物酶(peroxidase, APX)、AsA和GSH是AsA-GSH循环的重要组分。如真菌灰葡萄菌侵染番茄叶片后, 改变了植株AsA-GSH循环, APX、脱氢抗坏血酸还原酶(DHAR)和谷胱甘肽还原酶(GR)等酶活性降低, GSH和谷胱甘肽S-转移酶(GST)活性增强, 导致脱氢抗坏血酸(DHA)和氧化型谷胱甘肽(GSSG)含量积累, AsA/GSH降低, 抗坏血酸和谷胱甘肽含量减少[13]。同时AsA和GSH可作为信号分子直接调控MAP激酶, 从而调节水杨酸(SA)、茉莉酸(JA)和乙烯(ET)的合成, 最终介导植株对病原物的防御反应[14, 15]。
胼胝质, 即β -1, 3葡聚糖, 当植物受到病原物侵害后能够迅速在质膜和细胞壁之间沉积, 并诱导产生特定的防御机制[16]。研究发现, 大豆(Glycine max)在抵御花叶病毒侵染过程中, 产生了大量的胼胝质从而限制了病毒的胞间运输[17]。抗病性越强的品种在侵染点越早地积累了胼胝质, 其沉积特点与大豆抗病毒侵染密切相关[18]。在mapk4突变型拟南芥植株中, AtGsl5基因与拟南芥抗病性密切相关, 该基因在mapk4中高效表达, 胼胝质合成酶活性升高, 同时胼胝质大量累积, 进一步证实了胼胝质在植物抗病性中的重要作用[19, 20]。
为了探讨乙烯对匍匐翦股颖ISR抗病反应中AsA-GSH循环以及胼胝质沉积的影响, 本研究以立枯丝核菌(Rhizoctonia solani)侵染匍匐翦股颖, 通过BDO诱导产生ISR抗病反应后, 采用不同浓度的乙烯诱导剂和抑制剂喷施叶片, 探讨在ISR抗病反应中AsA、GSH含量及相关酶活性以及胼胝质的沉积部位、大小和数量等变化, 从而揭示乙烯信号分子在匍匐翦股颖ISR抗病生理响应中的作用特点, 以期为匍匐翦股颖抗病性研究提供一定的理论依据。
供试匍匐翦股颖选取北方常见品种Penn-A4, 由北京克劳沃公司提供。立枯丝核菌菌种(#3.2888) 购自中国普通微生物菌种保藏中心。
试验于2016年7月进行, 在规格为10 cm× 10 cm× 8 cm的方形花盆中装入灭菌的沙土混合物(土:沙=2:1)。种子用无菌水浸泡6 h, 70%乙醇冲洗1 min, 次氯酸钠浸泡15 min, 后用无菌水冲洗6次。每盆均匀撒播处理后的匍匐翦股颖种子0.3 g, 覆盖一薄层沙土, 每日定量浇水15 mL。置于(25± 2) ℃恒温条件下生长, 光周期为16 h· d-1。
立枯丝核菌在马铃薯葡萄糖琼脂培养基(PDA)中, 25 ℃培养4 d后用打孔器取6 mm直径菌丝块, 加入到PDA培养基中, 在25 ℃ 100 r· min-1的条件下培养4 d, 取出菌团, 去掉中心的培养基颗粒, 然后将菌丝放入无菌水中清洗, 清洗完成后, 拧干菌丝放入研钵进行研磨, 研磨成匀浆后加入无菌水, 浓度为OD340 nm=0.8。
待匍匐翦股颖长至10 cm左右时, 将15 mL 100 μ mol· L-1 BDO直接浇灌到幼苗根部土壤中, 连续浇灌5 d。配制含0.01%吐温的菌液, 采用菌丝悬浮液喷雾法接种匍匐翦股颖, 每盆均匀喷洒15 mL的菌液, 喷洒完成后等5 d, 诱导ISR反应。取生长情况相同的盆栽苗, 采用乙烯抑制剂氯化钴(CoCl2)和促进剂1-氨基环丙烷羧酸(1-amino cyclopropane carboxylic acid, ACC)处理幼苗, 处理浓度分别为A:1 mmol· L-1 CoCl2; B:3 mmol· L-1 CoCl2; C:5 mmol· L-1 CoCl2; D:50 μ mol· L-1 ACC; E:75 μ mol· L-1 ACC; F:100 μ mol· L-1 ACC; CK为清水对照。每个处理5个重复。上述处理每次均喷施15 mL, 喷施5、10、15 d后取材, 参考文献[21]的方法, 进行石蜡切片的制备, 同时剪取喷施10 d的叶片进行生理指标的测定。
匍匐翦股颖幼苗经BDO诱导产生ISR抗病反应, 在ET促进剂ACC或抑制剂CoCl2处理后, 测定了AsA-GSH循环中各生理特性的变化。APX活性的测定参照Nakano等[22]的方法, GR活性的测定参照Foyer 等[23]的方法, AsA含量的测定参照Kampfenkel等[24]的方法, GSH和GSSG含量的测定参照Anderson等[25]的方法。
1.4.1 取材 每个处理每盆随机剪取1株匍匐翦股颖幼苗, 然后去掉根部, 叶尖, 保留中部叶片, 切成5 mm左右的小段, 混匀保存于装有福尔马林-醋酸-酒精固定液(FAA)的青霉素小瓶, 置于4 ℃冰箱中保存。
1.4.2 脱水、透明 材料经FAA固定12~16 h后, 依次放入15%、30%、50%、70%、85%的乙醇中梯度脱水, 各浓度脱水20 min, 后于95%乙醇中脱水30 min, 无水乙醇中脱水2次, 各20 min。然后依次置换1/2二甲苯、二甲苯进行透明, 于1/2二甲苯中透明1 h, 二甲苯中透明2次, 每次30 min, 直至材料完全透明为止。
1.4.3 浸蜡、包埋 在装有透明材料的青霉素小瓶中加碎蜡2次, 第1次加入与瓶中二甲苯等量的碎蜡, 放入电热鼓风干燥箱中, 36 ℃保持1 h, 待碎蜡完全融化后, 加入瓶中液体50%的碎蜡, 36 ℃保存12 h, 温度调至42 ℃, 置换50%石蜡保持1 h, 温度调至50 ℃, 置换75%的石蜡保持30 min后, 温度调至60 ℃, 依次置换纯石蜡3次, 各30 min, TKY-BMB型石蜡包埋机进行包埋。1个蜡块中1个材料, 蜡块的尺寸为:0.5 cm× 0.5 cm× 0.5 cm(每个处理至少包埋蜡块10个), 将包埋好的蜡块冷却后直接修块, 进行切片或保存到4 ℃冰箱备用。
1.4.4 切片、展片、烤片 采用轮式手动切片机进行连续切片, 厚度10 μ m, 切片时每个蜡块中材料的前面部分切除, 每个蜡块切片10张, 每张蜡带至少含有8个材料。将恒温水浴锅温度调节至45 ℃, 在500 mL大烧杯加入蒸馏水放入水浴锅中, 将切好的蜡带光面朝下放入烧杯中, 待蜡带完全展开后, 将涂抹好蛋清甘油的载玻片伸入烧杯中, 使蜡带粘到载玻片上, 将粘有蜡带的载玻片自然晾干后, 在光学显微镜下观察展片效果, 取展片效果好的片子(每个处理镜检切片数约30张)置于电热鼓风干燥箱中于38 ℃下烘烤, 使之完全干燥。
1.4.5 染色、封片 取干燥后的片子, 依次放入加有二甲苯、1/2二甲苯、95%的乙醇、85%的乙醇、70%的乙醇、50%的乙醇、30%的乙醇、磷酸缓冲液、0.1%的苯胺蓝染色剂的立式染缸中; 在二甲苯、1/2二甲苯中各5 min, 95%的乙醇、85%的乙醇、70%的乙醇、50%的乙醇、30%的乙醇中各5 s, 磷酸缓冲液中10 min, 0.1%的苯胺蓝染色剂中30 min。最后将染色后的片子取出, 置于蒸馏水中30 s, 洗净片子上的杂质后, 过1/2二甲苯、二甲苯各10 s, 待片子干燥后采用中性树胶封片。
1.4.6 拍照观察 将所得切片自然风干后, 置于LeiCa DM6000 B荧光显微镜下观察并拍照。
使用IBM SPSS Statistics 22和Microsoft Office Excel 2010进行数据分析和统计, 胼胝质颗粒大小用Image-Pro Plus 6.0软件进行分析计算, 每个处理镜检片数30张, 每张取5~10个视野。根据检测的维管束数量及其上沉积的胼胝质沉积部位、大小、数量, 计算出平均每个维管束中胼胝质的沉积数量和沉积面积。
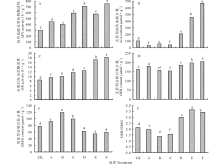
2.1.1 不同浓度CoCl2及ACC处理对匍匐翦股颖ISR反应中APX活性的影响 如图1A所示, 经不同浓度CoCl2和ACC处理后, 匍匐翦股颖幼苗叶片的APX活性均显著高于CK。随着CoCl2处理浓度的增加, APX活性呈先降低后升高的趋势, 在处理浓度为5 mmol· L-1 条件下升至最高, 为595.56 U· g-1。随着ACC处理浓度的增加, APX活性也呈现先降低后升高的趋势, 在100 μ mol· L-1ACC处理下升至最高, 达755.56 U· g-1。在乙烯促进剂ACC处理下, APX活性显著高于CoCl2的处理活性(P< 0.05)。
2.1.2 不同浓度CoCl2及ACC处理对匍匐翦股颖ISR反应中AsA含量的影响 不同浓度ACC处理匍匐翦股颖幼苗后, 各处理的AsA含量差异显著(图1B)。ACC处理下的AsA含量显著高于对照及CoCl2处理, 且随着处理浓度的增加, AsA含量也显著升高, 并在100 μ mol· L-1ACC处理下升至最高, 达666.16 μ mol· g-1。各浓度CoCl2处理下, AsA含量均低于对照, 并维持较低水平, 且各处理间差异不显著(P> 0.05)。
2.1.3 不同浓度CoCl2及ACC处理对匍匐翦股颖ISR反应中GR活性的影响 在匍匐翦股颖ISR抗病反应中, 不同浓度CoCl2及ACC处理下的GR活性均显著高于对照(图1C)。ACC处理下的GR活性显著高于CoCl2处理条件。随着CoCl2及ACC处理浓度的升高, GR活性均呈现显著上升的趋势, 分别在5 mmol· L-1 CoCl2和100 μ mol· L-1 ACC处理下升至11.66和18.13 U· g-1(P< 0.05)。
2.1.4 不同浓度CoCl2及ACC处理对匍匐翦股颖ISR反应中GSH含量的影响 不同浓度ACC处理匍匐翦股颖幼苗后, 各处理GSH含量差异显著(图1D)。随着CoCl2处理浓度的升高, GSH含量逐渐降低, 在5 mmol· L-1 CoCl2处理下降至最低, 为153.99 μ mol· g-1。随着ACC处理浓度的升高, GSH含量显著增加, 在100 μ mol· L-1 ACC处理下升至最高, 达203.78 μ mol· g-1(P< 0.05)。
2.1.5 不同浓度CoCl2及ACC处理对匍匐翦股颖ISR反应中GSSG含量的影响 匍匐翦股颖ISR抗病反应中, ACC处理下的GSSG含量显著低于CoCl2及对照(图1E)。经3 mmol· L-1 CoCl2处理后, GSSG含量升至最高, 为118.47 μ mol· g-1, 而经75 μ mol· L-1 ACC处理后, GSSG含量则降至最低, 为54.14 μ mol· g-1(P< 0.05)。
2.1.6 不同浓度CoCl2及ACC处理对匍匐翦股颖ISR反应中GSH/GSSG的影响 如图1F所示, 各处理条件下GSH/GSSG差异显著。经ACC处理后的GSH/GSSG显著高于CoCl2及对照。在75 μ mol· L-1 ACC处理下GSH/GSSG达到最高, 为3.64, 而在3 mmol· L-1 CoCl2处理下GSH/GSSG降至最低, 为1.36。此外, ACC处理下的GSH/GSSG显著高于对照, 而CoCl2处理下的GSH/GSSG则显著低于对照(P< 0.05)。
2.2.1 不同浓度CoCl2及ACC处理对匍匐翦股颖ISR反应中胼胝质的主要沉积部位、大小和数量的影响 由图2所示, 匍匐翦股颖叶片中胼胝质的主要沉积部位是厚壁细胞、韧皮部、木质部及表皮组织(图2D~F), 其中韧皮部中胼胝质的沉积形态主要为丝状、小颗粒状、中颗粒状和大颗粒状四种形式(图2A~C)。此外, 在同一维管束中可观察到不同的胼胝质形态, 图2B显示胼胝质沉积主要为韧皮部丝状、大颗粒状及厚壁细胞丝状胼胝质, 图2C中沉积的主要为韧皮部丝状及中小颗粒胼胝质, 图2E中显示沉积的主要为韧皮部、厚壁细胞丝状胼胝质, 图2F中沉积类型为木质部、韧皮部和厚壁细胞丝状胼胝质。图2G显示了大量的胼胝质沉积, 主要以丝状胼胝质为主。
表1显示了不同浓度乙烯抑制剂(CoCl2)及促进剂(ACC)处理下匍匐翦股颖叶片中胼胝质的主要沉积部位、大小和数量。在不同的处理条件和处理时间下, 厚壁细胞的胼胝质沉积均高于其他组织部位。在CoCl2和ACC处理5 d后, 匍匐翦股颖幼苗叶片的胼胝质沉积出现了不同的变化趋势, CoCl2处理下表皮组织、厚壁细胞和木质部的胼胝质沉积总量高于韧皮部, 而且随着CoCl2处理浓度的升高, 韧皮部中胼胝质的总量呈下降趋势, 反之, 随着ACC处理浓度的升高, 韧皮部中胼胝质的数量则逐渐增加, 同时CoCl2和ACC处理下的韧皮部胼胝质总量均高于对照。在CoCl2和ACC处理10 d后, 匍匐翦股颖幼苗叶片的胼胝质沉积总量表现出相同的变化趋势, 二者处理下表皮组织、厚壁细胞和木质部的胼胝质沉积总量高于韧皮部, 随着CoCl2处理浓度的升高, 韧皮部、木质部及表皮组织中的胼胝质沉积总量呈下降趋势, 反之, 随着ACC处理浓度的升高, 所有组织部位中胼胝质的数量均呈增加趋势, 同时, CoCl2处理下的木质部、厚壁细胞和表皮组织的胼胝质总量高于对照。CoCl2和ACC处理15 d后的胼胝质沉积与前期处理呈现不同的变化趋势, 两种处理条件下表皮组织、厚壁细胞和木质部的胼胝质总量均高于韧皮部, 随着CoCl2处理浓度的升高, 所有组织胼胝质的沉积总量均逐渐降低, 同时随着ACC处理浓度的升高, 胼胝质的沉积总量也呈现出降低趋势。由此可知, 经BDO诱导ISR反应的匍匐翦股颖感染褐斑病后, 乙烯对匍匐翦股颖叶片组织中胼胝质的沉积具有一定程度的影响, 主要沉积部位在厚壁细胞、韧皮部组织、木质部组织和表皮组织, 其中厚壁细胞和木质部胼胝质沉积较多, 而表皮组织胼胝质沉积较少。一定浓度的乙烯抑制剂能够降低胼胝质的沉积数量, 乙烯促进剂则增加了胼胝质的沉积, 提高了匍匐翦股颖幼苗的抗病性。同时厚壁细胞的胼胝质沉积数量显著高于其他部位, 可见该位置是匍匐翦股颖抵御病害侵染的主要障碍, 防止病害对植株的进一步侵染。
| 表1 匍匐翦股颖叶片中胼胝质的沉积主要部位以及各部位数量 Table 1 The callose main deposition positions and number of different in leaves of creeping bentgrass |
2.2.2 不同浓度CoCl2及ACC处理对匍匐翦股颖ISR反应中胼胝质沉积面积的影响 由表2可得, 在CoCl2和ACC喷施处理5 d时, 匍匐翦股颖幼苗叶片中胼胝质的沉积面积在乙烯合成抑制剂CoCl2各处理间无显著性差异, 在50 μ mol· L-1 ACC处理下则显著低于其他处理浓度, 胼胝质沉积面积较对照少0.05 mm2, 胼胝质沉积个数较对照多30.45。在CoCl2和ACC喷施处理10 d时, 匍匐翦股颖幼苗叶片中胼胝质的沉积面积在CoCl2各处理间无显著性差异, 但50和75 μ mol· L-1 ACC处理下胼胝质的沉积量显著高于100 μ mol· L-1 ACC处理条件, 亦显著高于CK。在CoCl2和ACC喷施处理15 d时, 匍匐翦股颖幼苗叶片中胼胝质沉积面积在CoCl2和ACC各处理间无显著差异。由此可见, 50 μ mol· L-1 ACC处理5 d时胼胝质沉积最少, 而50和75 μ mol· L-1 ACC处理10 d时胼胝质沉积面积明显高于CoCl2, 处理15 d时各处理间无显著差异。乙烯分子对由BDO诱导的ISR反应中胼胝质的沉积具有一定影响, 但随着病害胁迫时间的延长, 胼胝质沉积面积逐渐减少, 且在病菌侵染初期, 低浓度乙烯条件(50 和75 μ mol· L-1 ACC)使得匍匐翦股颖ISR反应中胼胝质的沉积显著增加, 增强了匍匐翦股颖幼苗的抗病性, 但至侵染后期, 胼胝质逐渐降解, 沉积面积减少, 各处理间无显著差异。
| 表2 匍匐翦股颖叶片中胼胝质的沉积面积 Table 2 The callose deposition area in the creeping bentgrass leaves |
AsA-GSH循环在ROS清除反应中具有重要作用。在该循环中, AsA作为特定的电子供体通过APX减少了H2O2, 即在APX的催化下将H2O2还原成H2O, 同时AsA被氧化成脱氢抗坏血酸, 氧化的脱氢抗坏血酸则由GSH通过非酶促方式还原, 从而构成AsA-GSH循环[26]。APX主要存在于细胞质、叶绿体和线粒体等部位, 能够清除植物体内大量累积的H2O2, 该酶过量表达能够减少H2O2对植物的毒害作用。同时抗坏血酸是植物体内非酶活性氧清除系统的重要组成部分[27]。对烟草(Nicotiana tabacum)与TMV(烟草花叶病毒)互作体系的深入研究发现, 烟草遭受病毒侵染后, 其体内活性氧大量产生, APX活性下降, 防止了H2O2的有效降解, 而H2O2能够诱导程序性细胞坏死, 并激活病程相关蛋白基因的表达, 防止病毒的进一步侵染, 反之, H2O2水平的过高积累再次诱导了APX活性的增加[28, 29]。本研究发现, 随着CoCl2和ACC处理浓度的增加, APX活性均呈现先降低后升高的趋势, 当APX活性降至最低时, 匍匐翦股颖幼苗体内H2O2大量积累, 抑制病害侵染, 增强植株抗病性。但经高浓度CoCl2和ACC处理后APX活性升至最高, 降低了H2O2在植株体内水平。Li等[30]的研究结果也表明, 病毒侵染的初期阶段, APX活性降低, 但随着H2O2大量积累植物细胞破坏, APX活性又有所升高。经一定浓度的ACC和CoCl2处理, 匍匐翦股颖植株体内APX活性均显著高于对照, 且经ACC处理后APX活性升至最高。可见, 一定浓度的乙烯能够调节匍匐翦股颖在ISR抗病反应中APX的活性, 积累H2O2诱导过敏反应, 消除H2O2保护植株正常细胞, 既确保活性氧在直接抑菌及诱导抗性基因等ISR抗病反应中的作用, 又防止活性氧过量积累伤害细胞。
AsA能够作为信号物质诱导抗病基因表达, 对植物中ROS, H2O2和ABA、SA、JA和乙烯等植物激素的含量有一定的调控作用, 从而对植物的抗病性产生积极作用。在拟南芥vtc1突变体中, AsA的缺乏导致病程相关蛋白PR1、PR2和PR5编码基因的不同表达[31]。同时, 外源AsA可诱导烟草对TMV产生全株抗性, 并表达了酸性PRs抗性蛋白基因, 增强了烟草对TMV的抗病性[32]。本研究结果表明, 不同浓度CoCl2和ACC处理匍匐翦股颖幼苗后, 各处理的AsA含量差异显著, 且经ACC处理后的AsA含量显著高于CoCl2处理。可见, 匍匐翦股颖ISR抗病反应中ET的积累诱导了AsA含量的升高, 增强了植株抗病性。同时随着乙烯浓度的积累, AsA含量达到最高。房媛媛等[33]研究发现匍匐翦股颖植株经BDO诱导的ISR抗病反应中, 随着接菌时间的延长, AsA和DHA含量也显著积累, 有效诱导了匍匐翦股颖对褐斑病的抗性。
在AsA-GSH循环中, 脱氢抗坏血酸再生AsA与GR活性密切相关, GR活性升高, 促进DHA还原为AsA, 也催化GSSG还原为GSH, GSH直接或间接地调控了活性氧的合成, 诱导了防御基因的表达, 介导了植物体的防御反应。灰葡萄菌侵染番茄叶片后, AsA和GSH含量显著降低, GR活性增强[34]。病毒感染细胞后, GSH/GSSG显著下降, 这被认为是病毒感染后氧化逆境的产生[35]。本研究中, 低浓度的乙烯环境下, 匍匐翦股颖幼苗中AsA含量较低, APX活性下降, 大量还原型谷胱甘肽GSH被催化还原为GSSG, GSSG大量积累, 同时GR活性较低, GSSG经GR少量还原为GSH, GSH保持较低水平。而高浓度的乙烯环境下, AsA含量较高, APX活性升高, GSSG在高活性GR作用下催化还原为GSH, 使得GSH大量积累。研究发现, GSH能够调控JA/ET信号转导途径中相关基因的表达, 而JA和ET是ISR抗病反应中重要的信号分子[36]。因此, 在匍匐翦股颖ISR抗病反应中, 一定浓度乙烯能够诱导AsA和GSH含量的积累, 它们不仅参与了活性氧的代谢平衡, 同时也作为信号分子在ISR抗病反应中起到重要作用。
大量研究表明, 病原菌侵染植物时, 胼胝质的沉积是一种常见的细胞应答反应, 经常以胼胝质的积累作为抗病性强弱的指标。白粉菌感染拟南芥(Arabidopsis thaliana)、细菌感染豌豆(Pisum sativum)时, 被感染的细胞壁处加厚, 产生大量的胼胝质沉积, 感染TMV的烟草, 植株整个叶片细胞壁上都有胼胝质沉积, 且抗病植株沉积量显著高于感病植株[37]。此外, 泡桐(Paulownia)感染丛枝病(MLO)后, 抗病性和感病无性系筛管胼胝质的沉积存在显著差异, 在抗病系中胼胝质大量沉积 [38]。本研究中匍匐翦股颖叶片感染褐斑病后有大量的胼胝质沉积, 且沉积部分主要是维管束鞘厚壁细胞、韧皮部、木质部及表皮组织。丁新伦等[39]实验表明, 在水稻条纹病(RSV)的胁迫下, 感病水稻叶片组织中胼胝质的荧光强度与健株无显著差异, 但是抗病水稻叶片组织中胼胝质的荧光强度却较健株明显增强, 且大维管束鞘内层厚壁细胞、木质部和韧皮部以及大维管束鞘延伸的厚壁组织、小维管束、表皮细胞以及叶肉细胞均有胼胝质荧光出现。
植物抗病信号传导途径分为两条, 分别是SA和JA/ET信号途径, 其中 JA/ET信号途径介导ISR, 在JA和ET的相互作用下, 影响了植物次生代谢物质的积累[33]。研究发现, 芒果(Mangifera indica)采后使用10 μ mol· L-1的茉莉酸甲酯(MeJA)处理显著降低了贮藏期的病情指数和接种炭疽病菌的病斑直径, 使用10 μ mol· L-1的MeJA处理显著促进了贮存期接种炭疽杆菌芒果果实内源激素乙烯的释放, 其释放速率呈现出前期迅速增高后期急剧下降的趋势, 有效增加了贮藏期芒果的抗病性[40]。苏晶等[41]试验发现, 使用1.0 μ L· L-1 1-MCP处理可以抑制伤口应激早期乙烯的释放, 伤口组织中苯丙氨酸酶(PAL)和过氧化物酶(POD)活性受到抑制, 降低了伤口处总酚和木质素的含量, 延缓了愈伤的进程, 增加了果实对灰霉菌的易感性, 且1.0 μ g· L-1的1-MCP处理可以提高果实乙烯的释放量, 加快愈伤进程, 提高果实的抗病性。上述研究表明, 一定浓度的乙烯处理与植物的抗病性呈显著正相关, 且抗病性越强, 染病后胼胝质的沉积越多, 但目前尚未有ET在草坪草ISR抗病性响应中的作用的相关报道。本研究发现, 胼胝质在匍匐翦股颖感染褐斑病初期, 经低浓度乙烯合成促进剂ACC处理后, 尚未大量沉积, 随着发病时间的延长, 胼胝质开始显著增加, 但在褐斑病侵染后期, 胼胝质的沉积在乙烯合成抑制剂和促进剂之间无显著差异。
综上所述, 在BDO诱导的匍匐翦股颖ISR抗病反应中, 乙烯信号分子影响了AsA-GSH循环以及胼胝质的沉积, 诱导了匍匐翦股颖的抗病性。一定浓度的乙烯诱导了AsA和GSH含量的明显上升, 但其如何与乙烯信号分子协同作用, 参与到匍匐翦股颖ISR抗病反应, 尚有待于进一步研究。同时在匍匐翦股颖感染褐斑病初期, 乙烯分子能够有效诱导胼胝质沉积, 但在侵染后期乙烯分子无显著影响。可知乙烯信号分子对胼胝质沉积的影响是短期效应, 一定浓度的乙烯分子能有效增强匍匐翦股颖植株对褐斑病的抵御能力。研究结果为探清匍匐翦股颖ISR抗病响应中ET信号分子如何调控抗病生理特性提供了理论基础。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|