作者简介:赵小强(1990-),男,甘肃陇西人,博士。E-mail: zhaoxq3324@163.com。方鹏(1992-),男,青海西宁人,硕士。E-mail: fangpeng3324@163.com。
**共同第一作者 These authors contributed equally for this work.
株高、穗位高、穗位比、叶面积、叶形系数、散粉-吐丝时间间隔(ASI)和雄穗分枝数等是影响玉米生态适应性、抗倒性、耐密植能力及生产潜力的重要农艺性状。因此, 以TS141为共同亲本, 分别与廊黄、昌7-2杂交, 构建2套F2群体(LTpop、CTpop)为试材, 分析了7个农艺性状的杂种优势, 探讨了其与单穗重间的相互关系, 并进行相关性状QTLs的检测及效应分析。结果表明: 1)2个F1杂交种的穗位比和ASI表现为明显的中亲优势, 其余5个性状均呈明显的正向超亲优势;F1杂种优势指数和相对杂种优势均表现为株高>穗位高>雄穗分枝数>叶面积>叶形系数>ASI>穗位比, 而F2优势降低率表现为叶面积>株高>穗位高>雄穗分枝数>ASI>叶形系数>穗位比。2)单穗重与ASI呈显著负相关, 与其余性状间均呈显著正相关;除雄穗分枝数外, 利用逐步回归分析成功构建了单穗重与其余6个农艺性状间的最优多元线性回归方程。3)利用CIM法在2套F2群体间总共检测到56个QTLs位点, 单个QTL的表型贡献率介于4.22%~15.74%。其中株高、穗位比、ASI和雄穗分枝数均受加性和非加性效应的调控, 而其余性状均受非加性效应的调控;进一步分析, 在2套F2群体中总共检测到12个稳定表达的sQTLs位点, 分别位于Bin1.07(umc1278~bnlg1025)调控株高、Bin1.08~1.10(mmc0041~phi308707)调控叶面积、Bin2.02(umc1823~umc2363)调控ASI、Bin4.06(bnlg1621a~umc2027)同时调控穗位高和穗位比、Bin4.09(umc2287~umc2360)同时调控ASI和雄穗分枝数、Bin6.05(umc2040~bnlg1174a)调控ASI、Bin7.00(umc2177~umc1378)调控雄穗分枝数、Bin8.08(umc1005~umc2218)调控穗位比、 Bin10.01~10.02(bnlg451~umc1337)同时调控株高和穗位比。为玉米相关性状的育种应用、精细定位及基因克隆提供有益参考。
Seven important agronomic traits that influence the ecological adaptability, lodging resistance, dense planting ability and the production potential of maize are plant height (PH), ear height (EH), panicle aspect ratio (PAR), leaf area (LA), leaf shape coefficient (LSC), anthesis-silking interval (ASI) and tassel branch number (TBN). In order to analyze the heterosis of these seven traits, two F2 populations were derived from crosses of Langhuang×TS141 (LTpop) and Chang7-2×TS141(CTpop). Analysis was also undertaken to reveal the relationship between these traits and ear weight (EW), and to detect QTLs and their corresponding QTL effects. The results showed that: 1) The PAR and ASI of the two F1 hybrids showed significant mid-parent heterosis, while the other traits showed significant positive over-parent heterosis. The F1 heterosis index and relative heterosis results were consistently PH>EH>TBN>LA>LSC>ASI>PAR. However, the F2 advantage reduction rate results were LA>PH>EH>TBN>ASI>LSC>PAR. 2) EW was significantly negatively correlated with ASI and was significantly positively correlated with the other six traits. Moreover, except for TBN, optimal regression equations between EW and the other six traits were successfully constructed via stepwise regression analysis. 3)56 QTLs were detected in the two F2 populations using composite interval mapping (CIM), with the results explaining 4.22%-15.74% of phenotypic variation per QTL. For these QTLs, PH, PAR, ASI and TBN showed both additive and non-additive effects, while the other traits showed non-additive effects. Further analysis identified 12 stable QTLs (sQTLs) in the two F2 populations. These sQTLs were for PH (Bin1.07; umc1278-bnlg1025), LA (Bin1.08-1.10; mmc0041-phi308707), ASI (Bin2.02; umc1823-umc2363), EH and PAR (Bin4.06; bnlg1621a-umc2027), ASI and TBN (Bin4.09; umc2287-umc2360), ASI(Bin6.05; umc2040-bnlg1174a),TBN (Bin7.00; umc2177-umc1378), PAR (Bin8.08; umc1005-umc2218), and for PH and PAR (Bin10.01-10.02; bnlg451-umc1337). This study has provided valuable information for application in the breeding, precision mapping and positional gene cloning for desired agronomic traits in maize.
玉米(Zea mays)作为高效的C4粮食作物, 蕴藏着巨大的产量潜力, 并在保障全球粮食安全中发挥着举足轻重的作用。然而, 玉米易受多种生物和非生物逆境胁迫的制约, 其严重影响玉米正常的生长发育及代谢过程, 最终导致玉米严重减产。株高、穗位高和穗位比对提高玉米的抗倒伏、抗逆性及增加玉米的种植密度, 进而改善植株光合作用等方面具有重要的影响[1, 2, 3]。叶片是玉米光合作用的主要源器官, 叶面积和叶形系数是衡量光合产物和群体冠层结构的重要农艺性状, 对于产量形成具有重要的作用[4, 5]。雄穗分枝数和散粉-吐丝时间间隔(ASI)是揭示玉米抗旱性大小、授粉能力强弱和产量高低的重要农艺性状, 而且Lambert等[6]、刘伟华等[7]和Zhao等[8]研究表明雄穗较小的玉米, 其群体下部的透光性增强, 雄穗生长对养分的消耗减少, 因而能够显著提高玉米产量。因此, 在高产育种实践和生产上, 深入剖析这些农艺性状的遗传机理, 有针对性地制定育种方案, 进而提高玉米育种进程具有重要的指导意义。
玉米的这7个农艺性状是典型的数量遗传性状, 其受多个微效基因的调控, 同时易受环境的影响, 而借助分子标记技术鉴定调控这些农艺性状的基因组区域为进一步深入剖析其遗传机理提供了准确而可靠的手段。目前, 关于玉米这7个农艺性状QTLs定位的研究国内外已有报道[2, 3, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19]。就这些检测到的QTLs位点而言, 由于不同学者所用的材料遗传背景、群体结构、群体大小、检测环境及QTL定位方法不同等原因, 导致研究结果不尽相同。而不同遗传背景的材料往往带有不同的影响这些农艺性状的基因或QTLs信息。因此, 在更为丰富的遗传背景下检测更多调控这些农艺性状的QTLs位点, 不仅能够全面澄清目标性状的遗传机制, 而且能为相应性状QTL精细定位、QTG(quantitative trait gene)与候选基因的确定与分离提供有益参考。基于以上考虑, 本研究以TS141为共同父本, 与廊黄、昌7-2 为母本分别杂交后构建了2套F2群体为试材, 通过对其株高、穗位高、穗位比、叶面积、叶形系数、ASI和雄穗分枝数等7个主要农艺性状QTLs定位及位点效应分析, 以期挖掘和鉴定不同遗传背景下稳定表达的QTL(stable QTL, sQTL), 为相应性状QTL精细定位及玉米高产分子标记辅助选择(marker-assisted selection, MAS)育种鉴定提供基础。
本研究所用的试验材料参照本课题组前期的试验结果[8, 20, 21], 选择了各农艺性状间均有较大差异的自交系TS141(共同父本)与廊黄/昌7-2(母本)杂交, 组配了2个F1杂交种(廊黄× TS141和昌7-2× TS141), 下年种植2个F1杂交种, 花前从F1中分别选择长势整体一致的2个单株严格套袋自交授粉分别获得了含有202(LTpop)和218(CTpop)个单株的F2作图及定位群体。其中自交系TS141属于Reid系, 廊黄和昌7-2属于四平头系[8, 22, 23]。
将3个供试亲本、2个F1杂交种及2个F2群体于2013年4月15日播种于甘肃农业大学平凉玉米育种站(北纬106.93° , 东经35.43° ; 海拔1204 m)。试验行长6 m, 每行30株, 行距0.6 m, 种植密度为55580株· hm-2。玉米生育期内(4-9月)试验点平均温度为16.8 ℃, 平均降水量为68.1 mm, 其他管理同一般大田。田间选择长势均匀一致的亲本(10株)、F1杂交种(10株)和F2群体的每一单株, 并参照Yang等[24]和Wu等[25]的方法, 待玉米抽雄吐丝时统计散粉-吐丝时间间隔(anthesis-silking interval, ASI)。花后15 d统计玉米的株高(plant height, PH)、穗位高(ear height, EH)、雄穗分枝数(tassel branch number, TBN), 并计算:
穗位比(panicle aspect ratio, PAR): PAR=EH/PH
穗叶的叶面积(leaf area, LA): LA=0.75× LL× LW
穗叶的叶形系数(leaf shape coefficient, LSC): LSC=LL/LW
式中: LL为测定穗叶的叶长; LW为测定穗叶的叶宽。9月底待玉米成熟后收获并自然风干, 室内考种考察单穗重(ear weight, EW)。参照Zhao等[8]的方法衡量相应7个农艺性状的杂种优势大小, 即:
F1杂种优势指数(F1 heterosis index, HI): HI=F1/MP× 100%
相对杂种优势(relative heterosis, RH): RH=(F1-MP)/F1× 100%
中亲优势(mid-parent heterosis, MH): MH=(F1-MP)/MP× 100%
超亲优势(over-parent heterosis, OH): OH=(F1-PH)/PH× 100%
F2优势降低率(F2 advantage reduction rate, ARR): ARR=(F2-F1)/F1× 100%
式中: MP为双亲平均值; PH为高值亲本。利用IBM SPSS 19.0软件统计分析F2群体相应性状的均值、偏度、峰度和Pearson相关系数。参照杨光宇等[26]的方法估算相应7个农艺性状的遗传力(Heritability, H2), 即:
H2=100-(1/4VP1+1/2VF1+1/4VP2)/VF2× 100%
式中: VF1、VP1、VP2和VF2分别为F1杂交种、亲本P1、亲本P2和F2群体的方差。参照Fu等[27]的方法构建单穗重与7个农艺性状间的逐步回归方程。
分别取廊黄、昌7-2、TS141、F1杂交种和F2群体单株的幼苗叶片, 采用Saghai-Maroof等[28]提出的CTAB法提取玉米幼苗叶片的全基因组DNA。从玉米基因组数据库(Maize Genome Database)网站(http://www.maizegdb.org)上选取均匀分布于玉米10个连锁群的872对SSR (simple sequence repeat)标记, 由上海生工生物有限公司合成。参照彭云玲等[29]的方法进行PCR扩增、电泳、银染, 对这872对SSR标记进行亲本间多态性标记的筛选, 再将筛选出的多态性SSR标记在F2群体间进行全基因组扫描, 采集相应群体的标记带型。所有F2单株的带型按Mendel分离比例作卡方(χ 2)检测, 判断是否存在偏分离。采用JoinMap© 4.0软件(http://www.kyazma.nl/index.php/mc.JoinMap/sc.Evaluate/)构建2套F2群体的分子遗传连锁图谱, 选用“ Kosambi” 函数计算图距(centimorgan, cM)。
结合F2群体分子标记带型和农艺性状表型数据, 采用Windows QTLs Cartographer 2.5软件(http://ststgen.ncsu.edu/qtlcart/WQTLcart.htm)进行相应农艺性状的QTLs的检测。采用复合区间作图法(composite interval mapping, CIM)中的Zmapqtl程序模块Model6, 每隔2 cM对基因组扫描一次, 窗口大小设定为10 cM, 通过1000次随机抽样确定LOD(LOD> 3.0)阈值[30]。参照Stuber等[31]的方法估算基因的作用方式: |d/a|=|显性效应值/加性效应值|; A(加性效应), |d/a|=0.00~0.20; PD(部分显性), |d/a|=0.21~0.80; D(显性效应), |d/a|=0.81~1.20; OD(超显性效应), |d/a|> 1.20。参照McCouch等[32]的方法进行QTL命名, 即“ q+性状英文缩写+染色体英文缩写+QTL个数” 。根据Tuberosa等[33]和Zhao等[8]的标准检测sQTL, 即在不同群体或环境间检测到同一性状的QTL, 标记区间相同或置信区间(confidence interval, CI)重叠(距离< 20 cM), 则被认定为一个sQTL。
7个农艺性状表型鉴定结果表明, 除亲本廊黄与TS141间穗位比、昌7-2与TS141间叶形系数差异不显著外, 亲本间其余农艺性状差异显著(P< 0.01或P< 0.05), 且父本TS141的株高、穗位高、叶面积、ASI和雄穗分枝数等明显大于母本廊黄/昌7-2(表1和表2), 说明亲本间存在较大的遗传基础, 其杂交后代可以进行数量性状遗传分析。与双亲相比, 2个F1杂交种的株高、穗位高、叶面积、叶形系数和雄穗分枝数显著大于高值亲本(P< 0.01或P< 0.05), 表现为明显的正向超亲优势, 而2个F1杂交种的穗位比和ASI均介于双亲之间, 且趋向于低值亲本, 表现为中亲优势。F1杂种优势指数和相对杂种优势在7个性状间表现一致均为: 株高(175.5%和43.0%)> 穗位高(160.3%和37.6%)> 雄穗分枝数(158.4%和36.8%)> 叶面积(148.0%和31.9%)> 叶形系数(118.5%和15.6%)> ASI(99.7%和-0.4%)> 穗位比(94.4%和-6.3%), 而F2优势降低率在7个性状间表现为: 叶面积(-42.4%)> 株高(-21.0%)> 穗位高(-18.9%)> 雄穗分枝数(-9.0%)> ASI(-8.9%)> 叶形系数(-7.7%)> 穗位比(-5.7%)(表1和表2, 图1)。2套F2群体7个农艺性状的遗传力均较大, 其平均遗传力介于60.8%(叶形系数)~89.4%(株高)(图1), 说明玉米的这7个农艺性状均受遗传特性的影响较大。另外, 2套F2群体7个农艺性状的偏度和峰度均介于-1.0~1.0(表1和表2), 符合正态分布, 表现为典型数量遗传特性, 因此这些性状适合进行QTLs分析。
| 表1 F2群体LTpop7个农艺性状的表型值 Table 1 Performance value of seven agronomic traits in the F2 population (LTpop) |
| 表2 F2群体CTpop7个农艺性状的表型值 Table 2 Performance value of seven agronomic traits in the F2 population (CTpop) |
2套F2群体相关性状间进行了相关性分析(表3)。就农艺性状间相关性而言, 除ASI与株高、叶面积和叶形系数间, 雄穗分枝数与穗位比和叶形系数间相关性不显著外, 其余农艺性状间彼此都呈显著正或负相关(P< 0.01或P< 0.05), 且彼此间的相关系数不同, 说明玉米的形态建成是各农艺性状协同作用的结果。就单穗重与农艺性状间相关性而言, 除单穗重与ASI呈显著负相关(P< 0.01)外, 单穗重与其余农艺性状间都呈显著正相关(P< 0.01或P< 0.05), 且彼此间相关系数不同, 说明各农艺性状显著影响玉米单穗重的形成, 且各农艺性状对单穗重的影响不同, 其平均影响程度依次为穗位高(r=0.537)> 株高(r=0.536)> ASI(r=-0.468)> 穗位比(r=0.403)> 叶面积(r=0.171)> 雄穗分枝数(r=0.140)> 叶形系数(r=0.134)。
| 表3 F2群体(LTpop和CTpop)相关性状的Pearson相关性分析 Table 3 Pearson correlation analysis for related traits in two F2 populations (LTpop and CTpop) |
根据3个亲本、2个F1杂交种及2套F2群体的原始数据, 对单穗重(因变量Y)与7个农艺性状(自变量Xi)建立多元线性回归方程:
Y=-0.105* * * -16.041
其中X1~X6依次为株高、穗位高、穗位比、叶面积、叶形系数和ASI, 方程中X系数为偏回归系数, 它表示X每增加一个单位, 单穗重Y增加量。对回归方程的F检测结果表明该方程达到P< 0.001显著水平, 因此该方程能够直观地反映单穗重与各农艺性状间的回归关系, 且与相关分析结果基本一致。
以LTpop的202个F2单株为作图群体, 用213对在双亲廊黄与TS141间的多态性SSR标记对LTpop群体进行全基因组扫描, χ 2分析发现202对SSR标记符合1:2:1分离比例, 并用此202对SSR标记进行连锁分析, 除umc2582、umc2505和umc2048等未进入连锁群外, 其余199对SSR标记共分成10个连锁群, 图谱全长1542.5 cM, 标记间平均间距为7.8 cM(图2)。类似的以CTpop的218个F2单株为作图群体, 用217对在双亲昌7-2与TS141间的多态性SSR标记对CTpop群体进行全基因组扫描, χ 2分析发现207对SSR标记符合1:2:1分离比例, 并用此207对SSR标记进行连锁分析, 除umc1356和umc2575未进入连锁群外, 其余205对SSR标记共分成10个连锁群, 图谱全长1648.8 cM, 标记间平均间距为8.0 cM(图3)。构建的2套图谱与IBM2 2008 Neighbors frame 6(http://www.maizegdb.org/data_center/map)参考图谱相比, 标记顺序与参考图谱高度一致, 因此其适合用于QTLs检测。
 | 图2 LTpop群体构建的遗传连锁图谱及7个农艺性状QTLs定位Fig.2 Genetic linkage map construction and QTLs mapping for seven agronomic traits in LTpop |
对于玉米的7个农艺性状, 利用CIM法在2套F2群体间总共检测到了56个QTLs位点, 其中LTpop群体间检测到了27个QTLs位点, CTpop群体间检测到了29个QTLs位点, 其分布于玉米的10个连锁群中, 单个QTL可解释表型变异的4.22%(LTpop的qTBN-Ch.1-1)~15.74%(LTpop的qASI-Ch.6-1)(图2和图3, 表4和表5)。就2套F2群体而言, 检测到了11个株高的QTLs位点, 其中18.2%、54.5%和27.3%的株高QTLs分别受加性(A)、部分显性(PD)和显性(D)效应调控。检测到了10个穗位高的QTLs位点, 其中50.0%、40.0%和10.0%的穗位高QTLs受PD、D和超显性(OD)效应调控。检测到了9个穗位比QTLs位点, 其中33.3%、22.2%和44.5%的穗位比QTLs受A、PD和D效应调控。检测到了4个叶面积的QTLs位点, 其中25.0%和75.0%的叶面积QTLs受PD和D效应调控。检测到了5个叶形系数的QTLs位点, 其中40.0%和60.0%的叶形系数QTLs受D和OD效应调控。检测到了9个ASI的QTLs位点, 其中33.3%、22.2%和44.5%的ASI的QTLs受A、D和OD效应调控。检测到了8个雄穗分枝数的QTLs位点, 其中25.0%、37.5%和37.5%的雄穗分枝数QTLs受A、PD和OD效应调控(图4)。
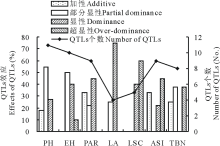 | 图4 F2群体(LTpop和CTpop)7个农艺性状QTLs效应分析Fig.4 QTLs effects analysis of seven agronomic traits in two F2 populations (LTpop and CTpop) |
| 表4 F2群体LTpop 7个农艺性状的QTLs检测 Table 4 QTLs detection for seven agronomic traits in the F2 population (LTpop) |
| 表5 F2群体CTpop 7个农艺性状的QTLs检测 Table 5 QTLs detection for seven agronomic traits in the F2 population (CTpop) |
经比较分析, 以上检测到的56个QTLs位点中有11个影响不同农艺性状的QTLs位点位于染色体上8个相同标记和Bin(Bin1.00~1.01、Bin2.02、Bin4.06、Bin4.09、Bin5.06~5.07、Bin6.05、Bin8.05、Bin10.01~10.02)区间, 为“ 一因多效” 位点(图2和图3), 说明调控农艺性状的QTLs位点常存在于相同的染色体区域, 因此, 不同农艺性状的QTLs位点普遍存在紧密连锁的现象。另外, 2套F2群体间总共检测到了12个sQTLs位点, 其分别是位于Bin1.07(umc1278~bnlg1025)调控株高、Bin1.08~1.10(mmc0041~phi308707)调控叶面积、Bin2.02(umc1823~umc2363)调控ASI、Bin4.06(bnlg1621a~umc2027)同时调控穗位高和穗位比、Bin4.09(umc2287~umc2360)同时调控ASI和雄穗分枝数、Bin6.05(umc2040~bnlg1174a)调控ASI、Bin7.00(umc2177~umc1378)调控雄穗分枝数、Bin8.08(umc1005~umc2218)调控穗位比, Bin10.01~10.02(bnlg1451~umc1337)同时调控株高和穗位比的sQTLs位点(表4和表5)。
株高、穗位高、穗位比、叶面积、叶形系数、ASI和雄穗分枝数等不仅是影响玉米生产潜力的重要农艺性状, 而且其与玉米的生态适应性、抗倒性及耐密植能力紧密相关, 综合这些农艺性状优劣对玉米高产育种具有重要意义, 因此, 深入研究这些农艺性状的遗传机理已成为近年来学者专注的热点。首先是选择育种上具有代表性的优良种质材料组配杂交组合, 进而构建作图定位群体进行相应研究。昌7-2属于典型的四平头系种质, 其配合力高、综合农艺性状优良, 自育成以来用其已选育出了安玉五号、郑单958和济单8号等一系列国审优良玉米新品种, 为保障我国玉米安全生产中发挥了重要作用。廊黄与昌7-2的表型类似、亲缘关系较近, 其株型紧凑、花粉量大、果穗较小, 属于四平头系统[8, 20, 21, 23]。TS141为Reid系种质, 其植株高大、株型平展、早熟、果穗较大[8, 20, 21, 23]。基于以上考虑, 本研究选用了TS141为父本, 分别与昌7-2和廊黄为母本杂交, 组配了2套F2群体, 综合探讨了玉米7个农艺性状的杂种优势大小及分子遗传机理。
本研究杂种优势结果表明2个F1杂交种的株高、穗位高、叶面积、叶形系数和雄穗分枝数呈明显的正向超亲优势, 其值显著大于高值亲本, 而穗位比和ASI表现为明显的中亲优势, 其值介于双亲之间, 且趋向于低值亲本。2个F1杂交种的F1杂种优势指数和相对杂种优势在7个性状间表现一致均为: 株高> 穗位高> 雄穗分枝数> 叶面积> 叶形系数> ASI> 穗位比, 而F1自交后, 其F2群体7个性状的杂种优势明显衰退, 其F2优势降低率表现为: 叶面积> 株高> 穗位高> 雄穗分枝数> ASI> 叶形系数> 穗位比。这与司书丽等[34]、魏锋等[35]、Dong等[3]的研究结果相一致。司书丽等[34]采用80个杂交组配及其亲本研究揭示株高、穗位高、穗位比、叶面积、叶形系数和雄穗分枝数等与母本的相关性较大, 而与父本的相关性较小; 另外, F1杂种优势较大的株高、叶面积等性状的亲子相关表现不受杂种优势大小的影响。魏锋等[35]以16个自交系及其组配的8个F1杂交种为试材, 相关研究表明F1杂交种的株高、穗位高、穗位比、雄穗分枝数和叶面积等性状与母本均呈显著正相关, 而其与父本的相关系数均未达到显著水平; F1杂交种的株高、穗位高、雄穗分枝数和叶面积在F1代杂种优势较大, 其超亲优势和中亲优势均较高, 而穗位比仅表现为较弱的中亲优势。Dong等[3]在3个生态环境下对相关性状研究表明玉米F1杂交种的株高、穗位高、叶面积和雄穗分枝数表现为正向超亲优势, 其值分别为22.8%、15.8%、46.6%和21.9%, 而穗位比表现为中亲优势, 且趋于低值亲本, 其值为-3.1%; 另外, 这5个农艺性状的F1杂种优势指数和相对杂种优势表现一致均为: 株高> 穗位高> 雄穗分枝数> 叶面积> 穗位比。因此, 要选育具有优良特性的玉米新品种时需要注重基础材料的选择, 同时还需注意对母本、中亲和高亲的选择, 还需兼顾杂种优势及其优势的衰退, 进而提高育种选择效率, 最终获得高产、适应性广及密植性高的玉米新品种。
本研究相关性分析表明, 除个别农艺性状间的相关系数未达到显著水平外, 其余农艺性状间的相关系数均较大, 彼此间呈显著的正或负相关; 单穗重与ASI呈显著负相关外, 其与其余6个农艺性状间均呈显著正相关, 彼此间的相关系数依次为: 穗位高> 株高> ASI> 穗位比> 叶面积> 雄穗分枝数> 叶形系数。说明玉米的形态建成是各农艺性状间协同作用的结果, 且其显著影响玉米产量的形成, 因此在提高玉米产量时应均衡协调各农艺性状, 尤其是协调穗位高与叶形系数间的关系。这与王雅萍[36]和Fu等[27]的结果一致。另外, 本研究还利用亲本、F1杂交种及F2群体的原始数据构建了单穗重与7个农艺性状间的最优多元线性回归方程, 雄穗分枝数未进入此方程, 其能够直观地反映单穗重与其余6个农艺性状间的回归关系, 并与相关分析结果基本一致。
本研究对2套F2群体QTLs定位及位点效应分析结果表明, 在2套F2群体间总共检测到了56个QTLs位点, 其分布于玉米的10个连锁群体中, 单个QTL的表型贡献率介于4.22%~15.74%。这些QTLs位点中, 株高、穗位比、ASI和雄穗分枝数均受加性和非加性效应的调控, 而穗位高、叶面积和叶形系数均受非加性效应的调控。Zhang等[9]、张志明等[37]、Fu等[27]、李贤唐等[12]、Wei等[38]和Zhao等[8]对这7个农艺性状QTLs效应分析后同样得到了类似的结果。因此, 在改良玉米的株高、穗位比、ASI和雄穗分枝数时需要考虑加性效应、非加性效应、一般配合力和特殊配合力等的影响, 而在改良穗位高、叶面积和叶形系数时要特别注意非加性效应和特殊配合力。Tuberosa等[33]认为由于不同性状间存在共同的遗传机制, 因此“ 一因多效” 或是控制不同性状的基因普遍呈紧密连锁的现象。本研究在2套F2群体间总共检测到了8个“ 一因多效” QTLs位点, 其分别位于Bin1.00~1.01、Bin2.02、Bin4.06、Bin4.09、Bin5.06~5.07、Bin6.05、Bin8.05和Bin10.01~10.02区间, 这与相关分析的结果一致, 说明玉米染色体的这8个Bin区间共同调控着玉米多个农艺性状的遗传。
大量研究已经证明, 不同遗传背景及生态环境下调控玉米同一性状的QTLs位点可能存在差异。而利用多定位群体能够挖掘出不同遗传背景下稳定表达的sQTLs, 其可为QTL的精细位点、发现QTG及克隆候选基因提供有益信息。因此, 本研究以TS141为共同父本, 与廊黄、昌7-2杂交, 分别构建了2套F2定位群体(LTpop和CTpop), 经QTLs定位后总共挖掘到了12个sQTLs位点。其中11个sQTLs位点与前人研究结果一致, 如位于umc1278~bnlg1025(Bin1.07)区间存在1个调控株高的sQTL位点, 在LTpop和CTpop群体间的累积表型贡献率为16.80%, 基因作用方式均为部分显性。Tang等[39]在Bin1.07的umc2151~bnlg1556区间也检测到了1个调控株高的主效QTL, 可以解释表型贡献的24.53%; Melchinger等[40]和Lubberstedt等[41]同样在Bin1.07的umc23a~umc58区间也检测到了多个调控株高的QTLs位点。另外, 利用图位克隆已在此区间获得了一个调控玉米株高的关键基因D8[39]。位于mmc0041~phi308707(Bin1.08~1.10)区间同时存在1个调控叶面积的sQTL位点, 累积表型贡献率为14.11%, 基因作用方式均为显性效应。低氮处理下, 在Bin1.07~1.08的umc1245~umc2029区间, Cai等[14]检测到了1个调控叶面积的主效QTL, 基因的表型贡献率为10.2%。Tang等[39]在Bin1.09的bnlg1643~bnlg1597区间检测到了1个调控叶片数的QTL, 表型贡献率为6.54%。许诚等[17]在Bin1.08的umc1013~dupssr12~umc2047区间检测到了1个调控玉米叶面积的QTL位点, 表型贡献率为9.27%。另外, 在此Bin1.08~1.10区间存在一个调控玉米叶发育的关键调控基因Kn1-DL[42]。位于umc1823~umc2363(Bin2.02)区间存在1个调控ASI的sQTL位点, 累积表型贡献率为17.18%, 基因作用方式均为超显性。在干旱和正常灌水条件下, 在Bin2.02处的umc1518附近, 张吉民等[43]同时定位到了1个吐丝期、1个散粉期及1个ASI的QTL位点, 3个QTLs的基因作用方式均为超显性, 其分别可解释表型贡献的8.1%、11.1%和8.8%。位于bnlg1621a~umc2027(Bin4.06)区间同时存在1个调控穗位高和穗位比的sQTL位点, 累积表型贡献率分别为16.04%和14.13%, 基因作用方式以部分显性效应为主。杨晓军等[2]同样在bnlg1621附近检测到了1个调控穗位高的QTL位点, 表型贡献率为3.01%, 基因作用方式为加性效应。Nikolic等[13]和许诚等[17]在相同区域同样检测到了多个调控株高的QTLs位点。位于umc2040~bnlg1174a(Bin4.09)区间同时存在1个调控ASI和雄穗分枝数的sQTL位点, 累积表型贡献率分别为20.68%和15.56%, 在2个性状间基因作用方式分别为显性和部分显性效应。Zhao等[8]利用meta-QTL分析在Bin4.09的umc2287~umc1101区间挖掘到了1个调控雄穗分枝数的meta-QTL位点, 进一步分析确定了1个调控玉米雄穗发育的候选基因ZAG3。位于umc2177~umc1378(Bin7.00)区间存在1个调控雄穗分枝数的sQTL位点, 累积表型贡献率为27.23%, 基因作用方式均为超显性效应。在正常供水和干旱胁迫处理下, Zhao等[8]同样在umc2177~umc1378区间检测到了6个调控雄穗分枝数的QTLs位点, 累积表型贡献率为80.20%, 基因作用方式均为超显性效应, 并在此区间预测到了1个调控玉米雄穗发育的关键基因MADS3。位于umc1005~umc2218(Bin8.08)区间存在1个调控穗位比的sQTL位点, 累积表型贡献率为20.01%, 基因作用方式均为加性效应。李贤唐等[12]在Bin8.07~8.08的umc1384~phi015区间也检测到了1个调控穗位比的QTL位点, 可解释表型变异的2.63%。位于bnlg451~umc337(Bin10.01~10.02)区间同时存在1个调控株高和穗位比的sQTL位点, 累积表型贡献率分别为20.46%和15.07%, 2个性状间基因作用方式均为显性效应。杨晓军等[2]也在bnlg1451~phi059区间检测到了1个调控株高的QTL位点, 表型贡献率为4.86%。说明Bin1.07、Bin1.08~1.10、Bin2.02、Bin4.06、Bin4.09、Bin7.00、Bin8.08和Bin10.01~10.02区域是调控玉米株高、穗位高、穗位比、叶面积、ASI和雄穗分枝数等农艺性状的重要sQTLs位点, 且这些稳定表达的sQTLs位点可为今后玉米相关农艺性状改良的候选染色体区段, 用于图位克隆及MAS选择育种。另外, 本研究还检测到了1个新的sQTL位点, 位于umc2040~bnlg1174a(Bin6.05)区间调控ASI, 累积表型贡献率为26.87%, 基因作用方式均为加性效应, 因此该位点可为玉米ASI遗传机理剖析提供新信息。
研究结果表明, 玉米的株高、穗位高、叶面积、叶形系数和雄穗分枝数呈明显的正向超亲优势, 而穗位比和ASI表现为明显的中亲优势; 7个农艺性状的F1杂种优势指数和相对杂种优势表现一致均为株高> 穗位高> 雄穗分枝数> 叶面积> 叶形系数> ASI> 穗位比, 而F2优势降低率表现为叶面积> 株高> 穗位高> 雄穗分枝数> ASI> 叶形系数> 穗位比。7个农艺性状与单穗重显著相关, 并利用逐步回归分析成功构建了单穗重与6个农艺性状间(除雄穗分枝数)的最优多元线性回归方程。7个农艺性状在2套F2群体间总共检测到了56个QTLs位点, 其中株高、穗位比、ASI和雄穗分枝数均受加性和非加性效应的调控, 而穗位高、叶面积和叶形系数只受非加性效应的调控; 进一步分析, 在2套F2群体中总共检测到了12个稳定表达的sQTLs位点。这些研究结果可为玉米相关农艺性状的遗传改良、育种应用、QTL精细定位及基因克隆提供参考。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|




