作者简介:王晓梅(1993-),女,山东烟台人,在读博士。E-mail: 2550691573@qq.com
匍枝筋骨草悬浮细胞中含有较高β-蜕皮甾酮,为了进一步提高其β-蜕皮甾酮含量,通过添加茉莉酸甲酯(MeJA)进行一系列试验研究。以4~10代筋骨草悬浮细胞为试验材料,测定不同处理浓度和处理时间的MeJA对细胞生长、β-蜕皮甾酮积累的影响,细胞生长量采用称量计数,β-蜕皮甾酮含量则使用高效液相进行检测。结果表明:匍枝筋骨草悬浮细胞生长曲线及β-蜕皮甾酮积累曲线符合Logistics模型。在细胞快速生长的初始期(第4天)或中期(第7天)添加不同浓度的MeJA,对细胞生长影响相对较小,生长曲线均有小高峰,分别出现在处理后第5天和第3天,干物质积累量分别达到0.60和0.62 g。而在细胞快速生长的高峰期添加MeJA,细胞生长曲线呈下降趋势,细胞鲜重和干重显著低于CK( P<0.05)。在细胞快速生长的初始期或中期添加MeJA后细胞鲜重与β-蜕皮甾酮积累量呈显著相关。在细胞快速生长的初始期或中期添加10~50 μmol·L-1 MeJA后,细胞鲜重与CK对比表现为显著增加,其中添加50 μmol·L-1 MeJA后细胞鲜重最佳,最高可达到35.90 g,显著高于其他处理( P<0.05)。而同样条件下β-蜕皮甾酮表现为积累量小幅增加,最高量为0.5095 mg·g-1。添加100~200 μmol·L-1 MeJA均会抑制细胞的生长,其中添加200 μmol·L-1 MeJA细胞鲜重与CK相比显著下降,抑制率最高可达到38.88%。而添加100~200 μmol·L-1 MeJA后β-蜕皮甾酮积累量表现为大幅提升,最高可达3.5315 mg·g-1,为同期CK的14.44倍( P<0.01)。在细胞快速生长的高峰期添加10~200 μmol·L-1 MeJA后,细胞鲜重与CK相比都表现为下降,说明在此时添加这些浓度MeJA可抑制细胞的生长,最高抑制率可达31.01%。而在细胞快速生长的高峰期添加10~50 μmol·L-1 MeJA后,β-蜕皮甾酮积累量可在短时间内大量激增,β-蜕皮甾酮积累量最高达到1.4136 mg·g-1,是CK的5.06倍( P<0.01)。添加100~200 μmol·L-1 MeJA则积累量较少。在细胞快速生长的中期添加100 μmol·L-1 MeJA条件下对细胞的刺激较小,β-蜕皮甾酮积累量最高,达到3.5315 mg·g-1。
High β-ecdysterone (β-EC) levels were contained in a cell suspension of Ajuga lobata. In order to further improve β-EC content, jasmonic acid methylester was added. The effects of adding jasmonic acid methylester was based on 4-10 generations of cell suspension of A. lobata and the influence of different MeJA concentrations and adding times on cell growth and β-EC accumulation was assessed. For β-EC content, high performance liquid chromatography (HPLC) was utilised. Results showed that the growth curve of the cell suspension and accumulative line of β-EC followed the Logistics model. Adding different concentrations of MeJA in the early (the 4th day of culture) or middle stages (the 7th day of culture) of the rapid cell growth period did not greatly affect cell growth; the growth curves were similar and each produced a peak. Adding MeJA on the 4th day and 7th day of culture resulted in peaks mostly occurring on the 5th and 3rd day after MeJA addition respectively. Dry weights of the cell suspension reached 0.60 g and 0.62 g respectively. Adding different concentrations of MeJA at the peak (the 10th day of culture) of rapid cell growth, resulted in a decline in growth in all cell cultures. The growth of suspended cells was significantly reduced by adding MeJA. Fresh and dry weights were usually significantly lower than that in the control group ( P<0.05). The cell fresh weights were significantly correlated with β-EC contents after adding MeJA into the culture system during the early or middle stages of rapid cell growth. After adding 10-50 μmol·L-1 MeJA cell fresh weights increased significantly compared with that of the control. Adding 50 μmol·L-1 MeJA achieved the highest cell fresh weight (35.90 g), significantly higher than other treatments ( P<0.05). Similarly β-EC content (0.5095 mg·g-1) was also highest with 50 μmol·L-1 MeJA. Adding 200 μmol·L-1 MeJA, significantly reduced cell fresh weights compared with the control (38.88% reduction). After adding 100-200 μmol·L-1 MeJA β-EC content was greatly increased, reaching 3.5315 mg·g-1, 14.44 times the control treatment( P<0.01). At the peak of rapid cell growth (10th day of culture), adding 10-200 μmol·L-1MeJA, reduced cell fresh weights compared with that of the control. The results illustrated that adding MeJA during cell growth could inhibit cell growth. Adding 10-50 μmol·L-1 MeJA at the peak of rapid cell growth resulted in a massive surge in β-EC content shortly after adding, the highest level being 1.4136 mg·g-1, 5.06 times the control ( P<0.01). When the MeJA concentration reached 100-200 μmol·L-1, the accumulation of β-EC was significantly reduced. We concluded that cell growth was mildly stimulated by adding 100 μmol·L-1 MeJA treatment in the middle stage of cell rapid growth period with β-EC content reaching 3.5315 mg·g-1.
蜕皮激素(ecdysone)是一类调节昆虫蜕皮、变态, 影响昆虫发育的内源激素, 最早由生物学家Polish于1919年提出[1]。1954年, 科学家们首次从50多万头家蚕(Bombyx mori)蛹中成功分离出α -蜕皮激素[2], 并确定了α 、β -蜕皮激素的甾体结构[1]。研究发现, 这些甾体化合物多在昆虫幼期的前胸腺产生, 在成虫期转由性腺分泌。蜕皮激素是以胆固醇作为骨架来合成的。但昆虫本身并不能合成胆固醇, 而是直接或间接地从植物中得到。所以, 昆虫在幼虫期间需要不断进行取食植物来获取蜕皮激素的前体物质[3]。
研究发现, 在自然界中有300多种植物中都含有类似于昆虫蜕皮激素的次生代谢物。这些次生代谢物被统称为植物蜕皮甾醇(phytoecdysteroid)。含植物蜕皮甾醇的植物中, 鸭跖草科、马鞭草科、唇形科、菊科、苋科、天南星科和罗汉松科的植物居多[4, 5, 6, 7]。而植物中植物蜕皮甾醇含量往往远高于昆虫体内蜕皮激素的含量[4]。为此, 很多学者致力于植物蜕皮甾醇的种类鉴定、提取工艺、功能等方面的研究[8, 9]。
匍枝筋骨草(Ajuga lobata)为唇形科(Lamiaceae)筋骨草属(Ajuga)植物, 主要生长在路边、溪边、山地丘陵等阴凉湿润之地, 具有抗菌消炎、清热解毒、化痰止咳等作用。匍枝筋骨草全株均含有植物蜕皮甾醇(phytoecdysteroid)中的一种主要成分, 即β -蜕皮甾酮(β -ecdysterone, β -EC), 也被称为20-羟基蜕皮激素(20-hydroxyecdysone)或β -蜕皮激素(β -ecdysone)[10, 11], 且含量较高, 约为全株重量的0.1%。陈小霞等[12]对3种筋骨草属植物进行分析发现金疮小草(Ajuga decumbens)中所含β -EC高达4.4976 mg· g-1; 而邱志国等[11]对筋骨草蜕皮激素类物质的分析发现线叶筋骨草中β -EC含量可达414 μ g· g-1; 黎昕等[13]发现在培养基中添加1 mg· L-1 6-BA可促使筋骨草细胞内β -EC含量, 达0.2092 g· L-1; 钱晶晶等[14]发现匍枝筋骨草悬浮细胞中β -EC含量可达0.246 g· L-1。
茉莉酸甲酯(jasmonic acid methyl ester, MeJA)是从素馨花(Jasminum grandiflorum)精油中分离出来的一种挥发性物质[15], 对植物有着广泛的生理作用[16]。它可以抑制植物生长, 增加植物的抗性, 提高胁迫能力。同时, 它作为诱导子, 可以参与膜间内源信号的转导, 还可间接诱导产生大量次生代谢物质[17, 18], 具有类似于ABA的作用[17]。
本实验建立了匍枝筋骨草生长模型及β -EC积累模型, 通过在匍枝筋骨草悬浮细胞中添加MeJA, 研究对其生长状况、β -EC积累的相关影响。旨在促进提高β -EC产量, 为工业化生产β -EC奠定技术基础。
本试验在2016年5月在室内进行, 于2017年3月完成试验。根据赵晓杰等[19]建立的匍枝筋骨草体系, 选取继代4~10代的悬浮细胞为实验材料。细胞室培养条件:温度(23± 2) ℃, 光周期16 h光照/8 h黑暗, 湿度50%~60%, 光照强度2000 lx, 摇床转速120~130 r· min-1。
1.2.1 生物量的测定 在无菌条件下, 取4~10代悬浮细胞5 g, 加入至50 mL的悬浮培养液中(接种量10%), 在摇床上分别培养4, 7, 10 d后添加不同浓度的诱导子茉莉酸甲酯, 每天取样观察细胞生长状况, 每处理重复3次, 处理的细胞液过300目细胞筛(孔径为48 μ m), 挤压吸干水分, 称其重量即得鲜重。鲜细胞在60 ℃的条件下烘干至恒重, 即得干重。
1.2.2 诱导子MeJA配置 取1 mL的MeJA标准品(95%, sigma公司)溶于50%的无水乙醇中, 定容至50 mL, 即得MeJA母液。经0.22 μ m的滤膜过滤后, 向50 mL的培养液中分别添加6、29、57、86、115 μ L的茉莉酸甲酯母液, 使培养液中诱导子茉莉酸甲酯的最终质量浓度分别为10、50、100、150和200 μ mol· L-1。在对照组的培养瓶中亦加入对应体积的50%乙醇。
1.2.3 样品的制备 所得干细胞在研钵中加入液氮, 在低温条件下研磨成粉, 取0.1 g干品粉末溶于2 mL甲醇中, 在暗条件下浸提24 h, 超声振荡1 h, 微波消解10 min(消解温度:50 ℃, 功率:300 W× 2, 压强:当前压力的两倍), 静置取上清液, 用0.45 μ m的有机滤膜过滤, 即得测定液。
用HPLC Waters 2695检测β -EC含量。检测条件:进样量10 μ L, 流速0.6 mL· min-1, Waters 2996 PDA检测器(波长范围:190~800 nm), 流动相(甲醇:水=1:1), 检测波长254 nm, 柱温:25 ℃。色谱柱型号:C18(4.6× 250 mm, 5 μ m 粒度)。
1.4.1 蜕皮激素标准曲线的制作 取蜕皮激素标准样品8 mg溶于10 mL色谱纯甲醇中, 即得0.8 g· L-1 β -EC的标准液。再依次分别配置浓度梯度为0.4、0.2、0.1、0.05 g· L-1的蜕皮激素标准液, 分别进样10 μ L, 重复进样3次, 制作β -EC线性回归方程:y=3× 107x-451985, R2=0.9993。
1.4.2 精密度试验 取3个不同浓度梯度的标准液, 分别进样10 μ L, 重复进样5次, 记录峰面积, 测得3个处理峰面积分别是5720135、11483655、23242561, 计算测得相对标准偏差(RSD)=0.94%。
1.4.3 重复性试验 取3个处理的匍枝筋骨草粉末, 每个处理称取5份, 分别提取, 进样, 记录峰面积, 测得3个峰面积分别是26885、1921143、2159040, 计算测得RSD=1.05%。
1.4.4 稳定性试验 取3个处理已制备的待测液, 分别在0、4、8、12、24 h进样测定, 记录峰面积, 测得3个峰面积分别是2149598、2100529、3284488, 计算测得RSD=0.96%。
1.4.5 加样回收率试验 取3个处理的待测液, 分别添加标准液, 每个处理按照其所含β -EC浓度的80%、100%、120%设置3个浓度梯度, 重复进样6次, 记录峰面积, 测得3个峰面积分别是1333620、2527232、2167941, 测得平均加样回收率(P)=97.26%, 平均RSD=1.38%。
采用Excel 2003进行图表的制作, 采用SPSS 17.0进行数据单因素方差分析, 多重比较采用邓肯极差检验法(SSR法), 显著性水平F=0.05。相关性分析采用Pearson法进行简单相关分析。生长模型采用Logistic, 利用Origin 8进行曲线的拟合度和相关参数的计算。
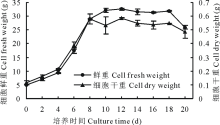
2.1.1 细胞生长曲线 取悬浮细胞5 g加入50 mL的培养体系中, 培养周期20 d。根据图1细胞生长曲线得知, 细胞鲜重曲线呈现Logistic型增长趋势, 分为4个生长期。0~4 d为细胞生长的迟滞期。此期细胞生长缓慢, 增殖倍数在37%~85%之间。4~10 d为细胞生长的快速增殖期。此期细胞呈对数生长, 细胞生长快速。其中第4天为细胞对数生长的初始期, 第10天达到细胞生长的高峰期, 鲜重达到32.12 g, 增殖倍数达到351%。10~18 d为细胞生长的平缓期, 此期细胞保持在一个稳定的水平上, 鲜重在31.29~32.72 g。18~20 d进入细胞生长的衰落期, 此期细胞生长量逐渐减低, 细胞开始褐化, 逐渐老化死亡。细胞干重曲线与细胞鲜重曲线趋势相似, 4 d细胞干重为0.22 g, 8 d进入干物质积累高峰期, 细胞干重达到0.58 g, 于18 d开始死亡。
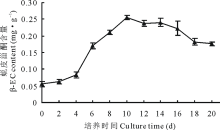
2.1.2 细胞内β -蜕皮甾酮动态积累曲线 从图2看出, β -蜕皮甾酮(β -EC)积累曲线属于与生长偶联型的次生代谢模型, 且呈线性正相关。在生长期第4天进入β -EC快速积累期, 第10天达到合成的高峰期, 细胞中β -EC含量达到0.25 mg· g-1, 10~16 d期间β -EC含量略有降低, 但降低的速度缓慢, 16 d后积累量迅速下降。
2.1.3 细胞生长和β -蜕皮甾酮积累曲线的模型拟合 以细胞培养天数(d)为自变量(x), 分别以细胞鲜重(g)、细胞干重(g)、β -EC合成量(mg· g-1)为因变量(y), 建立生长模型。从表1得知, 鲜重、干重、β -EC含量生长模型都为Logistic, 说明三者的变化规律相对同步, 拟合曲线基本一致。其中, 细胞鲜重、干重生长曲线决定系数达到0.95, 拟合程度较好。而β -EC积累曲线拟合模型的决定系数为0.86。
| 表1 细胞生长和β -蜕皮甾酮积累曲线的模型拟合 Table 1 The fitting analysis of cell growth and β -ecdysterone accumulation model |
2.2.1 细胞鲜重的变化 根据表2得知, 在培养了4 d的悬浮细胞培养体系中, 添加了10、50、100、150、200 μ mol· L-1 MeJA。 在处理后的第1天, 除添加100 μ mol· L-1浓度的MeJA外, 其他处理悬浮细胞鲜重与CK差异显著(P< 0.01)。在处理后的第3、5、7、10天, 各处理则均与CK差异显著(P< 0.05)。而在经MeJA处理后的5个观测时间点内, 各浓度处理组间均差异显著(P< 0.05)。其中, 添加10、50 μ mol· L-1浓度下, 处理组悬浮细胞鲜重均高于CK, 100、150、200 μ mol· L-1浓度下细胞鲜重与CK相比表现抑制作用。在各个添加浓度中, 50 μ mol· L-1浓度下细胞鲜重增加值相对较高, 在处理后的5个观测时间点内, 细胞鲜重分别达到了11.68、25.21、33.76、35.10和32.20 g, 细胞鲜重分别比同期CK增加了18.42%、33.15%、16.25%、12.16%和10.59%。而200 μ mol· L-1浓度下细胞鲜重降低最显著, 在处理后的5个观测时间点内, 细胞鲜重分别比同期CK下降了38.88%、32.86%、31.58%、26.35%和27.63%。
| 表2 在悬浮细胞生长的不同时间添加不同浓度的茉莉酸甲酯对筋骨草生物量的影响 Table 2 The influence on A. lobata suspension cell biomass after adding different concentration of MeJA at different culture time |
在培养了7 d的悬浮细胞培养体系中添加MeJA后细胞鲜重变化规律与培养了4 d的相似。在处理后1、3、5、7、10 d, 各浓度处理组细胞鲜重均与CK差异显著(P< 0.01), 且各浓度处理组间差异均显著(P< 0.01)。其中, 10、50 μ mol· L-1浓度下细胞鲜重均高于CK, 表现促进作用。100、150、200 μ mol· L-1浓度下细胞鲜重明显低于CK, 表现抑制作用。在各个浓度处理组中, 50 μ mol· L-1浓度下细胞鲜重增加最为显著, 表现最佳, 在处理后的5个时间点内鲜重分别达到27.20、35.90、33.89、31.34、29.26 g, 与同期CK相比分别增重9.21%、18.17%、9.34%、7.61%、8.17%。而200 μ mol· L-1浓度下细胞鲜重则降低较显著, 与同期CK相比分别下降35.56%、27.10%、21.57%、17.16%、14.85%。
在培养了10 d的悬浮细胞培养体系中添加不同浓度的MeJA, 处理后第1、3、5、7、10天, 各浓度处理组细胞鲜重均与CK差异显著(P< 0.05)。处理后第1、3天, 各浓度处理组间差异均显著(P< 0.05)。而处理后第5天, 除100与150 μ mol· L-1外, 其他浓度处理组间差异均显著(P< 0.05)。处理后第7天, 除10与50 μ mol· L-1、150与200 μ mol· L-1外, 其他浓度处理组间差异均显著(P< 0.05)。处理后第10天, 各处理组间差异均不显著(P> 0.05)。其中, 处理后第1天, 除添加10 μ mol· L-1浓度的MeJA外, 其他浓度处理悬浮细胞鲜重均显著低于CK。在处理后的第3、5、7、10天, 各浓度处理组均明显低于CK。在添加的各个浓度处理组中, 只有处理后第1天的10 μ mol· L-1浓度下细胞鲜重有所增加, 与同期CK相比仅增重2.85%。在处理后的第1、3、5、7天, 200 μ mol· L-1浓度下细胞鲜重均显著降低, 细胞鲜重分别比同期CK下降了23.65%、31.01%、29.93%、24.67%。
结果表明细胞的诱导子因MeJA添加周期、浓度的不同而发生变化, 同时还与处理时间的长短有密切关系。随着处理时间的延长, 细胞逐渐衰老死亡。同时, 诱导子MeJA浓度的增大会加速细胞的衰老。此外, 在细胞快速生长的高峰期添加MeJA可促进细胞快速衰老, 而在细胞快速生长期的初始期、中期添加MeJA后, 细胞的衰老速度则相对较缓。
2.2.2 不同添加时间对细胞干重的影响 从图3可看出, 在培养了4 d的悬浮体系中添加的MeJA后, 各处理组细胞干重不同。添加10 μ mol· L-1后细胞干重曲线与CK曲线有一定程度的交叉重合, 最大差值仅为0.026 g, 差异不显著(P> 0.05)。添加50 μ mol· L-1的MeJA后, 细胞干重曲线在前期(添加后2~5 d)显著高于CK曲线, 最大差值达到0.203 g(P< 0.05)。添加100 μ mol· L-1的MeJA后, 其细胞干重曲线与CK曲线相比差异不显著(P> 0.05), 表现轻微下降的趋势。添加200 μ mol· L-1后细胞干重曲线则表现完全抑制作用(P< 0.05)。同时还发现, 各个细胞干重曲线均有一个小高峰。其中50 μ mol· L-1细胞干重曲线在处理后5 d达到生长高峰, 干物质积累达到0.60 g, 显著优于其他各处理(P< 0.05)。
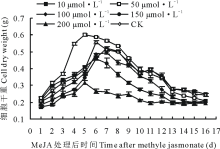 | 图3 在第4天向悬浮培养体系中添加MeJA对细胞干重的影响Fig.3 The effect on cell dry weight after adding MeJA into suspension culture system at the 4th days |
从图4看出, 在培养了7 d的细胞悬浮培养体系中添加MeJA后, 其细胞干重曲线与在培养了4 d的体系中添加MeJA后获得的细胞干重曲线有相似之处。其中添加50 μ mol· L-1细胞干重曲线在前期(添加后1~9 d)显著高于CK曲线(P< 0.05), 其高峰期出现在处理后的第3天, 细胞干重达到0.62 g。而添加了200 μ mol· L-1MeJA后的细胞干重曲线显著低于CK曲线(P> 0.05)。
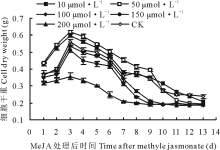 | 图4 在第7天向悬浮培养体系中添加MeJA对细胞干重的影响Fig.4 The effect on cell dry weight after adding MeJA into suspension culture system at the 7th days |
从图5可看出, 与CK细胞干重曲线相比, 在培养了10 d的悬浮培养体系中, 加入各浓度的MeJA后, 各处理组细胞干重曲线整体呈现下降趋势, 其与CK曲线最大差值达到0.216 g, 显著低于CK曲线(P> 0.05)。
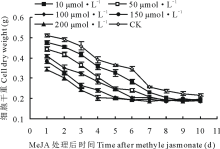 | 图5 在第10天向悬浮培养体系中添加MeJA对细胞干重的影响Fig.5 The effect on cell dry weight after adding MeJA into suspension culture system at the 10th days |
综合分析图3、4、5的试验结果发现, 细胞生长的不同周期添加MeJA后其细胞干重曲线有所不同。在细胞快速生长的初始期及中期添加MeJA, 低浓度可促进细胞的生长。而高峰期后添加MeJA会加速细胞的老化, 对细胞的生长起抑制作用。
2.2.3 β -蜕皮甾酮积累量的变化 根据表3得知, 在培养了4 d的悬浮细胞培养体系中添加了10、50、100、150、200 μ mol· L-1的MeJA。处理后第1、3、5、7、10天, 各浓度处理组β -蜕皮甾酮(β -EC)积累量均与CK差异显著(P< 0.05)。在观测的5个时间点内, 处理后第1、5、10天, 各浓度处理组间β -EC积累量差异显著(P< 0.05)。而在处理后第3天, 50与200 μ mol· L-1浓度处理组间积累量差异不显著(P> 0.05), 其他浓度处理组间则差异显著(P< 0.05)。在处理后第7天, 10、50、100、150 μ mol· L-1浓度组间β -EC积累量差异显著(P< 0.05), 10与200 μ mol· L-1浓度组间β -EC积累量则差异不显著(P> 0.05)。结果发现, 随着MeJA浓度的增大, β -EC积累量呈先升后降趋势。在各浓度处理组中, 100 μ mol· L-1浓度下β -EC积累量表现最佳, 在处理后的5个时间观测点内积累量分别达到1.5465、2.7766、0.7544、0.4735、0.2808 mg· g-1, 分别为同期CK的15.84、20.77、2.48、0.80、0.13倍。而在处理后第1、3、5天, 10 μ mol· L-1浓度下β -EC积累量显著降低, 分别为同期CK的0.80、0.58、0.23倍。在处理后第7、10天, 200 μ mol· L-1浓度下β -EC积累量最低, 分别为同期CK的0.17和0.01倍。
在培养了7 d的悬浮细胞培养体系中添加了不同浓度的MeJA处理后的5个时间观测点内, 各浓度处理组β -EC积累量均与CK相比差异显著(P< 0.05)。在处理后第3天, 除200与10 μ mol· L-1浓度组间积累量则差异不显著(P> 0.05)外, 其他浓度处理组间差异显著(P< 0.05)。而在处理后第1、5、7、10天, 各浓度处理组间均差异显著(P< 0.05)。随着处理浓度组依次增大, β -EC积累量表现先升后降。在处理后第1天, 150 μ mol· L-1浓度下β -EC积累量最佳, 为1.4986 mg· g-1, 增长率为同期CK的10.40倍。而在之后第3、5、7、10天, 100 μ mol· L-1浓度下β -EC积累量显著提高, 分别达到0.5541、1.2164、3.5315、0.6901 mg· g-1, 增长率分别为同期CK的1.38、3.52、14.44、3.15倍。在各个添加浓度中, 在处理后的第1、3天, 10 μ mol· L-1浓度下β -EC积累量较低, 为0.3455、0.3662 mg· g-1, 增长率分别为同期CK的1.62、0.98倍。而在处理的第5、7、10天, 200 μ mol· L-1浓度下β -EC积累量相对较低, 分别为0.2626、0.2165、0.1560 mg· g-1, 增长率分别比同期CK下降了2.2749%、5.3261%、6.1449%。
| 表3 在悬浮细胞生长的不同时间添加不同浓度的茉莉酸甲酯对筋骨草β -蜕皮甾酮含量的影响 Table 3 The influence on A. lobata β -EC content after adding different concentration of MeJA at different culture time |
在培养了10 d的悬浮细胞培养体系中添加了不同浓度的MeJA, 处理后第1天, 各浓度处理组β -EC积累量均与CK差异显著(P< 0.05), 各处理组间β -EC积累量均差异显著(P< 0.05)。此期50 μ mol· L-1浓度下β -EC积累量最佳, 为0.6797 mg· g-1, β -EC增长率为同期CK的1.75倍。200 μ mol· L-1浓度下β -EC积累量较低, 为0.2324 mg· g-1, 比同期CK下降了5.8663%。处理后第3天, 除了150 μ mol· L-1浓度处理组外, 其他浓度处理组间β -EC积累量与CK相比均差异显著(P< 0.05)。而各浓度处理组间β -EC积累量均差异显著(P< 0.05)。其中, 10 μ mol· L-1浓度下积累量达到1.4136 mg· g-1, 增长率为同期CK的5.06倍。200 μ mol· L-1浓度下积累量为0.1576 mg· g-1, 比同期CK下降了32.3294%。处理后第5天, 除了100 μ mol· L-1浓度处理组外, 10、50 μ mol· L-1浓度下β -EC积累量与CK差异显著(P< 0.05)。150、200 μ mol· L-1浓度下则未检测到β -EC。10、50、100 μ mol· L-1浓度组间β -EC积累量均差异显著。其中, 10 μ mol· L-1浓度下积累量为0.8534 mg· g-1, 增长率为同期CK的3.38倍。100 μ mol· L-1浓度下积累量为0.1884 mg· g-1, 比同期CK下降了3.2129%。处理后第7、10天, 除CK外, 各浓度处理组均未检测到β -EC。
综合分析发现, β -EC的积累量与诱导子MeJA的添加时间、处理时长以及处理浓度有直接关系。在细胞快速生长的初始期(第4天)添加MeJA后对细胞相对刺激较小, 各处理与CK相比, β -EC积累量均有不同程度的提升, 表现逐渐上升的趋势。而在细胞的快速生长的中期添加(第7天)MeJA后, 细胞中β -EC积累量则有大幅提高, 在一定浓度下随着处理天数的增加, β -EC积累量缓慢升高, 而添加高浓度MeJA后, β -EC积累量表现为短时间内急速升高后下降。在细胞的快速生长的高峰期(第10天)添加MeJA后对细胞刺激较大, 添加低浓度的MeJA可在短时间内刺激产生大量的β -EC, 但是之后细胞渐渐衰老死亡, 添加高浓度MeJA后, β -EC积累量则较少。
2.2.4 β -蜕皮甾酮积累量与细胞干重相关性分析 以β -EC积累量为因变量, 细胞干重为自变量, 采用Pearson法分析MeJA的不同添加时期对β -EC积累量、细胞干重的相互影响。由表4可知, 在培养了4 d的悬浮细胞中添加了不同浓度的MeJA后, 各浓度处理组生长量与β -蜕皮甾酮(β -EC)含量都近似表现极显著相关。其中, 添加10、50 μ mol· L-1的MeJA后, 细胞生长量与β -EC含量呈现极显著正相关(P< 0.01), 相关系数分别达到0.918、0.929。添加150、200 μ mol· L-1的MeJA两者间亦表现正相关(P< 0.01), 而添加100 μ mol· L-1的MeJA则呈现负相关(P< 0.01)。此期细胞生长量与β -EC含量相关性从大到小依次为:50 μ mol· L-1> 10 μ mol· L-1> 200 μ mol· L-1> 150 μ mol· L-1> 100 μ mol· L-1。
| 表4 不同浓度MeJA处理下β -蜕皮甾酮含量与细胞生长量的相关分析 Table 4 Correlation coefficients between β -EC content and cell growth under different concentration of MeJA |
在培养了7 d的悬浮细胞中添加了不同浓度的MeJA后细胞生长量与β -EC含量相关性和培养了4 d的悬浮细胞的相关性基本一致, 其中添加50 μ mol· L-1的MeJA后细胞生长量与β -EC含量的相关性最高, 相关系数可达到0.920。不同的是, 添加100、150 μ mol· L-1的MeJA后细胞生长量与β -EC含量显著性不相关(P> 0.05)。此期细胞生长量与β -EC含量相关性从大到小依次为:50 μ mol· L-1> 10 μ mol· L-1> 200 μ mol· L-1> 150 μ mol· L-1> 100 μ mol· L-1。
在培养了10 d的悬浮细胞中添加了不同浓度的MeJA后, 添加10 μ mol· L-1的MeJA表现无显著相关(P> 0.05), 添加50、100、150、200 μ mol· L-1的MeJA则都呈现极显著正相关(P< 0.01), 相关系数分别为0.785、0.968、0.934、0.904。此期细胞生长量与β -EC含量相关性从大到小依次为:100 μ mol· L-1> 150 μ mol· L-1> 200 μ mol· L-1> 50 μ mol· L-1> 10 μ mol· L-1。
经结果分析表明细胞生长量与β -EC含量的相关性随着MeJA添加时间和浓度的不同而发生变化。在细胞快速生长期的初始期(第4天)添加低浓度MeJA后细胞生长量与β -EC含量的相关系数较大, 而添加高浓度MeJA后相关系数则逐渐减小或为负。在细胞快速生长的中期(第7天)添加MeJA后细胞生长量与β -EC含量相关性规律与细胞快速生长期的初始期(第4天)添加相似。低浓度相关系数较大, 高浓度相关系数则减小或为负。在细胞快速生长的高峰期(第10天)添加MeJA相关性规律与第4天或第7天的规律不一致。此时, 添加高浓度MeJA后细胞生长量与β -EC含量的相关系数较大, 添加低浓度MeJA则相关系数较小。
2.2.5 β -蜕皮甾酮总含量的变化 由表5可知, 向培养了4 d的悬浮细胞培养体系中添加了10、50、100、150、200 μ mol· L-1的MeJA, 除了处理后第3天的10、200 μ mol· L-1外, 其他处理组培养体系中所有细胞的β -EC总含量均与CK差异显著(P< 0.05)。处理后第1、5、7、10天, 各处理组β -EC总含量均与CK差异显著(P< 0.05)。处理后第1天, 除200与10、50 μ mol· L-1浓度组间差异不显著外(P> 0.05), 各样品处理组间β -EC总含量均差异显著(P< 0.05)。在各个浓度处理组中, 100 μ mol· L-1浓度下β -EC总含量为0.3145 mg, 表现最佳, 而10 μ mol· L-1浓度下总含量较低, 仅为0.0359 mg。处理后第3天, 除100与150 μ mol· L-1浓度处理组间β -EC总含量差异显著外(P< 0.05), 其他处理组间β -EC总含量差异不显著(P> 0.05)。在各个浓度处理组中, 100 μ mol· L-1浓度下β -EC总含量达到0.7868 mg, 200 μ mol· L-1浓度下β -EC总含量较低, 仅为0.0615 mg。处理后第5天, 除200、10 μ mol· L-1外, 其他处理组间β -EC总含量均差异显著(P< 0.05)。在各个浓度处理组中, 100 μ mol· L-1浓度下β -EC总含量较高, 但与处理后第3天相比有所下降, 为0.2816 mg。而10 μ mol· L-1浓度下β -EC总含量较低, 仅为0.1095 mg。处理后第7天, 除10、150 μ mol· L-1外, 其他处理组间β -EC总含量差异显著(P< 0.05)。随着处理时间的延长, 100 μ mol· L-1浓度下β -EC总含量较高, 但与处理后第5天相比呈降低趋势, 为0.2336 mg, 200 μ mol· L-1浓度下β -EC总含量仅为0.0813 mg。处理后第10天, 除10、100 μ mol· L-1外, 其他处理组间β -EC总含量差异显著(P< 0.05)。在5个浓度处理组中, 50 μ mol· L-1浓度下β -EC总含量较高, 为0.1077 mg。200 μ mol· L-1浓度下β -EC总含量较低, 仅为0.0535 mg。
| 表5 在悬浮细胞生长的不同时间添加不同浓度的茉莉酸甲酯对筋骨草样品内β -蜕皮甾酮总含量的影响 Table 5 The influence insampleson A. lobata β -EC totalcontent after adding different concentration of MeJA at different culture time |
在培养了7 d的悬浮细胞培养体系中添加了不同浓度的MeJA后第3天, 200 μ mol· L-1浓度的β -EC总含量与CK差异不显著(P> 0.05)。处理后第7天, 10、150、200 μ mol· L-1浓度的β -EC总含量与CK差异亦不显著(P> 0.05)。处理后第1、5、10天, 各浓度组内β -EC总含量与CK相比均差异显著(P< 0.05)。处理后第1天, 除50、150、200 μ mol· L-1浓度组间β -EC总含量差异显著外(P< 0.05), 其他浓度组间β -EC总含量差异不显著(P> 0.05)。在各个浓度处理组中, 150 μ mol· L-1浓度下β -EC总含量最高, 达到0.5244 mg, 10 μ mol· L-1浓度下β -EC总含量较低, 仅为0.1474 mg。处理后第3天, 除50与100 μ mol· L-1组间β -EC总含量差异不显著外(P> 0.05), 其他处理组间β -EC总含量均差异显著(P< 0.05)。在各个浓度处理组中, 100 μ mol· L-1浓度下β -EC总含量较高, 为0.2955 mg。而200 μ mol· L-1浓度下β -EC总含量仅为0.1339 mg。处理后第5天, 各浓度处理组间β -EC总含量均差异显著(P< 0.05)。在各个浓度处理组中, 100 μ mol· L-1浓度下β -EC总含量较高, 为0.5798 mg。200 μ mol· L-1浓度下β -EC总含量仅为0.0797 mg。处理后第7天, 除10与50、150 μ mol· L-1, 150和200 μ mol· L-1处理样品组间β -EC总含量差异不显著(P> 0.05), 其他浓度间β -EC总含量差异均显著(P< 0.05)。在各个浓度处理中, 100 μ mol· L-1浓度下β -EC总含量最高, 与处理后第5天相比有大幅提升, 达1.2124 mg, 200 μ mol· L-1浓度下β -EC总含量仅为0.0447 mg。处理后第10天, 除10与50 μ mol· L-1、150与200 μ mol· L-1外, 其他浓度处理组间β -EC总含量均差异显著(P< 0.05)。在各个浓度处理组中, 100 μ mol· L-1浓度下β -EC总含量较高, 与处理后第7天相比有所下降, 为0.1334 mg。而200 μ mol· L-1浓度下β -EC总含量仅为0.0302 mg。
在培养了10 d的悬浮细胞培养体系中添加了不同浓度的MeJA, 处理后第1天, 除150 μ mol· L-1浓度的β -EC总含量与CK差异不显著外(P> 0.05), 其他浓度组β -EC总含量均与CK差异显著(P< 0.05)。各浓度处理组间β -EC总含量均差异显著(P< 0.05)。在各个浓度处理组中, 50 μ mol· L-1浓度下β -EC总含量较高, 为0.3013 mg, 而200 μ mol· L-1浓度下β -EC总含量仅为0.0798 mg。处理后第3天, 各浓度处理组间β -EC总含量均差异显著(P< 0.05)。此期10 μ mol· L-1浓度下β -EC总含量较高, 为0.5889 mg, 之后随着添加浓度的增大, 含量逐渐减少, 200 μ mol· L-1浓度下β -EC总含量仅为0.0384 mg。处理后第5天, 10、50、100 μ mol· L-1浓度下β -EC总含量差异显著(P< 0.05), 150、200 μ mol· L-1浓度下未检测到β -EC。此期10 μ mol· L-1浓度下β -EC总含量较高, 为0.2786 mg, 随着添加浓度的增大, 含量逐渐减少, 100 μ mol· L-1浓度下β -EC总含量仅为0.0465 mg。
结果表明, 筋骨草悬浮细胞内β -EC的含量与处理时间的长短和诱导子的浓度有直接关系, 同时也与细胞自身生长状况有关。在细胞快速生长的初始期(处理后第4天)添加MeJA, 对细胞影响较小, 细胞内β -EC含量提高幅度较小, 随着处理后时间的延长, 细胞逐渐衰老, 细胞内β -EC含量亦都大幅减少。细胞快速生长的中期(处理后第7天)是MeJA最适添加时期, 此期对细胞刺激适中, 一定浓度下可促进β -EC的产生和积累, 获得最高产量。在细胞快速生长的高峰期(处理后第10天)添加MeJA对细胞影响较大, 可在短期内获得较多的β -EC, 但存在时间较短, 细胞反应剧烈, 迅速衰老。
本研究发现, 筋骨草细胞在培养的初始阶段, 细胞增殖速度较慢, 随着时间的延长而转变为快速增殖, 到达高峰后趋于稳定状态。β -蜕皮甾酮(β -EC)含量积累曲线也基本符合此规律。该研究结果与其他种类的筋骨草悬浮细胞生长规律基本一致[13, 14]。另外, 王文星等[20]发现瑞香狼毒(Stellera chamaejasme)悬浮细胞的生长以及黄酮的积累随培养时间的增加而增加, 基本符合“ S” 型。丹参(Salvia miltiorrhiza)、黄岑(Scutellaria baicalensis)悬浮细胞生长量曲线亦是如此, 呈“ S” 形曲线变化[21, 22], 符合Logistic模型变化规律。
MeJA对植物细胞有多方面的功能。它可激活植物细胞体内防御酶的活性[23, 24, 25, 26, 27], 促进细胞的分裂和增殖, 调节植物的生长发育[17, 18]。王保军等[28]和Sirvent等[29]向贯叶连翘(Hypericum perforatum)悬浮细胞中添加100 μ mol· L-1 MeJA后, 其生长量是对照的1.3倍, 较低和较高浓度的MeJA对贯叶连翘生物量的影响不明显。说明只有适量浓度的MeJA才会对细胞的生长量有促进作用。这与本研究的结果规律是部分相似的, 不同的是在本研究中, 100 μ mol· L-1以上的MeJA对筋骨草细胞的生物量起抑制作用。在徐曲毅等[30]对绿豆(Vigna radiate)下胚轴生长的研究中, 10-6~10-4 mol· L-1以上的MeJA抑制绿豆下胚轴生长, 这与本研究结果的表现是一致的。张进杰等[31]发现高浓度MeJA会抑制黄芩细胞的生长, 而过早加入诱导物, 细胞生长也会受到抑制[32]。这一观点与本研究结果一致, 说明细胞的抑制作用受诱导物添加时期、浓度等因素的影响。同时, 本研究发现MeJA可缩短匍枝筋骨草悬浮细胞的生长周期, 加速其成熟、衰老。东方百合种球(Lilium oriental)经过1.0和10.0 mg· L-1 MeJA处理后, 可导致始花期显著提前。而在东方百合生长的现蕾期喷施1.0 mg· L-1MeJA可使单株花期和群体花期分别延长2.09和3.25 d[33]。在本研究中, 细胞快速生长的初始期(第4天)添加50 μ mol· L-1MeJA后筋骨草细胞鲜重持续增加, 在添加后第7天达到最高值35.10 g, 而在细胞快速生长的高峰期(第10天)添加50 μ mol· L-1MeJA后第1天细胞生长就受到抑制, 逐渐衰老死亡。说明不同的时期添加MeJA可调控植物的生长[34, 35], 本研究结果与此基本一致。
MeJA作为细胞间传导的信号分子, 可刺激植物启动防御体系, 从而增加多种次生代谢物质、挥发物的产量[36, 37, 38]。谢阳姣等[39]发现苦玄参(Picria felterrae)经过 0.05 mmol· L-1的MeJA处理后, 对代谢产物苦玄参苷 IA 和苦玄参苷 IB 的积累均表现为促进作用, 这与Aftab等[40]的MeJA可提高植物中青蒿素产量的观点相似。苗晓燕等[41]发现当MeJA浓度达400 μ mol· L-1时, 珊瑚菜(Glehniabo littoralis)的干燥根中补骨脂素和异欧前胡素含量可达到最大值, 分别为CK的6.09和5.53倍。 这说明MeJA可以刺激多种次生代谢产物的大量产生。朱宏涛等[42]发现, 三七(Panax notoginseng)组培苗中总苷含量随着培养时间延长总体呈先升后降趋势, MeJA浓度不同, 总苷最高含量出现的时间也不一致, 低浓度出现时间晚, 高浓度出现时间早。这与本研究的结果基本相似。在本研究中, 代谢产物β -EC积累量也呈现先升后降趋势, 随着处理时间的延长, 添加高浓度MeJA的细胞最先达到积累高峰, 之后快速衰老死亡。蔡静等[43]发现, 在培养周期第10天(指数生长中期)加入100 μ mol· L-1MeJA对明党参(Changium smyrnioides)悬浮细胞作用效果最明显, 而最适收获时间为处理4 d后, 此时悬浮细胞中佛手酚的产量为未诱导细胞的73.6倍。在本研究也发现类似结果。同时, 王和勇等[44]发现不同植物的代谢产物对诱导子的敏感程度不同, 因此不同代谢产物的积累与合成还需进一步研究探讨。
本研究表明, 筋骨草细胞的生长、β -EC积累动态曲线呈“ S” 型, 符合Logistic规律。其中4~10 d是细胞生长、β -EC合成的关键时期。此期细胞鲜重最高为32.12 g, 干物质积累达0.58 g, 细胞中β -EC达到0.25 mg· g-1。在生长周期内细胞生长和β -EC的合成几乎同步, 表明筋骨草细胞在生长过程中不断积累β -EC类物质, 细胞生长的速度与β -EC的合成密切相关。在筋骨草细胞的不同生长时期添加MeJA对细胞鲜重、β -EC的积累量影响有所不同, 而β -EC总含量与β -EC的积累量规律相似, 同时, 三者还与添加浓度、处理时间等因素相关。试验发现, 在细胞生长的初始期添加MeJA后对细胞影响最小, 表明在细胞生长的初期可能对MeJA类物质并不敏感, 虽可刺激一定量的β -EC产生, 但存留时间较短。在此时添加MeJA, 细胞中β -EC的含量和培养体系中所有细胞中β -EC总量的最大值均出现在添加100 μ mol· L-1MeJA后的第3天, 分别为2.7766 mg· g-1和0.7868 mg。而在细胞生长的中期(第7天)添加100 μ mol· L-1MeJA后的第7天, 细胞中β -EC含量和所有细胞中β -EC总量的最高值均出现在添加后的第7天, 分别达到3.5315 mg· g-1和1.2124 mg, 此时积累量达到了本研究所有处理组中β -EC总量的最高值, 是同期CK的14.44倍。在此期, 添加更高浓度MeJA后, 也可以在短时间内刺激悬浮细胞产生大量β -EC。如:在第7天添加150 μ mol· L-1MeJA处理后1 d, 细胞中β -EC含量可达1.4986 mg· g-1, 培养体系中所有细胞的β -EC总量达0.5244 mg。在细胞生长的后期添加MeJA主要表现为抑制细胞的生长, 促使生长周期缩短, 加速细胞衰老, 只有很低剂量的MeJA能在添加后的短时间内促进一定量的β -EC产生。如:在此期添加10 μ mol· L-1MeJA后的第3天, 细胞中的β -EC含量达1.4136 mg· g-1, 培养体系中所有细胞中β -EC总量达0.5889 mg。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|