作者简介:李孟湛(1992-),女,山东菏泽人,在读博士。E-mail: limzh2015@lzu.edu.cn
MYB家族转录因子在植物抵抗非生物胁迫过程中发挥着重要功能。前期研究发现强旱生植物霸王转录因子 ZxMYB315参与到植物抗逆过程中,其在拟南芥中的同源基因 MYB40的两种不同可变剪接体 MYB40.1和 MYB40.2对盐胁迫均有明显响应,但其在植物抗逆过程中的功能还未见报道。分析了在盐处理条件下 MYB40.1及 MYB40.2的表达模式,并利用CRISPR/Cas9技术,获得了2个 MYB40.1被编辑株系,及3个 MYB40.1和 MYB40.2被同时编辑株系,为揭示 MYB40这两种可变剪接体在拟南芥响应逆境胁迫过程中的功能和分子机理奠定了基础。
MYB transcription factors play important roles in various abiotic stress signaling pathways. In a previous study, we found that ZxMYB315 from Zygophyllum xanthoxylum is involved in plant responses to salt and drought stresses. In addition, the ortholog of ZxMYB315 in Arabidopsis, MYB40, has two splice variants, MYB40.1 and MYB40.2. Expression levels of both MYB40.1 and MYB40.2 are affected by salt treatment. However, the functions of these changes in response to abiotic stress are still unclear. In this study, we further analyzed the expression patterns of MYB40.1 and MYB40.2 under salt treatment. In particular, two heterozygous mutations for MYB40.1 and three heterozygous mutations for both MYB40.1 and MYB40.2 were generated using the gene-editing technique CRISPR/Cas9. These mutants now provide a foundation for studying functions and molecular mechanisms of MYB40 in various abiotic stress signaling pathways.
植物受到外界高盐、干旱、高温等逆境时, 胁迫信号在细胞内通过一系列地传递, 最终激发转录因子的表达; 转录因子与相应的顺式作用元件结合后, 从而特异性地启动应答基因的转录表达[1, 2]。研究发现, 与植物胁迫反应相关的转录因子主要有以下几个家族:MYB、bZIP、WRKY、NAC类转录因子家族等。其中, MYB家族作为植物最大的转录因子家族之一, 在植物抵抗非生物胁迫过程中发挥着重要功能。
研究者在模式植物拟南芥(Arabidopsis thaliana)中首次发现了受脱落酸(abscisic acid, ABA)显著诱导的AtMYB2基因, 其编码蛋白可参与调节脱水响应基因RD22的表达[3]。近几年先后从拟南芥、水稻(Oryza sativa)等植物中鉴定出一批参与非生物逆境响应的MYB转录因子, 并对其作用机理进行了深入研究。如Dai等[4]在拟南芥中过量表达水稻OsMYB3R-2基因可显著提高植株对冷、干旱和盐胁迫的耐受力。在马铃薯(Solanum tuberosum)中超表达StMYB1R-1后, 与干旱胁迫响应相关基因RD28、ALDH和ERD15的表达丰度大幅上调, 叶片的水分散失减少, 从而显著提高了植株的抗旱性[5]。番茄(Lycopersicon esculentum) R2R3-MYB转录因子LeAN2受高温诱导表达, 高温胁迫下超表达LeAN2的转基因植株通过保持较高的鲜重、光合效率及酶活性使其耐受性增强[6]。前期研究也发现强旱生植物霸王(Zygophyllum xanthoxylum)转录因子ZxMYB315的表达丰度受干旱和盐处理显著诱导, 在拟南芥中过量表达该基因显著提高了植物对干旱和盐胁迫的耐受力(未发表数据)。
通过ZxMYB315 CDS序列Blast比对发现, 拟南芥转录因子MYB40与ZxMYB315的同源性最高。MYB40具有两种不同的可变剪接体MYB40.1和MYB40.2, 在拟南芥信息学分析网站eFP(http://bar.utoronto.ca/efp/cgi-bin/efpWeb.cgi)上发现MYB40对盐和干旱胁迫均有明显响应, 表明其可能在植物抗逆过程中发挥重要功能, 而相关方面的研究还未见报道。因此, 获得MYB40.1和MYB40.2的敲除突变体, 并以敲除突变体为材料, 研究MYB40的抗逆功能具有十分重要的意义。但在ABRC(https://abrc.osu.edu/)等相关的拟南芥突变体种子库中未找到MYB40.1及MYB40.2相应的T-DNA插入缺失突变体。鉴于此, 应用CRISPR/Cas9基因编辑技术, 分别获得MYB40.1和MYB40.2的敲除突变体, 为揭示MYB40这两种可变剪接体在拟南芥响应逆境胁迫过程中的功能和分子机理奠定了基础。
本实验所用拟南芥野生型材料为Col-0; CRISPR/Cas9中间载体AtU6-26-sgRNA-SK和终载体pCAMBIA1300-pYAO:Cas9由兰州大学黎家实验室提供; 根癌农杆菌GV3101由兰州大学牧草逆境生理与基因工程实验室保存。本试验于2017年3月至2017年11月进行。
植物总RNA提取试剂盒购自北京天根生化科技有限公司; 引物合成及质粒提取试剂盒购自上海生物工程有限公司; 胶回收试剂盒购自Omega公司; 限制性内切酶BsaⅠ -HF、NheⅠ -HF、SpeⅠ -HF, 碱性磷酸酶CIAP及T4 DNA连接酶购自NEB公司; PrimeScriptTM RT reagent Kit with gDNA Eraser (Perfect Real Time)、DNA marker及SYBR Green qPCR Master Mix-SYBR Advantage购自大连宝生物公司; SILWET L-77购自GE Healthcare公司; 其他生化试剂为进口或国产分析纯产品。
将健康饱满的拟南芥Col-0种子消毒后, 点种于1/2 MS固体培养基上, 4 ℃春化3 d, 置于培养室培养1周后收集幼苗, 分别用1/2 MS液体培养基和含有150 mmol· L-1 NaCl的1/2 MS液体培养基处理6 h后取样, 用于提取总RNA。
将健康饱满的野生型拟南芥种子播种于装有草炭土的小花盆中并放入培养室进行培养。
培养室的温度为22~23 ℃, 光照条件为120~150 μ mol· m-2· s-1、16 h(昼)/8 h(夜), 相对湿度50%~60%[7]。
Real-time PCR引物设计:依据Tair网站(http://www.arabidopsis.org/)上MYB40两种可变剪接体的cDNA序列, 设计Real-time PCR引物如下(图1, 表1)。
| 表1 Real-time PCR引物 Table 1 Primers for Real-time PCR |
总RNA提取及cDNA获得:取1/2 MS液体培养基及含有150 mmol· L-1 NaCl的1/2 MS液体培养基处理6 h的根样, 参照植物总RNA提取试剂盒方法提取RNA并使用PrimeScriptTM RT reagent Kit with gDNA Eraser (Perfect Real Time)反转录获得cDNA。
MYB40.1及MYB40.2的表达模式分析:将反转录获得的cDNA稀释5倍后作为模板进行Real-time PCR。
靶点选择及靶点引物合成:在Tair网站上查找获得MYB40两种转录本的gDNA序列, 参考Ma等[8]及Yan等[9]的靶点选择方法, 应用Optimized CRISPR Design在线设计软件(http://crispr.mit.edu/)分别对MYB40.1、MYB40.2及MYB40进行靶点选择。因为经BsaⅠ 酶切后会留下粘性末端ATTG及AAAC, 所以在正向引物的5'端添加接头ATTG, 在反向引物的5'端添加接头AAAC。选择MYB40.1的靶点T1.1、T1.2, MYB40.2的靶点T2.1、T2.2及MYB40.1与MYB40.2的共同靶点T(图2), 并设计相应靶点引物如下(表2)。
| 表2 MYB40不同转录本CRISPR/Cas9靶点引物设计 Table 2 Design of CRISPR/Cas9 target primer for different transcripts of MYB40 |
1.5.1 sgRNA cassette构建 将10 μ mol· L-1的正反靶点引物各取10 μ L于80 μ L 0.5× TE (pH 8.0), 混匀98 ℃加热3 min后取出。取1 μ g中间载体AtU6-26-sgRNA-SK于50 μ L反应体系中, 使用1 μ L BsaⅠ -HF 37 ℃酶切4 h, 凝胶电泳检测, 回收3.5 kb片段。在10 μ L连接体系中, 使用0.2 μ L T4 DNA连接酶将40 ng酶切回收获得的AtU6-26-sgRNA-SK片段与1 μ L退火后的靶点引物在16 ℃连接过夜。
将连接产物转化大肠杆菌DH5α 感受态细胞并凃于含有50 mg· L-1氨苄的LB固体培养基上, 37 ℃培养过夜, 使用SK-gRNA-F (5'-CTCACTATAGGGCG AATTGG-3')与靶点反向引物进行菌落PCR, PCR长度应为499 bp。挑选阳性克隆进行扩大培养并提取质粒送测序, 将测序正确的质粒应用NheⅠ -HF和SpeⅠ -HF 37 ℃双酶切4 h, 电泳后切胶回收大小约642 bp的片段, 所获片段即为sgRNA cassette。
1.5.2 双元载体构建及农杆菌转化 在50 μ L体系中, 使用1 μ L SpeⅠ -HF在37 ℃酶切2 μ g终载体pCAMBIA1300-pYAO:Cas9 4 h后, 80 ℃失活20 min, 待反应体系冷却至室温后, 加入碱性磷酸酶CIAP 0.2 μ L于37 ℃反应10 min。 电泳, 切胶回收大小约14 kb 的片段。在10 μ L连接体系中, 加入约40 ng酶切后的pCAMBIA1300-pYAO:Cas9及15 ng左右的sgRNA cassette, 使用0.2 μ L T4 DNA连接酶在16 ℃连接过夜。
将10 μ L连接产物转化大肠杆菌Escherichia coli DH5α 感受态细胞, 涂于含有50 mg· L-1卡那霉素的LB固体培养基, 37 ℃过夜培养。使用1300-gRNA-F (5'-CCAGTCACGACGTTGTAAAC-3')与1300-gRNA-R (5'-CAATGAATTTCCCATCGTCGAG-3')进行菌落PCR并进行跑胶检测, PCR产物片段应为750 bp左右。挑选阳性克隆进行扩大培养并提取质粒。
使用冻融法将获得的质粒转化农杆菌GV3101, 涂于含有50 mg· L-1卡那霉素及50 mg· L-1庆大霉素的LB固体培养基上, 28 ℃培养48 h, 用1300-gRNA-F及1300-gRNA-R引物进行菌落PCR, PCR产物片段长度约为750 bp。对于每种质粒, 分别挑选阳性克隆进行扩大培养并保存于-80 ℃冰箱。
1.6.1 拟南芥遗传转化 应用浸花法[7]对拟南芥进行转化, 4周后收集种子。
1.6.2 基因编辑植株获得 拟南芥种子消毒后, 点于含有30 mg· L-1潮霉素的1/2 MS固体培养基上, 4 ℃春化3 d后置于培养室生长2周, 将具有潮霉素抗性的植株移植至草炭土中进行培养。
依据靶点引物的位置, 在其上下游分别设计转基因阳性植株检测引物(表3)。SDS法[8]提取潮霉素抗性拟南芥植株叶片总DNA, 使用检测引物进行PCR检测, PCR产物送至苏州金维智公司进行测序分析。
| 表3 突变检测引物设计 Table 3 Design of primers for mutation detection |
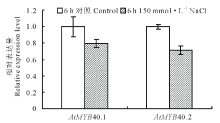
提取Control (1/2 MS)及150 mmol· L-1 NaCl (1/2 MS+150 mmol· L-1 NaCl)处理6 h拟南芥的根样, 液氮速冻后研磨, 提取总RNA, 使用NanoDrop 1000核酸蛋白检测仪检测, OD260/OD280为1.8~2.1, 表明所提RNA质量较高, 可用于随后的实验中。使用反转录获得的cDNA为模板, 分析盐处理条件下MYB40.1及MYB40.2表达变化(图3)。发现在盐处理6 h后, MYB40.1及MYB40.2的表达均下调, 表明这两种可变剪接体在拟南芥的耐盐过程中可能发挥了负调控的功能。
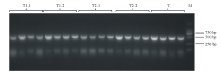
通过酶切连接的方法构建sgRNA cassette。使用SK-gRNA-F与靶点反向引物进行菌落PCR, 在499 bp处出现目标条带(图4)。对阳性克隆进行扩大培养, 提取质粒后送测序, 挑选测序结果合适的质粒, 使用NheⅠ -HF与SpeⅠ -HF进行双酶切, 对642 bp左右的条带进行切胶回收(图5), 所获片段即为sgRNA cassette。
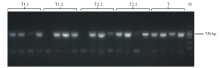
通过酶切连接的方法构建双元载体。使用1300-gRNA-F与1300-gRNA-R进行菌落PCR, 在750 bp处出现目标条带(图6), 表明MYB40两种不同可变剪接体的CRISPR/Cas9双元载体构建成功。
通过冻融法[6]将构建好的CRISPR/Cas9双元载体导入根癌农杆菌GV3101中, 挑取单克隆进行菌落PCR, 在750 bp处出现条带, 表明双元载体成功转化进入根癌农杆菌中(图7)。提取具有潮霉素抗性的拟南芥植株总DNA, 并使用突变检测引物进行检测, PCR产物送测序, 将测序结果与拟南芥野生型MYB40.1, MYB40.2的序列进行比对, 序列发生变化或测序出现套峰的即为基因编辑植株(图8)。
干旱、盐碱等非生物胁迫影响了植物的正常生长发育, 导致作物减产。在农业生产中, 通常通过灌溉及施肥减缓不良环境条件对作物生长的不利影响[10]。这些田间管理措施虽然在短时间内提高了作物产量, 但也造成了水资源浪费、次生盐渍化及水体富营养化等危害[11, 12]。因此, 培育能够保障稳定粮食供给且具有更强抗性的作物就具有十分重要的意义。植物在长期适应过程中, 进化出了一系列抗逆机制并形成了相应的调控网络。转录因子作为一种调控蛋白, 在植物响应各种非生物胁迫的信号通路中具有十分重要的功能, 其不同可变剪接体的形成在植物适应各种非生物胁迫中起到了关键作用[13, 14, 15, 16, 17]。因此, 研究转录因子受非生物胁迫所产生的可变剪接体在抗逆过程中的功能以更好的理解植物的胁迫响应机制具有十分重要的意义。
CRISPR/Cas9技术作为一种新兴的编辑技术, 因其高效性及简便性, 越来越多的应用于动植物的基因功能验证及育种中[18]。在该技术中, 通过构建特定的sgRNA, 引导Cas9至DNA的特定位点进行切割, 形成DNA双链断裂, 随后, 经非同源末端连接(non-homologous end joining, NHEJ)或同源重组(homologous recombination, HR)自我修复机制进行修复。通常情况下, NHEJ会导致随机的插入或缺失, 当插入或缺失发生在编码区时, 会导致翻译时的移码, 无法翻译成正确的蛋白, 从而达到基因编辑的目的[19]。在使用这一技术对拟南芥的基因进行编辑的过程中, 多通过农杆菌侵染花序, 将包含有Cas及相关序列的载体转入植物体内。因此, 在这一过程中, T-DNA最先进入到拟南芥的胚囊细胞中[20]。然而, 与其在营养组织中的活性相比, 最为广泛使用的启动Cas表达的CaMV 35S启动子在花序侵染的过程中活性较低, 严重影响了编辑效率且获得的突变多为体细胞突变(somatic mutations)。YAO参与拟南芥的胚胎发生及配子发育, 主要表达于分裂能力强的组织中[21]。因此, 本研究使用该基因的启动子pYAO代替35S启动子来启动Cas9的表达以提高编辑效率并获得生殖系突变(germline mutations)[9, 21]。
靶位点的选择将影响最终的编辑效率, 优先选择在内含子与外显子的连接处、起始密码子处及基因重要的功能结构域的NGG前设计靶点引物, 使编辑后DNA转录获得的pre-mRNA无法正常剪接、成熟的mRNA无法正常翻译或翻译获得的蛋白不具有活性, 以提高突变效率[8]。同时, 为达到特异性敲除不同可变剪接体的目的, 靶位点应根据两可变剪接体序列上的差异进行选择。因此, 本研究参照Ma等[8]及Yan等[9]的方法, 分别在AtMYB40.1的起始密码子处及第2个外显子与内含子的连接处, AtMYB40.2 CDS序列的5'端, AtMYB40.1的第3个外显子处分别选择编辑AtMYB40.1、AtMYB40.2及同时编辑AtMYB40.1和AtMYB40.2的靶位点。
在本研究中, 获得3个MYB40.1和MYB40.2被同时编辑的株系及2个MYB40.1基因编辑株系, 随后将继续对MYB40.2的突变体植株进行筛选, 获得3种不同突变体的纯合植株以进行抗逆功能分析, 同时, 该研究也为应用CRISPR/Cas9技术对霸王等非模式植物进行基因编辑以更好的研究其抗逆机理打下基础。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|