作者简介:李海云(1989-),男,甘肃永靖人,在读博士。E-mail: lihaiyun0923@163.com
为从岷山红三叶根际土壤中筛选出大量高效溶磷菌株,本研究采用Pikovaskaia’s、PKOC1和PKOC2三种溶磷培养基进行溶磷菌株的初步筛选和优良溶磷菌株16S rRNA基因序列鉴定,并对分离筛选效果较好的PKOC2培养基进行响应面优化。结果表明:采用Pikovaskaia’s、PKOC1和PKOC2三种溶磷培养基,从红三叶根际分离出26株溶磷菌株;经16S rRNA基因序列对7株优良溶磷菌株进行初步比对鉴定,初步鉴定结果为:菌株MHS4为蜡样芽胞杆菌( Bacillus cereus);菌株MHS7和MHS19为枯草芽胞杆菌( Bacillus subtilis);菌株MHS27为苏云金杆菌( Bacillus thuringiensis);菌株MHS30为荧光假单胞菌( Pseudomonas fluorescens);菌株MHS31为盖氏假单胞菌( Pseudomonas gessardii);菌株MHS49为产酸克雷伯菌( Klebsiella oxytoca)。PKOC2溶磷培养基优化配方为:葡萄糖18.19 g·L-1,Ca3(PO4)2 5 g·L-1,MgCl2·6H2O 3.21 g·L-1,MgSO4·7H2O 0.25 g·L-1,KCl 0.2 g·L-1,(NH4)2SO4 0.08 g·L-1。红三叶根际溶磷菌资源丰富,优化后的溶磷培养基为高效溶磷菌资源筛选提供资源支持。
In order to optimize isolation and screening of phosphate solubilizing bacteria from the rhizosphere soil of Trifolium pratense (Cv. Minshan), a preliminary extraction using Pikovaskaia’s, PKOC1 and PKOC2 phosphate solubilizing media was carried out, and the 16S rRNA gene sequence was determined for the bacterial strains with excellent phosphate solubilizing ability. The separation and screening effect of PKOC2 was better than that of PKOC1 and Pikovaskaia’s. The composition of the culture medium was optimized using a response surface experiment design. The optimal composition so identified for the PKOC2 medium was: glucose 18.19 g·L-1, Ca3(PO4)2 5 g·L-1, MgCl2·6H2O 3.21 g·L-1, MgSO4·7H2O 0.25 g·L-1, KCl 0.2 g·L-1, (NH4)2SO4 0.08 g·L-1. It was found that 26 strains of phosphate solubilizing bacteria were isolated from T. pratense rhizosphere using these techniques. A preliminary identification of 7 isolated bacterial strains with excellent phosphate solubilizing ability using the strains 16S rRNA gene sequence indicated that a strain designated MHS4 was Bacillus cereus, strain MHS7 and MHS19 were Bacillus subtilis, strain MHS27 was Bacillus thuringiensis, strain MHS30 was Pseudomonas fluorescens, strain MHS31 was Pseudomonas gessardii, and strain MHS49 was Klebsiella oxytoca. To summarise, phosphate-solubilizing bacteria were abundant in the rhizosphere of T. pretense were abundant, and the optimized phosphate-solubilizing medium provided support for the screening of bacterial strains with excellent phosphate-solubilizing ability.
植物根际促生菌在土壤肥力形成、营养循环、植物生长等方面发挥着重要作用[1]。促生菌的促生作用[主要有固氮、分泌吲哚-3-乙酸(indole-3-acetic acid, IAA)、溶磷和生防效果等]主要体现在改善植物根际营养环境, 分泌促生物质以及提高寄主对非生物胁迫的忍耐力等方面[2, 3]。利用从不同植物根际分离、筛选的优良促生菌资源研制的微生物菌肥, 与化肥、农药相比, 微生物菌肥具有成本低、增产稳定、非再生能源消耗少, 对生态环境友好、农产品安全, 经济效益高等优点[4]。因此, 植物根际促生菌种资源的筛选成为人们关注的热点。目前, 针对玉米(Zea mays)[5]、水稻(Oryza sativa)[6]、小麦(Triticum aestivum)[7, 8]等作物根际促生菌资源的筛选研究较多, 而对于牧草相关研究却鲜有报道。岷山红三叶(Trifolium pratense)是一种药草兼用型优质豆科牧草, 其粗蛋白和异黄酮含量是玉米和大豆(Glycine max)的2.3和10.0倍, 是异黄酮提取的优质原料[9]。近年来, 为追求经济效益, 种植者将大量工业磷肥和农药施用于岷山红三叶, 这一措施虽取得了一定的成效, 但存在很多问题[10], 如增加岷山红三叶的种植成本, 土壤肥力下降, 天然草场土壤微生物区系多样性破坏以及环境污染等[11]。而植物根际溶磷菌可以把土壤中不能被植物利用的无机磷转化为植物可利用的有机磷, 促进植物磷素的供应和生长[12]。因此, 从岷山红三叶根际土壤中筛选出具有溶磷、生防能力的菌株, 将其制成微生物磷肥, 以实现部分替代工业磷肥的目标具有重要意义。目前溶磷菌株通常采用Pikovaskaia’ s(PKO)培养基进行筛选, 根据溶磷菌在PKO培养基上形成的溶磷圈初步判断菌株的溶磷能力[13]。但是有些溶磷菌在该培养基上形成的溶磷圈很小, 但其溶解无机磷酸盐的能力却较强。为解决这一问题, Gupta等[14]在PKO培养基中加入了溴苯酚, 以提高溶磷圈的清晰度和透明度, 却并没有有效解决这一问题。林启美等[15], 齐文娟等[16]研究发现, 该培养基中Fe、Mn、Na等金属离子的存在对溶磷菌溶磷能力的发挥具有一定的限制作用。因此, 本研究采用PKO、PKOC1和PKOC2溶磷培养基对岷山红三叶根际溶磷菌进行筛选和优良溶磷菌株鉴定, 并对分离筛选效果较好的PKOC2培养基进行响应面优化, 为岷山红三叶根际促生菌特性研究及制备生物菌肥提供基础资料和菌种资源支持。
1.1.1 采样地概况及样品采集 采样地位于甘肃省定西市岷县岷山红三叶培育基地, 地理位置为北纬34° 07'34″-34° 45'00″, 东经103° 41'29″-104° 59'23″, 属于典型的高寒阴湿区, 适宜岷山红三叶生长, 是我国岷山红三叶的主要培育区和种植区。海拔2493 m, 年均降水量约为700 mm, 无霜期112 d, 年均气温5.8 ℃, 年均日照2228.6 h。试验区土壤为亚高山草甸土, 土壤pH为7.4~7.8, 有机质含量11.8 g· kg-1, 有效氮95.05 mg· kg-1, 有效磷7.32 mg· kg-1, 有效钾182.8 mg· kg-1。2013年5和7月采集岷山红三叶的根系及根际土壤, 装入无菌样品采集袋中, 带回实验室进行菌株分离。
1.1.2 培养基 采用Pikovaskaia’ s(PKO)、PKOC1[17]和PKOC2[17]3种溶磷培养基, 对红三叶根际土壤溶磷菌株进行初筛; LB培养基用于菌株的活化与保存。1)PKO培养基配方为:蔗糖 10 g, Ca3(PO4)2 5 g, (NH4)2SO4 0.5 g, NaCl 0.2 g, KCl 0.2 g, MgSO4 0.1 g, MnSO4 0.002 g, FeSO4 0.002 g, 酵母膏 0.5 g, 琼脂 18 g, 补加蒸馏水至1.0 L, 调节pH至6.8~7.0; 2)PKOC1培养基配方为:葡萄糖 10 g, Ca3(PO4)2 5 g, (NH4)2SO4 0.5 g, NaCl 0.2 g, MgSO4· 7H2O 0.1 g, KCl 0.2 g, MnSO4 0.002 g, FeSO4 0.002 g, 琼脂 18 g, 补加蒸馏水至1.0 L, 调节pH至6.8~7.0; 3)PKOC2培养基配方为:葡萄糖 10 g, Ca3(PO4)2 5 g, MgCl2· 6H2O 5 g, MgSO4· 7H2O 0.25 g, KCl 0.2 g, (NH4)2SO4 0.1 g, 琼脂 18 g, 补加蒸馏水至1.0 L, 调节pH至6.8~7.0; 4)LB培养基:酵母膏 5 g, 蛋白胨 10 g, NaCl 10 g, 琼脂 18 g, 补加蒸馏水至1.0 L, 调节pH至7.0。
准确称取10 g红三叶根际土壤样品装入250 mL三角瓶中, 加入90 mL无菌水及玻璃珠, 在室温条件下200 r· min-1振荡30 min。采用稀释法将菌悬液涂布于PKO、PKOC1和PKOC2培养基, 各3次重复, 在28 ℃条件下进行培养。培养期间, 观察平板上菌落生长及菌落周围透明圈变化情况, 挑取培养基上形成的透明圈较为明显的单个菌落, 进一步通过划线进行纯化。将各菌株重新接种到PKO培养基上, 各3次重复。28 ℃条件下培养13 d, 分别在第5、7、9、11、13天观察并记录透明圈的大小, 并计算D/d值[D为溶磷圈直径(cm), d为菌落直径(cm)], 根据D/d值初步判断各菌株的溶磷能力, 并将菌株接种于LB斜面培养基上, 保存于4 ℃冰箱中备用。
将保存的优良溶磷菌株在LB平板上进行活化, 采用细菌基因组DNA提取试剂盒(北京天根生化科技有限公司)对菌株基因组DNA进行提取。采用细菌16S rRNA基因特异性引物27 F和1492 R[14]进行PCR扩增。PCR体系为50 μ L:DNA模板2 μ L, 2× Taq PCR预混酶 25 μ L, 上下游引物各1 μ L, ddH2O 21 μ L。PCR反应参数为:95 ℃预变性 5 min; 95 ℃变性 30 s, 57 ℃退火 30 s, 72 ℃延伸1 min, 共30个循环; 最后72 ℃总延伸5 min。扩增产物用1%琼脂糖凝胶电泳进行检测, 将扩增产物送至北京六合华大基因科技股份有限公司进行测序。所测基因序列在NCBI数据库中进行同源性序列比对, 并采用MEGA 5.0软件中的邻近法(Neighbor-Joining)构建系统发育树, 自展值为1000次。
1.4.1 最佳影响因子选择 在150 mL三角瓶中, 分别配制PKOC2培养基成分MgCl2添加量(2.5, 5.0, 10.0 g), 葡萄糖添加量(5, 10, 20 g)和(NH4)2SO4添加量(0.10, 0.25, 0.50 g)的培养基50 mL, 以及采用不同碳源(果糖、半乳糖、甘露醇、木糖、蔗糖、麦芽糖、乳糖和蜜三糖)代替葡萄糖的培养基50 mL, 各处理3次重复。在121 ℃灭菌20 min, 在培养液中接种供试菌株MHS30菌悬液, 28 ℃培养13 d后, 将培养液8500 r· min-1, 4 ℃离心10 min, 取上清液, 采用钼锑抗比色法测定菌液中有效磷增量(扣除对照组的有效磷增量)[17]。
1.4.2 响应面优化 根据确定的PKOC2培养基成分中主要影响因子的浓度范围, 以供试菌株的相对溶磷率为响应值, 采用Design-expert 8.0.6软件中的Central composite design(CCD)试验设计方法和响应面分析对PKOC2培养基成分的重要影响因子进行优化, 因素水平设计见表1。试验结果利用Design-expert 8.0.6软件进行统计分析, 利用各因子两两交互响应面、等高线以及响应面回归模型进行优化, 找出供试菌株的最大溶磷量对应各因子的最优值, 并进行验证试验。
| 表1 中心组合试验因素水平设计 Table 1 Factors and levels of central composite design |
采用SPSS 17.0统计软件进行显著性检验和多重比较分析, 软件Design-expert 8.0进行响应面优化及回归方程方差分析。
利用3种不同溶磷培养基筛选岷山红三叶根际溶磷菌, 从红三叶根际分离筛选出26株具有溶磷能力的菌株, 部分平板初筛结果见表2。培养至第13天时, 以D/d> 2为衡量标准, PKO、PKOC1和PKOC2培养基分别可以获得溶磷能力较好菌株2、4和6株。可见采用PKOC1和PKOC2培养基的效果要优于PKO培养基, 这两种培养基可以从岷山红三叶根际分离获得更多的高效溶磷菌株。此外, 利用3种培养基分离筛选岷山红三叶根际溶磷菌, 不但工作量大, 而且菌株鉴定比较困难。因此有必要对上述培养基的组分加以优化, 本研究下一步选择对分离筛选岷山红三叶根际溶磷菌效果较好的PKOC2培养基进行成分优化。
| 表2 部分溶磷菌平板初筛结果 Table 2 The primary screening results of phosphate-solubilizing strains |
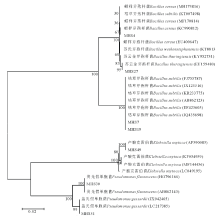
对分离自红三叶根际土壤中的7株优良溶磷菌株进行16S rRNA基因序列鉴定, 通过与现已报道的16S rRNA基因序列进行相似性比对分析。根据16S rRNA基因序列系统发育树分析鉴定结果表明(图1):菌株MHS4为蜡样芽孢杆菌(Bacillus cereus); 菌株MHS7和MHS19为枯草芽孢杆菌(Bacillus subtilis); 菌株MHS27为苏云金芽孢杆菌(Bacillus thuringiensis); 菌株MHS30为荧光假单胞菌(Pseudomonas fluorescens); 菌株MHS31为盖氏假单胞菌(Pseudomonas gessardii); 菌株MHS49为产酸克雷伯菌(Klebsiella oxytoca)。
表3结果表明, 采用果糖、半乳糖、甘露醇、木糖、蔗糖、麦芽糖、乳糖、蜜三糖等碳源代替葡萄糖时, 培养基的溶磷量均低于碳源葡萄糖。当葡萄糖浓度为20 g· L-1时, 随着MgCl2浓度的增加(2.5~10 g· L-1), 培养基的相对溶磷率呈现出先增大后减小的趋势(118.0%→ 122.5%→ 71.7%); 当MgCl2浓度为10.0 g· L-1时, 随着葡萄糖浓度的增加(5~20 g· L-1), 培养基的相对溶磷率呈现出先增大后减小的趋势(73.2%→ 105.6%→ 71.7%); 当MgCl2浓度为2.5 g· L-1时, 随着葡萄糖浓度的增加(5~20 g· L-1), 培养基的溶磷率一直呈现增大的趋势(55.6%→ 92.6%→ 118.0%); 当葡萄糖浓度为10 g· L-1时, 随着(NH4)2SO4浓度的增加(0.1~5.0 g· L-1), 培养基的相对溶磷率呈现出先增大后减小的趋势(86.6%→ 107.5%→ 102.1%)。由此可知, 葡萄糖、MgCl2和硫酸铵添加量对PKOC2培养基的溶磷能力具有显著影响, 是该培养基成分的主要影响因子。
| 表3 不同PKOC2培养基成分对菌株MHS30溶磷量的影响 Table 3 Effects of different PKOC2 medium components on phosphorus solubilizing capacity of strain MHS30 (%) |
2.4.1 CCD试验设计 以供试菌株MHS30溶磷量(P-solubilization capacity)为响应值(Y), 通过CCD试验设计筛选出葡萄糖、MgCl2和(NH4)2SO4三个影响因子的最佳添加量(表4)。由表5分析结果表明:该模型极显著(P< 0.01), 说明回归模型可用。方差分析失拟项为0.7319> 0.05, 说明所得的回归方程与实际拟合中非正常误差所占的比例较小。另外, 确定系数R-Sq与Adj.R-squared分别为95.74%和91.91%, 二者差距较小。从预测结果的整体估计来看, R-Sq和Pred.R-squared分别为95.74%和84.48%, 说明该模型拟合度较好。同时, 变异系数为2.72, 说明试验可信度较高。得到的回归方程为:Y=273.62+6.75A+5.58B+4.28C-1.82AB-11.04AC+12.88BC-9.63A2-9.92B2-12.22C2。该回归模型中的一次项A(葡萄糖)、B(MgCl2)对菌株的溶磷能力有极显著影响(P< 0.01), C[NH4)2SO4]对菌株的溶磷能力有显著影响(P< 0.05), 并且影响的程度从大到小依次为:A(葡萄糖)> B(MgCl2)> C[(NH4)2SO4]。此外, 二次项A2、B2和C2也会对溶磷能力产生显著影响(P< 0.01)。上述结果表明, 该模型为溶磷培养基的筛选提供了可靠的模型, 可利用Design-expert软件优化回归方程, 预测3个因素的最优参数。
| 表4 CCD试验设计与结果 Table 4 Design and results of central composite design |
| 表5 回归方程方差分析 Table 5 Analysis of variance of regression equation |
2.4.2 响应面分析 由图2可以发现, 葡萄糖与氯化镁浓度两因素之间的交互作用不显著(P> 0.05); 葡萄糖与硫酸铵浓度的交互作用极显著(P< 0.01); 氯化镁与硫酸铵浓度之间的交互作用也极显著(P< 0.01), 响应曲面和等高线的分析结果与方差分析所得的结果一致。PKOC2培养基最佳组分的预测由Design-expert通过求回归方程最大值, 当最大响应值Y(溶磷量)为276.77 μ g· mL-1时, 对应的自变量A(葡萄糖)、B(MgCl2)和C[NH4)2SO4]分别为18.19、3.21和0.08 g· L-1。
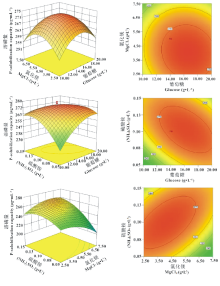 | 图2 两因素交互作用对菌株溶磷量影响的响应曲面图和等高线图Fig.2 Response surface and contour plots for the effects of cross-interactions among factors on phosphate solubilization capacity of the strain |
2.4.3 验证试验 为验证响应面预测模型的可用性和验证回归方程预测的可靠性, 利用预测所得的最佳培养基组成进行验证试验, 所测溶磷量为279.5 μ g· mL-1, 与预测值相近, 因此该模型具有较好的可信度, 可用于后续试验。
高效溶磷菌可以有效转化土壤中不易被植物直接吸收利用的无机磷[4], 提高土壤难溶磷的有效性和磷肥的利用效率, 对促进植物生长具有重要意义。本研究发现同一株溶磷菌在不同的溶磷培养基上其溶磷能力差异较大, 就菌株MHS30而言, 在PKO、PKOC1和PKOC2培养基上D/d值分别为1.44、1.95和2.90, 究其原因主要与培养基的组成及添加量有关, 故溶磷培养基的优化对筛选出高效溶磷菌株显得尤为重要。溶磷微生物正常的生长繁殖, 不仅需要充足的碳源物质, 而且还需要氮、磷、钾、钙、镁、铁等无机盐成分, 有些微生物还需要特殊的生长因子[18]。对于溶磷培养条件的优化也早有研究, 大多从C源、N源、NaCl、pH、装液量、接种量、种龄、温度、摇床转速等方面来进行研究[19, 20, 21, 22]。溶磷过程是复杂的, 并不是某一因素起全部作用, 而是多种因素共同作用的结果, 溶磷培养条件也会因菌株的不同而异。溶磷微生物溶磷能力的大小常通过采用PKO固体培养基定性测定和PKO液体培养基定量测定[13]。用溶磷圈法定性判定菌株是否具有溶磷能力存在一定的局限性, 这有可能是因为不同有机酸扩散机理不同。相对于溶磷圈法定性判定溶磷菌的溶磷能力, 液体培养定量测定方法更为合理和科学[19, 22]。然而另有研究证明PKO培养基中的酵母粉对溶磷菌溶解无机磷有限制作用, 而MgCl2对溶磷菌溶磷非常重要[23]。同时有研究表明, 去掉PKO培养基中的铁、镁、锰、钠等无机盐可显著提高溶磷菌的溶磷能力[15]。有研究表明, 溶磷菌对无机营养需要量很少, 磷矿粉中的含量能够满足其需要, 去掉培养基中铁、锰、镁、钠等无机盐能显著提高细菌溶解磷矿粉的能力, 并且培养基中缺少这些离子, 能减少磷酸根与其反应形成难溶性化合物, 从而避免了微生物释放出来的磷被再固定[15]。本研究发现, 葡萄糖、氯化镁、硫酸铵添加量对PKOC2培养基的溶磷能力具有显著影响, 是该培养基的关键影响因子。溶磷过程是复杂的, 并不是某一因素起全部作用, 而是多种因素共同作用的结果, 因此确定培养基最佳影响因子的最佳添加量对溶磷培养基的改良具有重要意义。通常优化培养基的方法主要有正交试验和均匀试验, 这些试验设计次数较少, 获得的优化结果不够准确, 而响应面法(RSM)可解决优化溶磷培养基组分的问题。Gao等[24]利用RSM中的CCD试验完成了乳杆菌发酵培养基的优化, 并使其制作成本降低了11%。Lotfy等[25]使用Box-Benhnken(Box)试验设计优化了黑曲霉的培养基组成, 优化后的培养基使菌株的柠檬酸产率提高了14倍以上。本研究对溶磷PKOC2培养基的组成采用响应曲面法进行优化, 最佳培养基成分为(1.0 L):葡萄糖18.19 g, Ca3(PO4)2 5 g, MgCl2· 6H2O 3.21 g, MgSO4· 7H2O 0.25 g, KCl 0.2 g, (NH4)2SO4 0.08 g。从研究结果还可以发现, 溶磷圈可以作为筛选溶磷菌株的必要条件, 但不是充分条件, 仅仅靠溶磷圈的大小来判断溶磷菌株溶磷能力的大小不够完善[26]。齐文娟等[16]研究发现, 不添加酵母膏的PKO培养基更适用于分离筛选小麦和苜蓿根际的溶磷细菌, 并且该培养基被改良之后, 4种溶磷细菌分泌出的有机酸种类和含量都有明显的增加。定量分析虽然可靠, 但是对于大量溶磷菌株的初筛来讲, 定性分析也是必不可少的, 通过定性分析菌株是否产生溶磷圈可以缩短筛选溶磷菌株的时间。植物根际土壤中存在多种溶磷微生物, 不同溶磷微生物的溶磷途径复杂多样。近年来的研究资料表明, 分泌有机酸是溶磷微生物溶磷的主要途径之一。目前已经发现的溶磷微生物培养过程中分泌的有机酸种类主要有:乙酸、丙二酸、草酸、乳酸、丁酸、丙酸、葡萄糖酸、柠檬酸、酒石酸、苹果酸等[15, 27]。这几类有机酸分泌到土壤中会使土壤酸度增加, 有效促进土壤中难溶性磷酸盐的转化和吸收, 进而促进作物生长。然而不同溶磷微生物分泌的有机酸种类和含量各不相同, 其溶磷途径也存在很大差异, 因此有必要对上述分离筛选的溶磷菌株的溶磷机制进行进一步的研究。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|