作者简介:胡冰钰(1992-),女,安徽合肥人,在读硕士。E-mail: 2015116002@njau.edu.cn
镉(Cd)是环境中常见的非生物胁迫因子,从种质资源中筛选出不同耐镉型的植物材料有利于能源植物在重金属污染土地上的高效开发利用。基于此,本研究以14个能源植物柳枝稷品种为供试材料,外源施加浓度为10 μmol·L-1镉,结合形态和生理指标,采用隶属函数及标准差系数权重法综合评价了柳枝稷幼苗对Cd的耐受性。结果表明:10 μmol·L-1 Cd胁迫显著降低了柳枝稷根长、根表面积、根尖数、总生物量、净光合速率及根系活力,且品种间差异显著( P<0.01)。根据隶属函数法得到柳枝稷对镉耐受性综合评价值( D),其中Kanlow最高,Forestburg最低。采用系统聚类法对 D值进行聚类分析,结果表明,14份柳枝稷可分为3组不同耐镉型材料,其中强耐镉型材料1份,为Kanlow;中等耐镉型材料9份,分别为Alamo、BoMaster、Carthage、Cave in Rock、Longisland、Newyork、Shawnee、Sunburst、Trailblazer;镉敏感型材料4份,分别为Blackwell、Dacotah、Forestburg、Shelter。结合柳枝稷对Cd的吸收,进一步分析发现耐镉性较强的品种镉富集能力也较强。可为选择适宜的柳枝稷材料种植于镉污染土地上提供理论依据,同时为丰富评价植物耐镉种质资源提供可操作性的方法。
Cadmium (Cd) is a common abiotic stress factor in the environment. Screening germplasm resources for Cd tolerance is an effective way to develop plants for use in biofuel production on land contaminated by heavy metals. Switchgrass ( Panicum virgatum) has been identified by the U.S. Department of Energy as having very high potential as a biofuel substrate. Hence, 14 switchgrass cultivars under hydroponic culture were treated with 0 (control) or 10 μmol·L-1 Cd, and morphological and physiological traits were investigated. Root morphology data of switchgrass were obtained using an EPSON scanner and WinRHIZO software. Net photosynthetic rate was determined with the LiCor-6400 portable photosynthesis system and a spectrophotometer was used to determine root activity. Inductively coupled plasma atomic emission spectroscopy (ICP-AES) was used to examine Cd accumulation of switchgrass. Data for measured traits were transformed to units of statistical standard deviation by division by their standard error and aggregated with positive/negative sign reversal where relevant, so that Cd tolerance was additive across traits, and a composite index of Cd tolerance compiled. Lastly a cluster analysis was performed. It was found that Cd stress significantly reduced the root length, root surface area, number of root tips, total dry weight, net photosynthetic rate and root activity of different switchgrass cultivars to different degrees. Significant differences were found ( P<0.01) among cultivars. According to composite index ( D value), Kanlow was the most tolerant variety, while Foreburg was the least tolerant. On cluster analysis, the 14 switchgrass cultivars were classified into 3 Cd-tolerance types. One cultivar (Kanlow) had high Cd tolerance; 9 cultivars (Alamo, BoMaster, Carthage, Cave in Rock, Long Island, Newyork, Shawnee, Sunburst, Trailblazer) were medium-cadmium-tolerance types and 4 cultivars (Blackwell, Dacotah, Foresburg, Shelter) were Cd-sensitive types. It was also found that the cultivar Kanlow with high Cd tolerance had a strong ability to accumulate Cd. This study provides a theoretical basis for selecting suitable switchgrass cultivars for the cultivation of Cd-polluted land, and the results illustrate an operable method to evaluate the Cd tolerance of plant germplasm lines.
随着工农业的快速发展, 环境中土壤、水体及大气等受到重金属不同程度的污染, 许多国家和地区由重金属导致的环境污染问题严重, 其中以矿区附近农田和边际土地尤为突出[1, 2]。2014年的《全国土壤污染状况调查公报》表明, 中国土壤环境污染状况严重, 其中土壤中镉(cadmium, Cd)的点位超标率最高, 达到了7.0%, 可能严重危及植物的正常生长及人类的健康[3]。目前, 我国耕地受到污染的总面积达到2667万 hm2, 其中, 由土壤重金属污染导致的粮食年减产量超过1000万t[4]。环境中镉达到一定浓度时可对植物造成毒害作用, 抑制植物细胞分裂和光合电子传递, 扰乱植物体内营养吸收, 从而影响植物正常生长[5], 具体表现为叶片失绿, 根系发黑, 严重时甚至导致植株死亡[6]。
已有许多研究证明, 不同物种, 不同基因型和不同品种间的植物对Cd的吸收及耐受性存在差异, 这在水稻(Oryza sativa)[7]、玉米(Zea mays)[8]、花生(Arachis hypogaea)[9]等作物中已得到验证, 并为污染土地利用及作物合理生产提供了依据。近年来的研究指出, 在重金属污染土地上种植耐Cd的能源植物可实现生物质资源开发与污染土地利用的双赢[10, 11]。柳枝稷(Panicum virgatum)是一种多年生草本C4植物, 其根系发达, 抗旱能力强, 适宜生长在边际土地上, 生物质产量高, 纤维素含量较高, 是典型的草本能源植物[12, 13, 14]。另有研究表明, 柳枝稷对镉有较强的耐受性, 可在中度和重度Cd污染环境中生长[15, 16]。
在镉污染土壤中种植柳枝稷, 既可以充分利用Cd污染土地, 又可以获得其作为转化生物乙醇的原料, 并有利于降低温室气体的排放[17]。然而, 有关不同柳枝稷种质资源在Cd胁迫下的耐受性差异及系统评估柳枝稷种质资源对Cd胁迫的耐受类型, 仍需要进一步的研究。基于此, 以能源植物为导向, 有必要开展柳枝稷对Cd胁迫耐受性的研究, 并结合柳枝稷吸收Cd的特性, 为筛选出适宜在Cd污染土地上种植的柳枝稷材料提供参考依据。
14个柳枝稷品种及生态型见表1, 其中3个低地型品种, 其余为高地型品种。种子来源于美国 ERNST SEEDS公司。
| 表1 14个柳枝稷品种及生态型 Table 1 14 switchgrass cultivars and their ecotypes in the exreriment |
种子于50%的硫酸中浸泡20 min打破种子休眠[15], 去离子水冲洗干净后用10%次氯酸钠浸泡10 min, 再用去离子水冲洗数次, 播于培养皿中, 萌发后移至洗净烘干的石英砂上培养, 待幼苗长至1叶1心时, 移入装有1 L 1/4 Hoagland营养液的塑料盆(22.0 cm× 16.0 cm× 7.5 cm) 中, 适应生长一周后换为1/2 Hoagland 营养液培养, 用HCl或NaOH溶液将营养液的pH调至5.8[18]。待幼苗长至5叶1心时, 分别设置对照(0, 不加镉)和10 μ mol· L-1 CdCl2· 2.5H2O处理, 每个处理3盆重复, 每盆中7棵苗, 一周更换两次营养液, 并调换盆钵的位置降低边缘效应的影响[19]。镉处理两周后取样并测定相关生理指标。植物生长条件为室温25~30 ℃, 湿度50%~70%, 光照/黑暗各为12 h。本试验从2016年9月至2017年3月, 在南京农业大学生命科学学院植物环境生理实验室温室内进行。
1.3.1 根系形态指标的测定 将样品的地上部和根分离, 完整的根系立即放入盛有去离子水的透明盘中, 充分分散, 使根系无重叠、完整地平铺在托盘 (30 cm× 40 cm) 中。用EPSON扫描仪(Expression 10000XL, 日本)扫描, 用根系分析软件(WinRHIZO software V 5.0, Regent Instruments, Quebec, Canada Inc.)分析出总根长、根表面积、根尖数等根系形态参数及根系构型数据。
1.3.2 生物量干重和镉含量测定 将植株放入含有20 mmol· L-1 EDTA-Na2溶液的烧杯中浸泡15 min, 除去附在根表面的镉离子, 去离子水简单冲洗后, 吸水纸吸干, 将植株按根系和地上部分开, 于烘箱(101-2A型) 70 ℃下烘干至恒重。样品Cd含量的测定方法为, 取0.1 g烘干样品放入消煮管中, 加入5 mL HNO3, 置于高效微波消解系统1 h, 消煮后的样品用2.5%硝酸回溶, 定容至25 mL, 之后用电感耦合等离子体发射光谱仪(ICP-AES)测定植物组织中的Cd含量[20]。
1.3.3 净光合速率的测定 样品收获前一天, 用便携式光合测定系统(LI-6400, Li-Cor, Lincoln, NE, 美国)测定最新成熟叶片的净光合速率(net photosynthetic rate, Pn), 使用内置红蓝光源(LI-6400-02B), 光强设为1200 μ mol· m-2· s-1。样品室中叶片温度和二氧化碳浓度分别为(27± 2) ℃和(450± 10) μ mol· mo
1.3.4 根系活力的测定 分别称取上述材料根尖样品0.5 g, 放入15 mL离心管中, 加入0.4% TTC (2, 3, 5-三苯基氯化四氮唑)溶液和磷酸缓冲液的等量混合液10 mL, 把根充分浸没在溶液内, 在37 ℃暗保温1~3 h, 然后加入1 mol· L-1硫酸 2 mL, 以停止反应。与此同时做一空白实验, 先加硫酸, 再加根尖样品, 37 ℃暗保温后加硫酸, 其溶液浓度和操作步骤同上。然后把根取出, 吸干水分后与乙酸乙酯3~4 mL和少量石英砂一起在研钵内磨碎, 然后将红色提取液移入试管, 并用少量乙酸乙酯把残渣洗涤2或3次, 皆移入试管, 最后加乙酸乙酯使总量为10 mL, 用分光光度计在波长为485 nm下比色, 以空白实验作参比测出吸光度, 查标准曲线即可求出四氮唑还原量[22], 用TTC表示根系活力大小, 并根据下式计算根系活力。
TTC(mg· g-1 FW· h-1)=C/(1000× W× t)
式中:C为四氮唑还原量(μ g); W为根重(g); t为时间(h)。
1.4.1 单项指标耐性指数 为排除不同品种的柳枝稷自身生长情况差异对综合评价造成的影响, 试验采用耐镉指数来表述不同材料对镉胁迫的耐受性[23]。耐镉指数为镉胁迫下某一指标测量值与正常情况下该指标测量值的比值。
1.4.2 隶属函数计算 由于不同变量与耐镉性之间存在正相关和负相关两种情况, 因此, 对于与耐镉性呈正相关的指标, 采用正隶属函数X(μ )=(X-Xmin)/(Xmax-Xmin), 呈负相关的, 采用反隶属函数X(μ )=(Xmax-X)/(Xmax-Xmin)进行计算[24]。式中, X(μ )为柳枝稷某一指标测定值; Xmax为所有植株某一指标同一处理下测定最大值; Xmin为所有植株某一指标同一处理下测定最小值。
1.4.3 各综合指标的权重 运用隶属函数对各指标进行标准化处理, 采用标准差系数法确定各指标权重。
式中:Xij表示第i个种质的第j个评价指标,
1.4.4 各种质材料综合耐镉能力的大小 将上式结果代入下面公式, 计算得到各种质耐镉性综合评价值D。
式中:μ (Xj)表示第j个评价指标的隶属函数值。
用Excel 2013记录整理原始数据, SPSS 20.0 统计分析数据, 运用Duncan检验进行单因素方差分析(P< 0.05)。运用隶属函数法和标准差赋予权重法计算各品种的耐镉性综合得分, 鉴定每份材料耐镉能力, 并采用欧氏距离的平方系统聚类法进行聚类分析[26]。
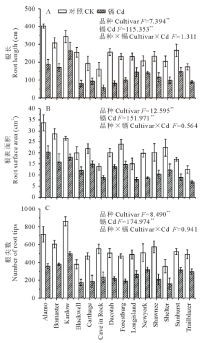
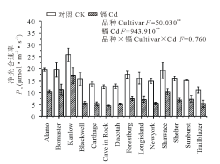
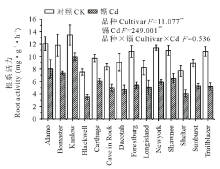
如图1所示, 与对照相比, 镉胁迫显著降低了柳枝稷的根长, 根表面积和根尖数, 且品种间差异显著(P< 0.01)。就根长而言, Kanlow的下降幅度最低, 仅为20%, 而Dacotah被抑制的程度最大, 达到了76%。在镉胁迫下, 柳枝稷的根干重, 地上部干重和总生物量都受到了显著抑制(P< 0.01)(图2), 但不同品种受抑制程度仍有差异, 无论是在镉胁迫还是对照条件下, Kanlow的总生物量都是最大的, Cd胁迫时该品种总生物量降低了34%, 而Longisland的总生物量最小, 镉胁迫下降低了41% (图2C)。由图3可以看出, 镉胁迫显著降低了不同柳枝稷品种的净光合速率, 品种间差异同样达到显著水平(P< 0.01), 其中, Kanlow的下降幅度最小, 仅降低了32%, 而Blackwell降低程度最大, 为63%; 镉胁迫下, 柳枝稷的根系活力也受到显著抑制(图4), 且品种间差异显著(P< 0.01), 其中, Kanlow下降的程度最小, 只有23%, 而Forestburg则降低了55%。
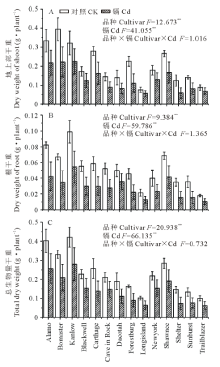 | 图2 镉对柳枝稷干重的影响 图中数据为平均值± 标准误, 下同。Fig.2 Effect of cadmium on dry weight of switchgrass (n=3) Values are means± SE, the same below.* * : P< 0.01. |
如表2所示, 镉胁迫下, 对于根长而言, 低地型柳枝稷Kanlow的耐镉指数最高, 高地型Dacotah的最低, 且Kanlow的耐镉指数显著高于Dacotah(P< 0.05); 同样的, 对于净光合速率而言, Kanlow的耐镉指数也是最高的, 且显著高于其他品种(P< 0.05), 而高地型Cave in Rock的耐镉指数最小。另外, 在镉胁迫下, 各柳枝稷品种根表面积, 根尖数, 生物量以及根系活力的耐镉指数均没有显著差异。
| 表2 镉胁迫下柳枝稷各单项指标的耐性指数值 Table 2 The value of tolerance index of single index of switchgrass under Cd stress |
如表3所示, 柳枝稷耐镉性综合评价体系中, 净光合速率, 根系活力和总根长的权重最大, 分别为0.229, 0.188和0.169, 权重加和为体系总权重的58.6%, 这表明该评价体系侧重于柳枝稷净光合速率与根系相关参数的评价。采用标准差系数赋予权重法对各种质材料进行综合评价结果表明, Kanlow的综合评价值(D)最大, 即该品种在镉处理下耐受性最强, 综合表现最好。根据D值得出各种质的耐镉性大小依次为 Kanlow> BoMaster> Alamo> Sunburst> Longisland> Shawnee> Trailblazer> Cave in Rock> Carthage> Newyork> Dacotah> Shelter> Blackwell> Forestburg。
| 表3 镉胁迫下柳枝稷各指标隶属函数值、权重、综合评价值及排序 Table 3 Subjective function value, index weight, comprehensive evaluation value (D) and order of switchgrass under Cd stress |
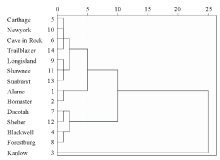
采用系统聚类法对D值进行聚类分析, 可将14个品种划分为3类:Kanlow为第一类, 属于强耐镉型品种; Alamo、Bomaster、Carthage、Cave in Rock、Longisland、Newyork、Shawnee、Sunburst、Trailblazer为第二类, 属于中等耐镉型品种; Blackwell、Dacotah、Forestburg、Shelter为第三类, 属于镉敏感型品种(图5)。
如图6A所示, 中等耐镉型品种Shawnee根中的镉含量最高, 其次是强耐镉型品种Kanlow, 且这两个品种的根中镉含量均显著高于其余镉敏感型品种(P< 0.05); 而地上部镉含量最高的是中等耐镉型品种Newyork, 除此之外, 强耐镉型品种Kanlow的地上部镉含量都显著高于其他镉敏感型品种(P< 0.05)(图6B)。对于镉积累而言, 无论根还是地上部, 强耐镉型品种Kanlow的镉积累量都是最高的, 显著高于其他镉敏感型品种(P< 0.05)(图6C, D)。镉是植物生长的非必需元素之一, 即使在较低浓度时也可对植物产生毒害, 如Cd胁迫加速根尖细胞的衰老, 降低根系活力, 阻碍根系对营养物质的吸收和向地上部的转运, 导致植株生长受到抑制[27, 28]。有研究发现, 随着营养液中Cd浓度的增加, 柳枝稷的总根长、根表面积和根尖数显著降低[16], 本实验结果与之一致。本研究中柳枝稷的总根长, 根表面积, 根尖数以及根系活力在10 μ mol· L-1镉胁迫下均显著降低, 且不同品种下降的程度不同, 表明这些根系相关参数对Cd胁迫较敏感, 故可将根系相关参数作为评估植物耐镉性的一个重要指标。同样的, 也有研究指出, 根系构型变化一般可反映植物对非生物胁迫的敏感程度[29], 因而本研究选用根系形态及根系活力等相关指标来评价柳枝稷的耐镉性是切实可行的。
镉胁迫可破坏植物线粒体和叶绿体超微结构, 导致呼吸作用和光合作用受到影响[30], 进而植株叶片发黄, 生物量下降, 干物质量降低[5]。本研究中, 镉胁迫显著降低了不同柳枝稷品种的生物量干重, 张锡洲等[7]的研究表明, 镉胁迫严重抑制了水稻的生物量, 与本研究结果一致, 10 μ mol· L-1镉处理下不同品种柳枝稷的生物量干重也出现了不同程度的降低, 因而可将生物量作为评价镉耐性强弱的另一重要指标。光合作用可用于分析环境因素对植物生长和代谢的影响[31]。镉胁迫影响了二氧化碳的固定和电子传递链的发生, 从而降低植物光合速率[32], 同样, 本研究中不同品种柳枝稷的净光合速率在镉胁迫下也显著降低, 因此可以选用净光合速率来评价植物耐镉性。
植物的耐镉性需要由多指标构成的综合性指标进行评价[33], 仅凭单个指标评价, 其结论不仅可信度低, 可能还会自相矛盾, 选取多个指标综合评价植物耐镉性有利于结论的可靠性, 采用隶属函数法对多个指标进行综合分析, 可以避免单一指标带来的片面性[34, 35]。本实验评价结果与刘长浩[36]有所不同, 这一方面依赖于实验材料的数量, 选取了10个柳枝稷品种, 而本实验有14个, 随着柳枝稷种质材料数量的增加, 或许更能筛选出对Cd耐受型极端的材料, 另一方面, 实验中仅采用了形态学指标, 缺少相关生理指标, 而本实验的评价指标更为全面, 除了根系构型和生物量之外, 还有净光合速率和根系活力等生理指标, 其中净光合速率这一指标的权重达到22.9%, 说明净光合速率在评价体系不应被忽视。另有研究通过测定48个番茄品种在低温胁迫下的相关生理指标, 包括与光合作用相关的叶绿素荧光及光系统Ⅱ 等参数, 采用隶属函数综合评价了不同番茄品种耐寒能力, 也表明了光合参数在评价体系中的重要性[37]。
本研究通过隶属函数法对14个柳枝稷种质的6个指标进行综合评价, 结合聚类分析将14个柳枝稷品种分为3个不同的耐镉型材料, 这样实现了对品种耐Cd性差异的定性分类, 但仍需要在今后的大田实验进一步验证。聚类分析法也在不同品种多花黑麦草(Lolium multiflorum)种子萌发期耐Cd性差异研究[25]以及筛选不同抗旱性小麦(Triticum aestivum)品种[38]的分析中得到运用, 证明该方法具有可行性。
不同植物以及植物的不同部位对Cd的积累能力有一定差异[39]。Sipos等[40]研究发现, Cd主要集中在植物根系, 只有少量向地上部转移。本实验中14个柳枝稷材料幼苗的根部镉含量均大于地上部, 这表明根向地上部转移镉的能力较低, 减少重金属从根向地上部的运输是植物耐受重金属胁迫的机制之一[41]。其中耐镉性强的品种Kanlow体内的镉含量高, 镉积累量大, 表明耐镉性强的品种具有更高的镉富集能力。该品种可能更适合种植于镉污染土地上, 作为能源植物应用潜力巨大。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|