作者简介:孙丽坤(1987-),女,山东泰安人,讲师,博士。E-mail: sunlk_baby@126.com
分别以核糖体DNA(nuclear ribosomal DNA, nrDNA)的内转录间隔区(internal transcribed spacer regions, ITS)和两条叶绿体DNA(chloroplast DNA, cpDNA)片段— trnL-trnF, rps16为分子标记,研究了20个自然分布的中国柽柳群体遗传变异与环境因子和地理距离间的相关性。结果表明:ITS序列(616 bp)中共发现了10个多态位点,定义了11种单倍型;总核苷酸多样性和总单倍型多样性分别为2.170和0.814。两个cpDNA分子标记片段的拼接序列(1542 bp)中共发现了14个多态位点,定义了16种单倍型,总核苷酸多样性和总单倍型多样性分别为0.500和0.586。ITS遗传多样性与地理、气候和土壤因子间相关性分析显示:海拔、温度和经度是影响中国柽柳群体遗传变异的主要因素。在低海拔、温暖和靠海近的湿润东部群体,ITS遗传多样性较高。而cpDNA的遗传变异与各种环境因子间没有显著的相关性。Mantel检测发现中国柽柳ITS的遗传变异与地理距离显著正相关,而cpDNA的遗传变异没有显著的地理渐变趋势,该结果进一步揭示了中国柽柳强大的种子流在降低群体间遗传分化上发挥了重要作用。
In this study, we examined the relationships between environmental factors and the genetic diversity of 20 Tamarix chinensis. populations throughout its native range. Genetic diversity was evaluated by comparing the sequences of nuclear ribosomal internal transcribed spacer regions (ITS) and two chloroplast DNA (cpDNA) regions ( trnL-trnF and rps16). Eleven haplotypes were identified on the basis of 10 variable sites within the 616 bp sequenced ITS region, and the total nucleotide diversity and haplotype diversity indexes were 2.170 and 0.814, respectively. Sixteen haplotypes were identified on the basis of 14 variable sites within the two chloroplast regions (1542 bp), and the total nucleotide diversity and haplotype diversity indexes were 0.500 and 0.586, respectively. The results showed that the genetic diversity based on the ITS region is influenced mainly by altitude, temperature, and longitude. Populations with rich genetic diversity exist at lower altitudes, in warmer habitats, and in eastern regions nearer to the sea. We detected no significant relationships between the genetic diversity of cpDNA and environmental variables. Using the Mantel test, a significant relationship was detected between matrices of ITS genetic differentiation and matrices of geographical distance, but this relationship was not detected from the cpDNA data. This result further proved that seed flow is an important factor contributing to the low genetic differentiation of T. chinensis populations.
任何一个物种的分布、行为、生理和遗传变异都受到环境因子的作用[1]。遗传多样性是物种不断适应生境的结果。当生境发生改变, 例如气温骤降、气候干旱化、土壤盐碱化等, 会使得种群的遗传多样性丧失[2]。反之, 一个物种适应环境的能力也取决于种群内部遗传变异的大小[3]。因此, 在遗传学和分子生态学领域, 种群的遗传变异与环境因子的相关性都是研究者关注的焦点[4, 5]。目前, 遗传多样性对环境因子的响应关系在云南松(Pinus yunnanensis)[6]、钝桴野大麦(Hordeum spontaneum)[7]、岩生植物金发草(Pogonatherum paniceum)[8]、小叶锦鸡儿(Caragana microphylla)[9]、西番莲属(Passiflora)[10]等物种上被报道。
编码核糖体的基因(nuclear ribosomal DNA, nrDNA)是一个重要的植物分子标记片段[11]。nrDNA内转录间隔区(nuclear internal transcribed spacer, nrITS)常用于群体遗传学研究[12, 13]。被子植物的叶绿体DNA(chloroplast DNA, cpDNA)是母系遗传, 遗传漂变使得单亲遗传的基因中累积的遗传分化更大[11]。同时叶绿体DNA具有拷贝数多、分子量小、序列保守、设计通用引物方便、原核性和不参加基因重组等优点[14], 常用于研究植物的遗传变异和物种进化历史。
中国柽柳(Tamarix chinensis)隶属于柽柳科(Tamaricaceae), 柽柳属(Tamarix)。柽柳属起源于早第三纪始新世的古地中海沿岸地区, 并随着晚第三纪古地中海的退缩、气候逐渐干旱而得到进一步发展, 产生了许多以温带成分为主、适应干旱、盐碱环境的现代柽柳属物种[15]。中国柽柳天然分布于华北、华东、华南、东北、西北的部分地区, 耐盐碱、贫瘠、水湿和干旱, 适应性强, 能够在盐碱地、沙荒地等极端环境中建群, 且能通过盐腺分泌盐分和有害离子[16], 其生态价值显著。
张娟等[17]利用RAPD技术(随机扩增片段多态性DNA, random amplification polymorphic DNA)研究表明新疆境内刚毛柽柳(Tamarix hispid)群体间的遗传分化为6.25%, 群体内遗传多样性丰富。赵景奎[18]用RAPD技术研究发现黄河三角洲3个中国柽柳群体间存在频繁地基因交流, 92.83%的遗传变异发生在群体内。推测与该植物种子能够借助风、水等进行空间扩散有关。李锐[19]用EST-SSR(表达序列标签-简单重复序列, expressed sequence tags, simple sequence repeats)方法对6个中国柽柳群体的遗传变异研究发现:Nei多样性指数(h)平均为 0.456, 香农(Shannon)多样性指数(I)平均是1.776, 群体间的变异仅占8.04%, 进一步分析发现由于群体之间生境相似, 受到的选择压力相近, 其进化方向趋同, 使得群体间的遗传变异较小。Jiang等[20]利用SSR(简单重复序列, simple sequence repeats)技术研究了黄河三角洲地区5个中国柽柳群体的遗传变异, 发现Nei多样性指数(h)和Shannon 多样性指数(I)分别是0.239、0.363, 且群体间的遗传变异小, 表明群体间存在频繁的基因交流。同时该研究还发现, 土壤盐度与遗传多样性呈显著负相关。
中国柽柳分布范围广泛, 枝叶繁茂, 在盐碱湿地、沙荒地具有绿化环境, 改良生态的作用。然而, 目前关于中国柽柳的研究多见于遗传多样性和遗传结构方面, 没有针对遗传变异与环境因素的响应研究。本研究采集了不同地理分布区域的中国柽柳群体, 在分析其遗传变异的基础上, 结合地理、气候和土壤因素等多个生态子, 探讨了影响遗传变异的主要环境因素, 为更好地利用该物种进行生态改良和修复提供科学的实践指导。
参照中国数字植物标本馆(http://www.cvh.org.cn)、《中国植物志》、国内各个地方植物志和一些文献中记载的中国柽柳分布区信息, 本课题组于2014年7月开始在中国柽柳分布范围内展开资源调查和样品采集工作, 对中国柽柳的现存分布区进行了野外调查, 并采集了包括滨海湿地、黄河三角洲或冲积扇平原、沙荒地、盐碱地、干旱地等生境的20个居群。这些居群分布在山东、江苏、河南、山西、陕西及甘肃局部, 记录群体的海拔、经纬度、生境(土壤和地形条件)等信息(表1)。由于种群内部种子扩散或者是无性繁殖会对遗传变异造成影响, 在采样时个体间间隔要求大于20 m, 每个群体采集5~10个个体, 采集新鲜幼嫩叶片, 装入信封后用硅胶干燥保存。
| 表1 中国柽柳各采样点信息 Table 1 Information about sampling localities of T. chinensis |
1.2.1 植物总 DNA 提取、目的片段扩增与测序 中国柽柳叶片DNA的提取采用 Omega 公司提供的植物DNA提取试剂盒(HP Plant DNA Kit), 具体步骤按说明书进行操作。对4条叶绿体 DNA(cpDNA)片段筛选进行, 最终确定2条cpDNA 片段(trnL-trnF, rps16)用于叶绿体遗传多样性分析。用于PCR扩增的引物及其文献来源见表2。
| 表2 PCR筛选中使用的引物 Table 2 Primer pairs used for PCR amplification and sequencing |
扩增采用25 μ L体系, 其中包括正反引物各1 μ L(10 mmol· L-1), DNA模板1 μ L, 12.5 μ L的PCR mix(包括10X buffer, Mg2+, dNTP和Taq酶), 9.5 μ L的去离子水。PCR扩增中相应片段退火温度见表2, 72 ℃延伸1 min 30 s。PCR扩增采用An S1000TM thermo cycler(Bio-Rad, CA, USA)。PCR扩增产物用1.5%的琼脂糖凝胶电泳检测, 挑选条带单一无拖尾PCR产物进行纯化并利用扩增引物(表2)进行测序, 采用华诺科技ABI 3730 测序分析仪完成。
1.2.2 气候数据获取 选取了中国柽柳20个研究点的年平均温度(mean annual temperature, MAT)、年平均降水量(mean annual precipitation, MAP)、年最高温(highest temperature, HT)、年最低温(lowest temperature, LT)、夏季平均气温(summer mean temperature, SMT)和夏季平均降水量(summer mean precipitation, SMP), 冬季平均温度(winter mean temperature, WMT)、冬季平均降水(winter mean precipation, WMP)。本研究还采用了干旱指数(aridity index, AI)分析了湿润度对中国柽柳遗传多样性的影响[25]。气象资料来源于2014年地面气象资料(http://data.cma.cn/)。根据研究点从680个气象台站中选择相应的台站资料。
1.2.3 土壤理化性质的测定 将土壤样品风干, 剔除石块、植物根系等, 磨碎过80目(0.18mm)筛, 待分析检测。土壤pH、土壤有机碳(soil organic carbon, SOC), 全氮(soil total nitrogen, STN)采用德国耶拿公司生产的碳氮分析仪Multi N/C 2100S (elementar Vario-EL, Germany)进行测定。土壤全磷(soil total phosphorus, STP)的测定采用钼酸盐/抗坏血酸-钼蓝比色法。
利用 DnaSP Version 5.0 分别计算每个中国柽柳群体的ITS、cpDNA的核苷酸多样性(nucleotide diversity, Pi)和单倍型多样性(haplotype diversity, h), 其中插入缺失(indels)多态性未计算在内。在PAST软件中, 利用核苷酸多态性和单倍型多态性的结果, 基于布雷柯蒂斯(Bray-Curtis)方法对中国柽柳20个群体进行聚类。在SPSS 19.0软件中, 进行环境因子间的主成分分析, 并用群体的遗传多样性与地理因子(经度、纬度及海拔)、气候因子(MAT, SMAT, HT, LT, WMT, MAP, SMP, WMP, AI)和土壤因子(SOM, STN, STP, pH)之间进行皮尔森相关性分析, 检验遗传多样性与环境因子间的关系。群体遗传多样性(Pi和Hd)与环境因子间的相互关系在CANOCO V4.5采用冗余分析(redundancy analysis, RDA)。考虑到群体间遗传距离的差异可能导致遗传分化, 因此用DnaSP软件计算群体间的遗传分化FST, 同时计算各居群采样点间的直线地理距离矩阵, 利用Mantel test通过在线软件IBDWS 3.2.3(Available at http://ibdws.sdsu)计算遗传距离和地理距离之间的相关性(r值), 运行 1000次重复抽样检验显著性。
在105个中国柽柳样本的ITS 序列(616 bp)中, 共发现了10个多态性位点, 定义了11种单倍型。在135个中国柽柳trnL-trnF, rps16联合序列(1542 bp)中, 共发现了14个多态性位点, 定义了16种单倍型。其中, 中国柽柳ITS总核苷酸多样性和总单倍型多样性分别为2.170和0.814。叶绿体片段的总核苷酸多样性和总单倍型多样性分别为0.50和0.59(表3)。基于ITS和cpDNA的核苷酸多样性和单倍型多样性进行聚类分析, 结果表明20个群体可以分为两大支, 甘肃白银、兰州和陕西定边的一个群体聚为一支, 其他17个群体聚为一支(图1)。
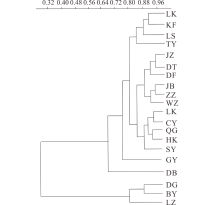 | 图1 基于ITS和cpDNA核苷酸多样性和单倍型多样性的聚类分析Fig.1 Cluster analysis base on nucleotide and haplotype diversity of ITS and cpDNA |
| 表3 中国柽柳群体ITS和cpDNA单倍型分布及遗传信息 Table 3 Nucleotide diversity (Pi) and haplotype diversity (Hd) of ITS and cpDNA in 20 population of T. chinensis |
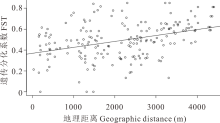
基于母系单亲遗传的cpDNA序列和双亲遗传的ITS序列, 计算得出群体间的遗传分化FST, 同时得到各居群采样点间的直线地理距离矩阵。结果表明ITS群体间的遗传分化系数进行估算值为0~0.48, 而cpDNA群体间分化系数估算值仅为0~0.17, 有些甚至是负值, 群体间遗传分化小。通过Mantel test对群体进行距离隔离(isolation by distance, IBD)检测, 以便分析群体之间的遗传距离与地理距离是否具有显著相关性。ITS结果表明(图2), 遗传分化系数与地理距离存在显著的正相关关系(r=0.399, P< 0.001), 即随着群体间分布距离的增大, 遗传距离显著增大。但cpDNA遗传分化系数与地理距离间没有显著的相关关系(r=0.103, P=0.17)。
皮尔森相关分析结果表明:cpDNA的核苷酸多样性和单倍型多样性与各种环境因子间没有显著的相关性(表4)。ITS核苷酸多样性(Pi)和单倍型多样性(h)均与经度极显著正相关(P< 0.001), 经度越大, 遗传多样性越高。而两者与海拔均极显著负相关(P< 0.001)。从气候因素上看, 温度是影响ITS遗传多样性的重要因素, 核苷酸多样性(Pi)和单倍型多样性(h)与年平均气温、年最低温、年最高温、夏季和冬季平均气温都显著正相关。而冬季平均降水仅与核苷酸多样性(Pi)正相关。干旱指数对遗传多样性没有显著影响。土壤养分和pH对ITS遗传多样性均没有显著影响(表4)。为了对所有的环境因子进行降维和排序, 利用冗余分析(RDA)发现海拔与ITS遗传多样性负相关, 温度与ITS遗传多样性正相关(图3)。
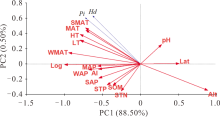 | 图3 基于ITS核苷酸多样性和单倍型多样性与16个环境因子的冗余分析Fig.3 Bi-plot from the redundancy analysis (RDA) analysis based on Pi, Hd of ITS and 16 environmental variables |
| 表4 核苷酸多样性和单倍型多样性与环境因子的皮尔森相关分析 Table 4 The pearson correlation analysis between nucleotide diversity, haplotype diversity and environmental variables |
由于以上16个环境因子间存在共线性, 本研究进一步对它们进行主成分分析(表5), 结果表明, 第一个主成分可解释原始变量的 56.752%, 从主成分的变量来看, 主要为冬季平均温度、经度和海拔(表6); 第二主成分解释24.168%, 主要为土壤有机碳、全年最高温度和夏季平均温度(表6)。前两个主成分累计解释变量达到80.920%(表5)。从以上结果可以发现, 温度、海拔和经度(海陆关系)是影响中国柽柳分布的最主要的环境因子。
| 表5 中国柽柳环境因子的主成分分析 Table 5 Principal component analysis of environmental |
| 表6 16个环境因子在前3个主成分轴上的载荷 Table 6 The factor loadings of 16 environmental variables on the three principal components (PC) axes |
本研究分别以ITS和cpDNA片段作为分子标记, 来检测中国柽柳的群体遗传多样性及其与环境因子之间的相关性。结果揭示了该物种高水平的遗传多样性, 得到中国柽柳ITS总核苷酸多样性(HT)为0.803, 高于一般针阔叶树种0.206[18], cpDNA总核苷酸多样性(HT)为0.635, 大于张如华[26]用cpSSR研究得到的东部10个中国柽柳HT(0.284), 具有较为丰富的遗传多样性, 但种群间的遗传分化较低, 主要是由于中国柽柳具有较长的进化历史, 分布范围广, 分布区内气候、土壤等条件存在巨大差异, 在长期自然选择的作用下产生了广泛的遗传变异, 种内具有丰富的遗传多样性。其中, ITS序列的分析结果显示江苏戗港的核苷酸多样性最高, 而山东河口的单倍型多样性最高。cpDNA片段结果显示陕西定边(DB)核苷酸多样性最高, 而山西灵石的单倍型多样性高。两种分子标记所反映出来的各种群体遗传多样性水平不一致, 此外, ITS序列的核苷酸多样性也远远大于cpDNA的。
本研究表明ITS群体间的遗传分化系数估算值为0~0.48, 不同群体间差异较大, 其中甘肃白银群体、兰州群体和陕西定边(DG)群体与其他群体间FST为0.078~0.479, 表明这3个群体与其他群体间的分化较为明显。20个群体的聚类结果也说明了这一结论。依据距离隔离检测, ITS遗传距离具有显著的地理渐变趋势。表明地理距离是中国柽柳ITS遗传变异分布产生的机制。而母系遗传的cpDNA的遗传分化没有表现出显著的地理格局。中国柽柳是两性花, 交配系统以异交为主的兼性自交, 世代周期长, 一年多次开花结种, 繁殖能力强等特点可能是造成群体内遗传多样性较高的原因。且该植物群体间隔障碍少, 种子和花粉能够借助风、水等空间扩散导致基因流较大。在被子植物中, cpDNA是母系单亲遗传(种子), 而ITS是双亲遗传(花粉和种子)。比较而言, ITS的总遗传多样性比cpDNA的大, 这种差异一方面是由于ITS片段突变速率快, 遗传多样性高, 且更容易受到环境压力的选择, 地理距离近的群体选择压力相近, 进化的方向趋同, 使得相近环境中的遗传变异趋近; 另一方面说明种子扩散对中国柽柳贡献更大, 使得cpDNA具有很大的基因流, 实现不同居群之间的遗传变异的均质化, 因此没有表现出明显的地理分化。张如华[26]研究中国柽柳花粉-种子迁移率为7.1674, 比中等迁移率(17)低一半还多, 也说明历史积累的种子流作用更大。
除考虑地理距离外, 生态因子也可能影响群体间的分化。进一步分析中国柽柳遗传变异环境因子间相关性发现, 不同环境因子对中国柽柳遗传多样性的选择压力不同, 温度、海拔和经度(海陆关系)与ITS的遗传多样性显著相关。分布在温暖、低海拔和相对湿润地区, 如江苏、山东的群体遗传多样性较高; 分布在寒冷、高海拔和干燥地区, 如甘肃、陕西的群体则反之。海拔、温度梯度是影响许多物种多样性的重要环节因子。研究发现, 云南松在低纬度、低海拔、温暖、降水量多的环境下遗传多样性丰富[6], 低海拔区域小叶锦鸡儿群体的遗传多样性高于高海拔区域的群体, 说明随着海拔高度的增加, 居群间的基因流受到阻碍[27]。我国北方油松(Pinus tabulaeformis)的遗传多样性主要受温度、海拔及年降水量的显著影响[28]。本研究没有发现土壤因子与遗传多样性的相关性。这与Jiang等[20]研究发现的中国柽柳的遗传多样性与土壤盐度呈显著负相关的结果不一致, 可能与局域的采样区和群体数目有关。综上可以看出, 中国柽柳在海岸滩涂地、湿地中遗传多样性高, 群体更稳定, 适应性更强, 能很好地发挥生态恢复的功能。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|