作者简介:李小冬(1984-),男,湖南邵阳人,副研究员,博士。E-mail: lixiaodongzl@163.com
高温能危害植物的生长发育,是限制紫花苜蓿在南方地区推广的主要非生物胁迫因素之一。从“中苜1号”紫花苜蓿品种克隆获得紫花苜蓿多桥蛋白1c( Medicago sativa Multi protein Bridging Factors 1c, MsMBF1c)全长编码序列,发现紫花苜蓿MsMBF1c蛋白与拟南芥AtMBF1c蛋白同源相似性高达72%。分析 MsMBF1 c在根、茎、叶、花和果实等不同组织中,以及在高温、干旱以及高温和干旱组合胁迫条件下的表达模式,发现该基因在不同组织中的表达强度依次为花>根>叶>茎>果实; MsMBF1 c显著受高温、干旱以及高温和干旱组合诱导,分别被上调4.21、2.15和4.59倍。构建pBI121-35S: MsMBF1 c过量表达载体并转入模式植物拟南芥(wild type, WT),在T3代获得卡那抗性不分离的过量表达株系(over expression, OE);利用OE与 Atmbf1 c突变体(mutant, MUT)杂交的方法获得互补株系(complementary, COM),并通过PCR与qRT-PCR的方法进行分子和表达验证。平行比较OE、COM、MUT以及WT等不同拟南芥株系在高温胁迫后的种子发芽率和幼苗存活率,在正常情况下,OE、COM、MUT以及WT拟南芥株系种子的发芽率没有显著差异(97.6%~100.0%),高温胁迫后,WT发芽率下降到71.7%,MUT发芽率下降到66.0%,显著低于WT( P<0.05);而COM与3个独立的OE株系的发芽率达79.3%~87.0%,显著高于WT( P<0.05)。在幼苗耐热试验中,OE、COM、MUT以及WT株系的存活率在正常条件下差异不显著,高温胁迫后,WT幼苗存活率下降到16.7%,MUT下降到10.0%,显著低于WT( P<0.05);而COM与3个独立的OE株系存活率下降到40.0%~76.7%,显著高于WT( P<0.05)。利用real-time PCR方法,分析 HSFA1 a、 HSFA2、 HSFA3、 HSFB1、 WRKY25、 WRKY18、 DREB2 a等耐热调节关键基因在OE、MUT和WT拟南芥株系的相对表达情况,在正常条件下, HSFA2、 WRKY18与 DREB2 a在MUT株系中的表达显著低于WT(0.33~0.47)。而在OE株系中,除 HSFA1 a外, HSFA2、 HSFA3、 HSFB1、 WRKY25、 WRKY18、 DREB2 a的表达相对WT株系都有不同程度上调,幅度为1.74~3.80。高温胁迫后,与WT相比, HSFA2、 HSFA3、 HSFB1、 WRKY18与 DREB2 a在MUT株系中的表达中被显著下调,在OE株系中,只有 WRKY18显著高于WT外,其余基因的表达在OE与WT株系中差异不显著。综合分析, MsMBF1 c是一个功能比较保守的耐热调节基因,过量表达 MsMBF1 c能够互补拟南芥 mbf1 c突变体耐热缺失表型,并能够增强拟南芥在种子萌发与幼苗生长阶段的耐热性。 MsMBF1 c可能与 AtMBF1 c一样,与其他耐热调节关键基因互作调节植物耐热性。
High temperature negatively affects plant growth and development, and is one of the major abiotic stress factors limiting the growth of alfalfa ( Medicago sativa) in southern China. The full-length coding sequence of the gene encoding Multi protein Bridging Factor 1 c ( MsMBF1 c) was isolated from the alfalfa variety “Zhongmu 1”. The MsMBF1c protein in alfalfa was found to be homologous to AtMBF1c in Arabidopsis thaliana, with 72% similarity at the amino acid sequence level. The transcript levels of AtMBF1c were measured in the root, stem, leaf, flowers, and fruit; and changes in transcript levels were monitored under high temperature, drought, and the combination of these stress conditions. The highest transcript level of MsMBF1 c was detected in the flowers, followed by the root, leaf, stem, and fruit. MsMBF1 c was induced by high temperature, drought, and their combination (up-regulated by 4.21, 2.15, and 4.59 fold, respectively). The pBI121-35S: MsMBF1 c overexpression vector was constructed and transformed into wild-type (WT) Arabidopsis seedlings. Overexpression (OE) lines without the separation of kanamycin resistance were obtained in the T3 generation. The OE lines were then crossed with the mbf1 c mutant (MUT) to generate complementary lines (COM). The presence of the transgene in the plant materials was confirmed by PCR, and the transcript levels of AtMBF1c and MsMBF1 c were determined by qRT-PCR. To evaluate the heat resistance conferred by MsMBF1c, the seed germination rates and seedling survival rates were determined for the OE, COM, MUT, and WT Arabidopsis lines. The seed germination rates differed slightly among the OE, COM, MUT, and WT lines (97.6%-100.0%) under normal conditions ( P>0.05). After a heat stress treatment, the germination rate of WT decreased to 71.7%; that of the MUT line decreased to 66.0%, significantly lower than that of WT ( P<0.05); and those of three individual OE lines and the COM line decreased to 79.3%-87.0%, significantly higher than that of WT ( P<0.05). The seedling survival rate did not differ significantly among the OE, COM, MUT, and WT lines under normal conditions. However, after a heat stress treatment, the survival rate of WT decreased to 16.7%; that of MUT decreased to 10.0%, significantly lower than that of WT ( P<0.05); and those of three individual OE lines and the COM line decreased to 40.0%-76.7%, which were significantly higher than that of WT ( P<0.05). The expression levels of genes encoding key regulators, including HSFA1 a, HSFA2, HSFA3, HSFB1, WRKY25, WRKY18 and DREB2 a were analyzed in the OE, MUT, and WT lines by real-time PCR. Under normal conditions, the transcript levels of HSFA2, WRKY18, and DREB2 a were low in the MUT line (0.33-0.47 of that in WT); while the transcript levels of HSFA2, HSFA3, HSFB1, WRKY25, WRKY18 and DREB2 a in the OE lines were 1.74 to 3.80 fold their respective levels in WT. After heat stress, compared with WT, the MUT line showed significantly decreased transcript levels of HSFA2, HSFA3, HSFB1, WRKY18, and DREB2 a, and the OE lines showed increased transcript levels of WRKY18 but none of the other tested genes. In conclusion, MsMBF1 c is a functional conserved gene in the heat regulation pathway. Overexpression of MsMBF1 c can complement the thermotolerance deficiency of the mbf1 c mutant, and also enhance the thermotolerance of Arabidopsis at the seed germination and young seedling stages. The function of MsMBF1 c may be similar to that of AtMBF1 c, which regulates plant thermotolerance with other key heat resistance genes.
热害是影响植物生长发育的主要环境胁迫因素之一, 这种危害对冷季型植物危害更大。植物耐热性由复杂而精细的基因调控网络控制, 通过一系列基因表达变化, 可以使植物应对一定范围内的温度升高而存活[1]。紫花苜蓿(Medicago sativa)是典型的冷季型牧草作物, 也是草畜产业发展的核心牧草品种之一。南方季节性与区域性高温等气候因素限制了紫花苜蓿在长江以南的地区的推广, 研究紫花苜蓿耐热调控关键基因功能对培育南方对适应性强的耐高温紫花苜蓿品种有一定的指导意义。
前人也针对紫花苜蓿耐热性从表型、生理等角度开展了相关研究。在温控条件下, 高温胁迫使紫花苜蓿生长受到抑制, 植株产量降低54%, 叶片叶面积缩小至常温的1/4, 但叶片厚度增加了54%, 高温是生产中紫花苜蓿夏季减产的一个重要原因[2]。斯达等[3]研究高温期非秋眠紫花苜蓿的生长状态以及高温期刈割对紫花苜蓿再生产量及品质的影响, 发现刈割时期对紫花苜蓿品质的影响要大于品种间的差异。邵辰光等[4]与赵雁等[5]分别以高秋眠级耐热型‘ 赛迪10’ 和低秋眠级热敏型‘ 阿尔冈金’ 为对照, 分析南方紫花苜蓿品种‘ 德钦’ 在高温胁迫后叶片内植物激素和多胺等含量的变化, 发现紫花苜蓿耐热性与脱落酸、吲哚乙酸以及亚精胺等含量呈正相关, 而与赤霉酸、腐胺和精胺含量呈负相关。
尽管对紫花苜蓿耐热表型和生理已有较多研究, 然而对其耐热的分子基础研究还比较少, 主要集中在热激转录因子(heat stress transcription factor, HSF)和热激蛋白(heat stress protein, HSP)。如通过转基因研究的方法, 过量表达紫花苜蓿MsHSP23基因增强了匍匐剪股颖(Agrostis stolonifera)的耐热性[6]。高通量分析的方法在紫花苜蓿中也被广泛应用, 将紫花苜蓿、大豆(Glycine max)和百脉根(Lotus japonicus)的已知基因组信息与拟南芥(Arabidopsis thaliana)比对分别发现了21、25和19个HSF基因, 并且其中70%的HSF候选基因都与非生物胁迫相关[7]。在紫花苜蓿叶片中, 通过差减杂交法筛选到10个受温度(高温/低温)诱导表达的基因[8]。
在模式植物拟南芥中, 已经对植物的耐热机制进行了系统的研究, 鉴定了许多耐热调节的关键基因, 并建立了一个以HSF为核心的耐热调控模型[9]。HSF通过结合热激元件(heat stress element, HSE)激活高温应答基因的表达, 是植物耐热调节的主要途径。在拟南芥中, HSFA1、HSFA2、HSFA3、HSFA7a和HSFB等热激转录因子能调节植物的耐热性, 而且许多HSPs与其他抗热相关基因受到这些基因调节。最近的研究发现除了HSF-HSP核心途径外, 植物的抗热性还存在其他的调控枢纽, 而MBF1s家族基因就是其中之一。在动物[10, 11]、真菌[12, 13]中, MBF家族基因广泛参与多种生物和非生物胁迫反应。拟南芥MBF1c基因显著受热诱导, mbf1c突变体对高温敏感[14], 而且AtMBF1能够互补酵母(Saccharomyces cerevisiae)mbf1突变体热敏感表型[15]。在小麦(Triticum aestivum)中, TaMBF1c的表达显著受高温诱导, 过量表达TaMBF1c能显著提高酵母和水稻(Oryza sativa)的耐热性[16]。MBF家族基因在两个不同葡萄(Vitis vinifera)品种中均受高温与干旱胁迫诱导[17]。分析耐热性存在显著差异的两个剪股颖草的转录组发现MBF1c基因显著被热诱导[18]。然而在紫花苜蓿中, MBF1c家族基因还没有被深入研究。
本研究从紫花苜蓿“ 中苜1号” cDNA中克隆了MsMBF1c基因, 其蛋白与拟南芥AtMBF1c蛋白同源相似性高达72%, 参照动植物中MBF1家族基因已有研究成果, 该基因可能是一个紫花苜蓿逆境胁迫调控的核心基因, 需要进一步研究其功能和调控机理。本研究分析了MsMBF1c基因在紫花苜蓿不同组织, 以及在高温、干旱和高温与干旱组合等逆境胁迫下的表达模式。通过平行比较拟南芥MsMBF1c过量表达株系、mbf1c突变体、互补株系、以及野生型植株在种子萌发和幼苗生长阶段的耐热性, 考察MsMBF1c在植物抗热反应过程中的功能, 并从基因调控网络等角度对其功能进行了初步鉴定与研究, 为进一步剖析MsMBF1c基因在高温胁迫下的分子作用机制提供有价值的参考, 并为紫花苜蓿分子遗传改良及转基因新品种的培育提供重要的基因资源。
紫花苜蓿品种“ 中苜1号” 由中国农业科学院北京畜牧兽医研究所高洪文研究室馈赠, 拟南芥哥伦比亚型野生型(wild type Col-0, 以下简称WT)和Atmbf1c T-DNA突变体(编号:SALK_083813C, 以下简称MUT)从拟南芥生物资源中心(Arabidopsis biological resource center, ABRC)购买。在人工气候室中种植拟南芥与紫花苜蓿, 其生长条件参考Li等[19]的方法, 具体参数如下:温度为22 ℃, 湿度为60%, 光照强度为230~300 μ E· m-2· s-1, 光周期为16 h光照/ 8 h黑暗, 试验时间为2014-2017年。
1.2.1 RNA提取与反转录 植物总RNA采用TRIZOLTM Kit RNA提取试剂(Invitrogen, USA)进行提取[20], 拟南芥取7 d的幼苗(包括根), 紫花苜蓿参照说明的时间和部位进行取样, 每份样品100 mg, 具体提取方法如下:用液氮研磨, 加入到1 mL Trizol试剂中, 上下颠倒, 室温(20~25 ℃, 下同)放置10 min, 加入200 μ L氯仿, 在涡旋振荡仪(VORTEX -GENIE 2T, 上海)上剧烈振荡30 s, 室温放置5 min, 12000 r· min-1, 4 ℃, 离心10 min, 取500 μ L上清至新离心管中, 加入1 mL无水乙醇, 混匀后-20 ℃放置20 min, 12000 r· min-1, 4 ℃, 离心10 min, 倒掉上清, 加入1 mL预冷的 75%乙醇(用0.05% DEPC H2O按照体积比稀释), 10000 r· min-1, 4 ℃, 离心10 min, 倒掉上清, 空气干燥15 min, 加20~30 μ L RNase-free H2O 50~60 ℃溶解5 min。反转录采用MBI公司的RevertAid H Minus First Strand cDNA Synthesis Kit (Fermentas), 具体试验流程参照试剂盒说明书。
1.2.2 紫花苜蓿MsMBF1c基因的克隆、序列分析与表达载体构建 以紫花苜蓿叶片cDNA为模板, MsMBF1c F与MsMBF1c R引物组合, 采用phusion DNA聚合酶扩增试剂盒(Thermo, 上海)进行扩增, 引物序列为, MsMBF1c F:5'-ACTCCCGGGATGTCAGGTCTAGGCCATATTTCTC-3'(SmaⅠ 接头); MsMBF1c R:5'-CTAGAGCTCTCATTTCTTGCCACGCAGTTTAG-3'(SacⅠ 接头)。反应体系为:5× high-fidelity 缓冲液, 4 μ L; dNTP mix, 0.5 μ L; MgCl2, 1.5 μ L; MsMBF1c F, 1 μ L; MsMBF1c R, 1 μ L; DNA模板, 2 μ L; DNA Polymerase, 0.2 μ L; dd H2O, 10 μ L。扩增程序为:94 ℃ 3 min, 94 ℃ 30 s, 72 ℃ 30 s, 28个循环, 72 ℃ 10 min, 25 ℃ 5 min, 反应结束。采用凝胶回收试剂盒(SK8131, 上海生工)将扩增产物连接到pEASY-Blunt克隆载体(pEASY-Blunt Cloning Kit, Transgene), 进行测序分析。MsMBF1c蛋白序列比对采用Clustal X 1.83软件分析, 并利用BioEdit软件对比对序列进行编辑。
提取pEASY-MsMBF1c(gene)载体质粒, 与pBI121载体一起, 分别利用SmaⅠ 与SacⅠ 双酶切, 回收线性化的pBI121载体片段和MsMBF1c (gene)片段, 用T4连接酶(Fermentas)连接构建pBI21-35S:MsMBF1c过量表达载体, 并将该载体通过CaCl2转化法转化到农杆菌GV3101菌株备用。
1.2.3 紫花苜蓿MsMBF1c基因的组织特异性表达与诱导表达 组织特异表达的取样时期与部位为:根、茎、叶分别取播种后20 d的紫花苜蓿幼苗, 花选取盛花期开放的花朵, 果实选取开花后5~7 d的幼嫩角果。对于诱导表达材料的准备, 将播种后28 d的紫花苜蓿幼苗, 分成4组, 第1组为对照, 正常浇水, 正常生长温度; 第2组为干旱处理组, 在正常温度下, 持续干旱处理7 d; 第3组为高温处理组, 正常的浇水条件, 在40 ℃持续高温条件下处理1 h; 第4组为高温与干旱组合处理组, 持续干旱7 d, 每天温度变化, 9:00 am-5:00 pm为38 ℃, 5:00 pm-次日9:00 am为22 ℃, 取相应处理后的叶片组织进行表达分析。RNA提取与反转录参考材料与方法1.2.1。MsMBF1c基因的表达采用real-time PCR的方法, 采用GoTaq Real-Time PCR Systems(Promega, A6001)试剂盒, 操作方法按照说明书。引物为qMsMBF1c F:5'-CAATGAGAAGCCTCAAGTGATCCA-3', 与qMsMBF1c R:5'-TGCCACGCAGTTTAGCTCCAAG-3'。内参基因为紫花苜蓿3-磷酸甘油脱氢酶(Glycerol-3 phosphate dehydrogenase, GPDH)基因, qMsGPDH F: 5'-CAAACATGGGAGCATCCTTACTAG-3', qMsGPDH R: 5'-GTTTTTACCGACAAGGACAAAGCT-3'。SYBR荧光信号用Eppendorf replax 2仪器进行检测, 反应程序为94 ℃ 2 min, 94 ℃ 15 s, 58 ℃ 15 s, 72 ℃ 30 s, 读取荧光信号, 45个循环, 72 ℃ 5 min, 25 ℃ 5 min。采用2-Δ Δ ct方法分析MsMBF1c的表达变化, 每个样品设3个生物学重复, 每个生物学重复设3个技术重复。
1.2.4 MsMBF1c过表达拟南芥株系以及mbf1c T-DNA突变体互补系的获得 拟南芥的转化采用浸花法[21], 将携带pBI121-35S: MsMBF1c转化基因的农杆菌用诱导培养基悬浮[5%蔗糖溶液, 加0.02%的 Silwet L-77(上海生工)], 将WT拟南芥的花蕾在悬浮菌液中浸泡30 s, 收取T0代转基因种子。将T0代种子用75%乙醇表面消毒1 min, 用50% 84消毒液消毒3 min, 用无菌水清洗3~4次, 将其均匀铺布于1/2 MS+300 mg· L-1特美汀+50 mg· L-1卡那霉素的培养基中, 在人工气候室中培养15~30 d, 挑选绿色健壮的抗性植株移栽到营养土中进行繁殖, 直到T3代获得卡那抗性不分离的MsMBF1c过表达株系, 即为MsMBF1c过表达拟南芥株系(Arabidopsis MsMBF1c overexpression lines, 以下简称OE)。Atmbf1c T-DNA突变体互补系(complementary lines, 以下简称COM)通过OE与MUT进行有性杂交的方法获得, 后代中筛选mbf1c位点纯合且含有MsMBF1c过表达插入位点的株系用于表型与表达分析。
1.2.5 DNA提取与转基因拟南芥分子鉴定以及表达分析鉴定 拟南芥DNA提取采用Edwards DNA快速提取方法[21], 具体如下:取100 mg新鲜叶片组织放入无菌的1.5 mL离心管中, 加入400 μ L抽提缓冲液[200 mmol· L-1 Tris-HCl pH 7.5, 250 mmol· L-1 NaCl, 25 mmol· L-1 乙二胺四乙酸二钠(ethylene diamine tetraacetic acid disodium salt, EDTA-2Na), 0.5%十二烷基硫酸钠(sodium dodecyl sulfate, SDS)], 室温迅速研磨, 上下颠倒离心管混匀后, 静置10 min。12000 r· min-1, 室温离心10 min, 将上清转移到800 μ L预冷的无水乙醇中, -20 ℃沉淀1~2 h。12000 r· min-1, 室温离心15 min, 倒掉上清, 沥干DNA。加100 μ L无菌水充分溶解DNA备用。转基因材料检测采用新霉素磷酸转移酶基因(neomycin phosphor transferase, NPT), 引物组合为NPT F+NPT R和35S+MsMBF1c R, 引物序列为NPT F:5'-GAGGCTATTCGGCTATGACTG-3', NPT R:5'-ATCGGGAGCGGCGATACCGTA-3', 35S:5'-TCCCACTATCCTTCGCAAG-3'。mbf1c T-DNA插入检测引物为LBp1.3:5'-ATTTTGCCGATTTCGGAAC-3', mbf1c F:5'-ATCCAATGATAATAAGGCGGC-3', mbf1c R:5'-TAAAACCATTGAGCCAAATCG-3'。PCR采用2× Taq PCR反应试剂盒(上海生工), 并参照试剂盒说明书配制反应体系。PCR扩增程序如下:94 ℃ 3 min, 94 ℃ 30 s, 58 ℃ 30 s, 72 ℃ 30 s, 30个循环, 72 ℃ 5 min, 25 ℃ 5 min。分别取8 μ L PCR产物电泳检测。OE筛选转基因检测呈阳性的植株, 加代收种至T3代, 参照1.2.4中T0代抗性筛选的方法, 选取抗性不分离的株系用于表型考察与表达分析。COM筛选MsMBF1c转基因为阳性, 同时mbf1c插入位点纯合的植株用于后续分析。分析MsMBF1c与AtMBF1c在WT、MUT、3个独立的OE株系(#1, #7, #23)与COM中表达变化, 取7 d的幼苗提取RNA, 反转录后采用荧光定量方法检测, 引物组合分别为qMsMBF1c F+qMsMBF1c R与qAtMBF1c F+qAtMBF1c R(表1), 程序与方法参照1.2.1与1.2.3。
| 表1 荧光定量用到的引物序列 Table 1 Primer used in the real time PCR assay |
1.2.6 高温胁迫处理 参考Yu等[20]的方法, 采用1.2.4表面消毒方法将WT、3个独立的OE、MUT以及COM株系分别播种到1/2 MS培养基上, 4 ℃春化3 d。高温胁迫发芽率试验采用浸入法:将培养皿置于45 ℃水浴锅中热处理4.5 h后, 在人工气候室中生长7 d后统计发芽率, 对照组一直在人工气候室中生长。每平皿每材料处理30粒种子, 设置3个生物学重复。高温处理幼苗试验:将春化后材料置于人工气候室中生长3 d, 采用浸入法将培养皿在42 ℃水浴中处理25 min, 将处理后的材料转移到正常条件下生长7 d后统计存活率。
1.2.7 基因表达分析 在OE、MUT以及WT拟南芥材料中检测耐热相关基因的表达变化, 取样部位, 热处理方法, RNA提取、反转录以及荧光定量PCR检测参照1.2.1与1.2.3。利用Integrated DNA Technologies网站提供的引物设计软件设计表达检测的引物, 检测的基因及其引物序列见表1, 其中Actin7为内参基因。基因相对表达量采用2-Δ Δ Ct方法进行计算。
采用t检验分析表达差异显著性, 采用Excel 2010与PowerPoint 2010作图。
以紫花苜蓿叶片cDNA为模板克隆获得一个长度为429 bp的DNA序列(基因注册号:MK091391), 编码一个143个氨基酸的蛋白, 将该蛋白序列与拟南芥AtMBF1c蛋白序列比对发现, 两者同源相似性高达72%。
参照材料与方法中的取样时期与部位, 分析MsMBF1c在不同组织中的表达差异, 结果显示MsMBF1c在不同组织中都有表达, 其表达强度依次为:花> 根> 叶> 茎> 幼嫩角果, 花中的表达量最高, 是果实表达量的3.15倍(图1A)。在诱导表达中, 高温及干旱都能诱导MsMBF1c的表达, 与正常条件相比, MsMBF1c的表达被高温诱导了4.21倍, 被干旱诱导了2.15倍, 被高温与干旱组合处理诱导了4.59倍(图1B)。
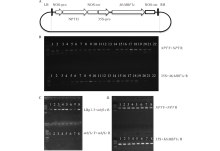
从诱导表达分析发现MsMBF1c在高温条件下强烈诱导表达, 为进一步探究MsMBF1c在调节植物耐热性中的功能, 采用了过表达转基因植株和突变体表型联合分析的方法。首先, 通过将pBI121-35S:MsMBF1c过量表达载体(图2A)对野生型拟南芥植株进行遗传转化获得MsMBF1c过表达OE材料。采用PCR分析的方法分析NPT与MsMBF1c两个基因的扩增效果, 22株抗生素筛选呈阳性的植株中, NPT显著扩增的有20株, MsMBF1c显著扩增的有18株(图2B)。选择抗性不分离的T3代过表达转基因植株和mbf1c T-DNA突变体杂交, 在 F3代中采用分子检测的方法筛选mbf1c位点, 其中LBp1.3与MsMBF1 R引物组合有明显扩增条带, 表示有插入片段; 因为插入片段过长, 而且插入位点为纯合体, 导致MsMBF1 F与MsMBF1 R引物组合没有显著扩增(图2C), 并且含有MsMBF1c过表达插入片段的植株(MsMBF1c OE/mbf1c)(图2D), 即为互补系COM材料, 或者为突变体背景的过表达材料。
分析AtMBF1c与MsMBF1c在WT、3个独立OE株系(#1、#7和#23)、MUT以及COM中的表达变化, 其中AtMBF1c在MUT和COM中没有表达, 在WT、3个独立OE株系正常表达, 但他们之间没有显著的差异。MsMBF1c在3个独立OE与COM株系中高丰度表达, 而在WT与MUT中没有检测到表达。
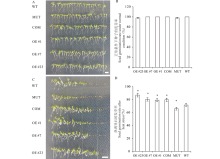
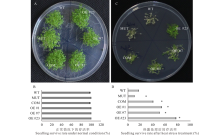
为了明确MsMBF1c对植物耐热性的调节作用, 利用拟南芥野生型(WT)、mbf1c突变体(MUT)以及上述筛选的MsMBF1c OE和COM材料进行高温处理后的种子萌芽和幼苗耐热性试验。在正常条件下, 4种材料之间的种子发芽率没有显著的差异(图4A, B), 而在高温处理后, MUT的发芽率显著比WT低, COM种子的发芽率和发芽势与3个独立OE株系(#1、#7和#23)均显著高于WT, 而COM与3个OE株系之间差异均不显著(图4C, D)。
不同材料的幼苗耐热存活率也存在显著差异。采用密植法播种待分析的材料, 在正常条件下, WT、MUT、COM以及OE株系之间的幼苗存活率没有显著差异(图5A, B), 而在高温处理之后, 所有株系的存活率与正常条件相比均有不同程度下降, 其中WT存活率下降到16.7%, 而 MUT的存活率下降到10.0%, 显著低于WT水平。COM和3个OE株系的的存活率均显著高于WT水平, 达40.0%~76.7%(图5C, D)。
为进一步探究MsMBF1c对植物耐热性调节的分子机制, 分析了拟南芥中已知的耐热调节关键基因在正常生长条件和高温处理后的WT、COM以及OE #23等株系中的表达变化, 共挑选了HSFA1a、HSFA2、HSFA3、HSFB1、WRKY25、WRKY18、DREB2a等7个基因。在正常条件下, HSFA2、WRKY18与DREB2a在MUT中的表达显著低于在WT中的表达水平, 而HSFA1a、HSFA3、HSFB1、WRKY25等基因的表达与在WT中的表达量差异不显著。在OE株系中, 除HSFA1a外, HSFA2、HSFA3、HSFB1、WRKY25、WRKY18、DREB2a的表达相对WT中都有不同程度上调, 表达量为在WT的1.74~3.80倍范围。
高温处理后, 所有检测基因在WT、COM以及OE #23等株系中的表达都比在正常条件下升高, 但在不同材料中差异较大(2.54~7.26)。与WT相比, 高温处理后HSFA2、HSFA3、HSFB1、WRKY18与DREB2a在MUT中的表达仍被显著下调, 而HSFA1a与WRKY18的表达与WT不显著。在OE株系中, 除WRKY18显著高于在WT的表达水平外, 其余基因的表达在OE与WT两个材料间差异不显著。
MBF1在原核生物和真核生物中十分保守, 通过连接不同的DNA结合蛋白和TATA-box结合蛋白(TATA-binding protein, TBP)增强目标基因的转录[22], 从紫花苜蓿中获得的MsMBF1c蛋白与拟南芥MBF1c蛋白同源相似性高达72%, 表明其可能也具有保守的参与调控植物耐热性的功能。
在植物中MBF家族基因可能通过与多种激素或其他信号分子互作参与非生物逆境胁迫应答。辣椒(Capsicum annuum)CaMBF1的表达显著被水杨酸、高盐、渗透压以及重金属胁迫抑制, 而过量表达CaMBF1能降低植株对冷害胁迫的耐受能力[23]。过量表达玉米MBF1a基因能增强拟南芥的耐盐能力, 可能与乙烯与葡萄糖信号通路相关[24]。在西红柿(Lycopersicon esculentum)中过量表达MBF1基因能显著诱导水杨酸(salicylic acid, SA)信号途径标志基因PR1与PR6等的表达, 并增强植物的抗病性[25]。最近的研究发现过量表达南极洲苔藓(Polytrichastrum alpinum)的MBF1c能够增强拟南芥的耐盐性[26]。大量的报道也表明植物MBF1基因是一个重要的抗热(或干旱)调节基因。在高温和干旱处理后的拟南芥转录组中检测到AtMBF1c显著被诱导[27]。拟南芥AtMBF1能够互补酵母mbf1突变体热敏感表型[15]。拟南芥mbf1c突变体对高温敏感, 这种表型能够被MBF1c恢复[14]。过量表达小麦TaMBF1c能显著提高酵母和水稻的耐热性[16]。在葡萄[17]和剪股颖[18]也有MBF1家族基因参与耐热调节的报道。在本研究中MsMBF1c的表达能够显著被高温和干旱诱导, 而且MsMBF1c能够互补拟南芥mbf1c突变体在种子萌发以及幼苗生长阶段耐热能力的缺失, 并且显著增强野生型拟南芥的耐热性。说明MBF1c基因在植物耐热调节中是一个十分重要的功能保守基因。
为分析MsMBF1c在植物耐热调节反应中的地位, 本研究分别检测了野生型、mbf1c突变体以及MsMBF1c过量表达株系在正常和热诱导后的HSF家族与WRKY家族部分基因和DREB2a的表达变化, 在不同材料中这些基因都能受高温显著诱导, 但是诱导表达的程度差异较大, 原因在于这些基因在调节植物耐热反应中所处的途径和地位不同。HSFA1a的表达变化在3种材料中差异不大, 说明HSFA1a可能位于MBF1c的上游(或不处于同一条调控途径), 这与在拟南芥中MBF1c的表达受HSFA1的调节, 在hsfa1四突变体中被显著抑制[28]的报道相吻合。在正常条件下, HSFA2、WRKY18与DREB2a的表达在mbf1c突变体中被显著抑制, 在MsMBF1c过量表达植株中被上调, 高温胁迫后这种趋势更加明显; 而HSFA3、HSFB1与WRKY25也具有类似的变化趋势, 说明这些基因表达可能受MsMBF1c基因的调控。这与在拟南芥中, HSFB2a, HSFB2b和HSFA3的上游基因DREB2a依赖于MBF1c[29]中的报道是一致的。另外, 在拟南芥中MBF1c参与WRKY转录因子介导的耐热调节, MBF1c的表达受WRKY25、WRKY26与WRKY33的调控[30, 31], 而同时, WRKY18在MBF1c过表达株中上调表达[32]。因此, MBF1c与WRKY家族基因可能存在反馈调节的机制。在本研究中, WRKY18与WRKY25的表达均受MsMBF1c的调节, 可能的原因为MBF1c能够通过激素信号途径调节植物耐热性, MBF1c位于水杨酸和乙烯信号通路介导的耐热调节途径的上游[14, 33], 而WRKY25与WRKY33等能够与乙烯信号途径相互作用调节植物耐热性[30]; 另外一种可能是紫花苜蓿MsMBF1c在部分调控途径上与拟南芥存在差异, 准确的结果还有待深入研究。
紫花苜蓿MsMBF1c能够应答高温、干旱等非生物胁迫, 并具有调节植物抗热性的作用。在分子水平上, MsMBF1c能够调节HSF、WRKY以及DREB2a等家族某些主要的抗热相关基因的表达, 参与植物对耐热胁迫的应答反应。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|