作者简介:赵颖(1991-),女,宁夏永宁人,在读博士。E-mail: A_zhaoying@163.com
针对西北地区藜麦栽培土壤限制问题,研究盐碱胁迫对藜麦种子萌发及抗性相关酶特性的影响,探讨藜麦对盐碱土壤的适应机制,为藜麦在盐碱地的栽培实践提供理论依据。将中性盐(NaCl、Na2SO4)和碱性盐(NaHCO3、NaCO3)按不同比例混合模拟出20种混合盐碱条件对藜麦种子进行胁迫,分析盐碱胁迫下藜麦种子的发芽率、发芽势、发芽指数和抗氧化酶活性及同工酶表达。结果表明:5种盐碱胁迫均引起藜麦种子发芽率,发芽势,发芽指数降低,且随着盐浓度的增加,萌发受到显著抑制( P<0.05),对藜麦种子萌发影响较大。A,B处理组各浓度盐碱胁迫下超氧化物歧化酶(superoxide dismutase, SOD)和谷光甘肽还原酶(glutathione reductase, GR)活性均高于CK;C,D,E处理组SOD活性均低于CK,但GR活性在50 mmol·L-1盐碱浓度时高于CK。过氧化物酶(peroxidase, POD)活性在盐碱浓度为50 mmol·L-1时最高,随盐浓度增加POD活性比CK降低4倍,过氧化氢酶(catalase, CAT)活性随盐碱浓度的增加而下降。SDS-PAGE分析发现,盐碱胁迫可诱导SOD,POD,CAT,GR同工酶出现新的条带,但随着盐碱浓度的增加,酶带的表达量降低。上述结果说明,盐碱胁迫抑制藜麦种子萌发,其中Na2SO4和NaHCO3对藜麦种子萌发抑制效应明显。本试验条件下,藜麦的耐盐碱阈值为50 mmol·L-1,其中盐碱浓度是影响藜麦种子萌发的主要因素,盐组分值对藜麦种子萌发影响次之。
The saline-alkali conditions in many parts of Northern China constitute a soil factor causing significant restrictions to quinoa development. In order to better understand the adaptive physiology of quinoa under saline-alkali stress, this research focused on quinoa seed germination, antioxidant enzyme activities and isozyme characteristics. A set of 20 different alkali-saline plant stress conditions were simulated by mixing two neutral (NaCl and Na2SO4) and alkaline (NaHCO3 and Na2CO3) salts with soil in different proportions (A, NaCl∶Na2SO4=1∶1. B, NaCl∶Na2SO4∶ NaHCO3=1∶2∶1. C, NaCl∶Na2SO4∶NaHCO3∶Na2CO3=1∶9∶9∶1. D, NaCl∶Na2SO4∶NaHCO3∶Na2CO3=1∶1∶1∶1. E, NaCl∶Na2SO4∶NaHCO3∶Na2CO3=9∶1∶1∶9) and at concentrations of (50, 100, 150 and 200 mmol·L-1). Several germination and physiological indices, such as the germination percentage, germination index, germination energy were measured, and the activities of SOD, POD, CAT and GR were also analysed, and isoenzymic zymograms prepared. It was found that the five different saline-alkali stress formulations all decreased quinoa germination percentage, germination index and germination energy. With increasing saline-alkali concentration, germination was decreased dramatically ( P<0.05). Compared to the control, saline-alkali stress induced higher activities of SOD and GR under treatments A and B, and lower activity of SOD under treatments C, D, and E, while GR activity was significantly increased at 50 mmol·L-1 salt concentration. The activity of POD was the highest when the concentration of saline-alkali solution was 50 mmol·L-1; with increased salt concentration, POD activity fell to levels 4 times lower than control, and CAT activity also decreased. SDS-PAGE revealed that saline-alkali stress induced significant changes to isomer ratios of antioxidant enzymes (SOD, POD, CAT, GR), including new isoforms. These results indicate that salt-alkaline stress inhibited seed germination of quinoa. For Na2SO4 and NaHCO3 on the germination inhibition of quinoa seeds was more obvious. The threshold of salt tolerance was 50 mmol·L-1 in this study, and salt concentration was the main determinant of the degree of inhibition, with the composition of the salt solution being a minor factor.
藜麦(Chenopodium quinoa)为苋科藜属植物, 起源于南美洲安第斯山脉沿麋地区, 距今约有5000~7000年的栽培历史, 是当地印加人备受推崇的传统食物之一。因藜麦富含丰富的蛋白、氨基酸种类、膳食纤维、维生素、矿物质及不饱和脂肪酸, 被联合国国际粮农组织(FAO)推荐为“ 全营养食品” 。其在预防肥胖、心血管疾病、糖尿病乃至癌症等方面的功效已得到认可[1], 使其从一种冷门的传统谷物成为全球炙手可热的商品, 仅依靠原产地并不能满足日益增加的需求。由于藜麦具有抵御土壤贫瘠[2]、盐渍[3]、干旱[4, 5]和霜冻[6]等逆境的生物学特性, 被广泛引种栽培到美国、加拿大和欧洲等多个国家和地区[7, 8], 目前在我国西藏、陕西、甘肃、青海、宁夏等地均有种植[8]。我国西北高原地区的自然环境为藜麦的引种栽培提供了良好的条件, 但此地区因雨水少, 微弱的淋溶作用致使大部分土壤呈碱性反应, 在低洼灌溉区以及地下水位较高地段, 地下水可由毛管作用将盐分带到地表聚集, 使土壤发生盐渍化[9, 10], 严重制约农业生产。因此, 研究盐碱胁迫下藜麦耐盐碱机制, 对解决藜麦适应性栽培具有理论指导和现实意义。
目前, 国内外对藜麦抗逆的研究主要集中在抗盐方面, 刘文瑜等[11]研究发现低于200 mmol· L-1 NaCl溶液能促进藜麦种子萌发, 随盐度增加藜麦幼苗茎部生长受到抑制, 低浓度盐胁迫可增加藜麦幼苗叶片渗透调节物质含量, 增强抗氧化酶活性, 清除多余活性氧。杨宏伟等[12]认为低浓度盐胁迫可促进根的生长以增强根系吸水抵抗渗透胁迫。张紫薇等[13]研究发现藜麦的耐盐性强于耐旱性, 低浓度盐处理复水后, 幼苗侧重对茎生物量的分配, 对根生物量分配较少, 高浓度盐处理复水后对根造成永久伤害不能恢复至对照水平。Shabala等[14]研究发现遭受盐胁迫时藜麦降低叶片气孔密度以得到最佳水分利用效率。通过积累无机离子(Na+ 、K+、Cl-)进行渗透调节, 以维持正常所需水势, 降低蒸腾速率[15]。虽然前人从萌发、生物量、呼吸代谢、光合特征, 养分组成等方面对盐胁迫下藜麦盐害的响应已有系统研究, 但开展这些研究工作主要集中在NaCl(中性盐)单一因素处理下对藜麦生长的影响, 把渗透胁迫和高浓度Na+毒害效应作为盐胁迫的2个主要因素[16], 自然界的盐碱成分复杂[17], 我国西北地区盐碱地大多属于复合型盐碱地, 造成盐碱的主要成分为NaHCO3和Na2CO3, 兼有NaCl和Na2SO4, 因此盐化与碱化作用往往同时发生[18], 而以混合盐碱胁迫处理展开的研究尚未见报道。种子萌发是植物生长的关键及敏感阶段[19, 20], 本研究从种子萌发及幼苗抗氧化酶特性探讨藜麦的耐盐碱性, 揭示其耐盐碱机制, 旨在为藜麦在盐碱地的适应性种植、农业系统多元化栽培及生态环境改善奠定良好的理论基础。
1.1.1 实验材料 供试藜麦由宁夏农林科学院科泰种业有限公司提供, 原产地秘鲁, 种子产于宁夏固原市原州区中度盐碱地区(地跨东经105° 58'~106° 30', 北纬35° 34'~36° 38', 海拔1470~2920 m, 年降水量350~650 mm), 千粒重0.327 g, 选取成熟饱满、大小均匀及无病虫害的种子用于萌发试验。
1.1.2 盐碱条件的模拟 根据古丽内尔等[21]的研究稍做改动模拟盐碱条件, 选择2种中性盐(NaCl、Na2SO4)和2种碱性盐(NaHCO3、NaCO3), 以碱性盐所占比例递增顺序设置5个处理组, 依次为A、B、C、D、E(表1), 设定的盐处理浓度为50, 100, 150, 200 mmol· L-1。用pH计(雷磁PHS-3C)检测20种不同盐碱混合液pH值。
| 表1 各处理盐分组成、摩尔比及pH Table 1 Salts composition, molar ratio and pH of solutions for mixed salt- alkali treatment |
1.1.3 种子萌发试验 本试验于2017年10月-2018年1月在甘肃农业大学实验教学中心植物生理实验室进行。选择饱满、大小均匀的藜麦种子, 用2% NaClO消毒10 min并用去离子水冲洗3~5次, 置于垫有2层滤纸的培养皿(Φ =9 cm)中, 每皿50粒, 每处理重复3次。置于光照强度4000 lx, 温度25 ℃/15 ℃, 光周期16 h/8 h(昼/夜)光照培养箱中培养, 每天10:00更换处理液, 保持处理液浓度一致。每24 h统计一次发芽数, 第7 天取幼苗测定进行抗氧化酶活性及同工酶电泳。
1.2.1 种子萌发指标 萌发以胚根长为种子长的2倍为标准, 计算公式如下:
发芽率(germination percentage, GP)=(第7 天发芽种子数/测试种子数)× 100%[22]
发芽势(germination energy, GE)=(前3 d发芽种子数/种子总数)× 100%[22]
发芽指数(germination index, GI)=
式中:Dt为日发芽种子数, Gt为与Dt相应的每天的发芽种子数。
1.2.2 抗氧化酶活性的测定 酶液提取:称取不同处理的藜麦幼苗0.5 g置于研钵中, 加入5 mL 50 mmol· L-1磷酸缓冲液(pH 7.8, 内含1%聚乙烯吡咯烷酮)冰浴研磨至匀浆, 转入10 mL离心管, 在4 ℃、10000 r· min-1条件下离心15 min, 上清液即为酶液[24]。
超氧化物歧化酶(SOD)活性测定方法:采用NBT显色法测定[25]; 过氧化物酶(POD)活性测定方法:采用愈创木酚氧化法测定[24]; 过氧化氢酶(CAT)活性测定方法:采用紫外吸收法测定[25]; 谷光甘肽还原酶(GR)的测定参照Halliwell等[26]的方法。
1.2.3 抗氧化酶同工酶电泳 采用垂直不连续聚丙烯酰胺凝胶电泳。SOD同工酶分离胶质量分数为10%, POD和CAT同工酶分离胶质量分数为7.5%, GR同工酶分离胶质量分数为8%, 浓缩胶质量分数均为3.75%。浓缩胶和分离胶分别在电压80和200 V, 电流30和45 mA条件下电泳, 上样量均为40 μ L。当溴酚蓝指示剂移至前沿时, 停止电泳。
将SOD胶块依次浸于2.45 mmol· L-1 NBT(四唑氮蓝)中暗染20 min, 0.036 mmol· L-1(pH 7.8)PBS(磷酸缓冲液)缓冲液(内含28 mmol· L-1 TEMED(四甲基乙二胺), 28 μ mol· L-1核黄素)中暗染15 min, 0.05 mol· L-1(pH 7.0)PBS缓冲液[内含0.1 mmol· L-1 EDTA(乙二胺四乙酸二钠)]日光灯下染色20 min[27]。将POD胶块放入联苯胺醋酸染液中染色5~10 min[28]。将CAT胶片放入0.05% H2O2溶液中浸泡10 min, 蒸馏水冲洗2~3次, 再放入1%氯化高铁和1%铁氰化钾(1∶ 1)混合液中染色5 min[27]。将GR胶块放入0.25 mol· L-1 (pH 7.8) Tris缓冲液[内含0.24 mmol· L-1 MTT(噻唑蓝), 0.34 mmol· L-1 2, 6-二氯靛酚, 0.4 mmol· L-1 NADPH(还原型烟酰胺腺嘌呤二核苷酸磷酸), 3.6 mmol· L-1 GSSG( 氧化型谷胱甘肽)]中暗染50 min[29]。
利用Microsoft Excel 2010进行数据整理, SPSS 19.0统计软件进行方差(Duncan)分析(P< 0.05), Image J及Photoshop软件对同工酶图谱进行分析。
不同pH的盐碱胁迫下藜麦种子的累积萌发率如图1所示。在A、B、C、D、E 5个不同的盐碱环境中, 随着盐碱浓度的增加, 各组的累积萌发率均呈下降趋势。此外, 由A至E, pH值随碱性盐所占比例增加而增大, 累积萌发率受盐组分的影响不大, E处理组pH值最大, 但其累积萌发率变化趋势与A处理组相似, 大于B、D组, C组的累积萌发率最低。A、C、E处理组下, 盐浓度大于100 mmol· L-1时, 累积萌发率分别显著下降了25.41%、41.83%、36.04%。而D处理组在盐浓度大于150 mmol· L-1时累积萌发率显著下降。
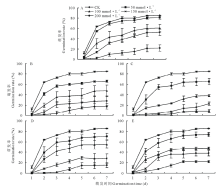 | 图1 不同pH盐碱胁迫下藜麦种子累积萌发率Fig.1 Accumulative germination percentages of C. quinoa seeds in salt-alkali mixed stresses at different pH values A, pH=7.43. B, pH=8.81. C, pH=9.10. D, pH=9.64. E, pH=10.43. |
如表2所示, 不同盐碱组合的5种盐溶液处理均引起藜麦种子发芽率、发芽势、发芽指数降低, 相同盐组分下, 随着盐浓度的增加抑制作用增强。相同盐浓度下, A、E处理组的发芽率显著大于B、C、D处理组, 且B、C、D处理组间发芽率无显著差异(P< 0.05), 当盐浓度为200 mmol· L-1时, 5处理组发芽率差异不显著。在50 mmol· L-1盐浓度下, A处理组与CK相比发芽势为显著降低, B、C、D、E处理组发芽势显著降低; 随着盐浓度增加, A、D、E处理组间差异逐渐显著, 但B、C处理组间发芽势无差异。藜麦种子发芽指数在50 mmol· L-1盐浓度下各处理组变化趋势与该浓度下发芽势趋势一致, 当盐浓度大于150 mmol· L-1时, A、E处理组无显著差异。
| 表2 不同pH盐碱处理对藜麦种子萌发的影响 Table 2 Effects of different pH values of salt-alkali concentration on seed germination of quinoa |
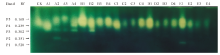
由图2可知, A处理组在浓度为50 mmol· L-1时SOD活性最大, B处理组SOD活性随着盐碱浓度的升高呈先增高后降低趋势, 且在 100 mmol· L-1时SOD活性最大。C、D处理组SOD活性均低于CK, 且随着盐碱浓度的增加SOD活性逐渐降低, 当浓度为200 mmol· L-1时, C、D处理SOD活性比CK分别降低了25.53%和20.90%。E处理SOD活性均低于CK, 且随盐碱浓度增加先增高后降低。由图3可看出, 藜麦SOD同工酶谱带呈现2条。迁移率为0.753的P2酶带在盐碱胁迫后颜色加深, C、D、E处理出现P1酶带, 颜色较P2酶带浅, 说明其表达量较低。
 | 图2 盐碱胁迫对藜麦种子萌发期SOD活性的影响Fig.2 Effects of complex saline-alkali stress on SOD activity in quinoa during germination period |
由图4所示, 各混合盐碱胁迫下POD活性在浓度为50 mmol· L-1时最大, 除C处理。A、B、D、E处理POD活性分别比CK显著增加了27.20%, 49.85%, 58.80%和72.00%(P< 0.05), C处理POD活性与CK相比降低了0.02%。当盐碱浓度大于50 mmol· L-1时, POD活性显著降低, 150和200 mmol· L-1浓度下POD活性无显著性差异。由图5可知, 不同盐碱处理下POD同工酶谱带存在明显的差异, POD同工酶共检测出7条酶带。A1、B1、C1、D1、E1泳道POD同工酶表达量最高, 与之对应POD活性也最大。A、B处理组POD酶带数较多, 出现P4酶带。C、D、E处理组随着浓度增加, 酶带表达量逐渐降低。
 | 图4 盐碱胁迫对藜麦种子萌发期POD活性的影响Fig.4 Effects of complex saline-alkali stress on POD activity in quinoa during germination period |
由图6可得, 混合盐碱胁迫下藜麦CAT活性随着盐碱浓度的增加而降低。当浓度为50 mmol· L-1时, A、B、C、D、E处理CAT活性较CK分别降低了27.46%, 0.04%, 39.32%, 30.17%, 26.10%。当浓度大于150 mmol· L-1时, B、C、D、E处理CAT活性与CK相比降低50%以上。由图7可看出, 共检测到5条CAT同工酶条带, 与CK相比, A1、B1、C1、D1、E1处理酶带表达增强, A2、A3、C2、C3、D2、D3、E2、E3处理酶带表达被抑制。A2、A3、A4、B2处理下出现P3酶带, E1处理出现P1酶带。
 | 图6 盐碱胁迫对藜麦种子萌发期CAT活性的影响Fig.6 Effects of complex saline-alkali stress on CAT activity in quinoa during germination period |
由图8可以看出, 各处理组GR活性均随着盐碱浓度的增加呈先升高后降低的变化趋势。与CK相比, A、B处理组各浓度下GR活性均显著高于CK(P< 0.05), A处理组在盐碱浓度为50 mmol· L-1时活性最大, B处理组在盐碱浓度为100 mmol· L-1时活性最大。C、D、E处理组在盐碱浓度为50 mmol· L-1时GR活性最大, 分别比CK提高了31.25%, 19.58%和31.25%, 盐碱浓度为200 mmol· L-1时GR活性比CK分别降低了44.58%, 23.00%和27.08%。从图9可知, 在种子萌发期检测到3条GR同工酶条带, 迁移率分别为0.535, 0.434和0.292。与CK相比, P2条带在A1、B1、C1、D1、E1处理下表达均受到抑制。A、C处理组随着盐碱浓度的增加P1和P3酶带的表达量增加, B、D、E处理组随着盐碱浓度的增加P1酶带的表达受到抑制。结果说明低浓度的盐碱胁迫能提高GR活性, 碱性盐含量的增加会引起GR活性降低。
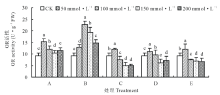 | 图8 盐碱胁迫对藜麦种子萌发期GR活性的影响Fig.8 Effects of complex saline-alkali stress on GR activity in quinoa during germination period |
种子萌发是植物对盐胁迫最敏感的时期, 而生活在盐渍环境中的植物是否能够萌发出苗, 是植株在盐碱条件下生长发育的前提[30]。本研究发现, 藜麦种子的累积萌发率, 发芽率, 发芽势及发芽指数在同一盐组分条件下, 随着盐浓度的增高均降低; 在盐浓度相同条件下, 藜麦种子的萌发率因盐组分的不同表现出差异性。在本试验中, Na2SO4和NaHCO3的含量对藜麦种子萌发影响较大, 这与张勇等[31]对盐碱胁迫红芪(Hedysarum polybotrys)种子萌发的研究结果不同, 造成这一现象的可能原因是混合盐碱胁迫下多离子共同作用与单盐胁迫对种子萌发的调控机制不同。刘文瑜等[11]和杨宏伟等[12]研究表明, 在小于300 mmol· L-1 NaCl胁迫下藜麦种子的萌发率均达到65.36%, 而本试验中, 当A处理组盐浓度大于150 mmol· L-1, B、C、D、E处理组盐浓度大于100 mmol· L-1时, 藜麦种子的萌发率就会低于50%。这表明, 混合盐碱胁迫对藜麦种子萌发的影响比单盐胁迫更严重。古丽内儿· 亚森等[21]研究表明, 灰绿藜种子萌发率随pH值增加而减少, 本研究发现, 盐浓度是决定藜麦种子萌发的主要因素, 盐组分对藜麦种子萌发影响次之, 这可能是由于不同植物在种子阶段适应自然生境的能力不同。
超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、谷胱甘肽还原酶(GR)作为植物体内的活性氧(ROS)清除剂, 在植物抗逆响应过程扮演重要的保护作用[32]。SOD作为膜保护的首道防线, 它能清除超氧阴离子(
同工酶是植物体内最活跃的酶之一, 可通过酶谱直接判断基因的存在及表达[36]。逆境常引起基因变异而使酶结构及其活性发生变化, 而导致同工酶酶谱发生变化[37]。本试验结果表明:盐碱胁迫下藜麦种子萌发期SOD同工酶在盐碱胁迫下表达增强, 且随着盐浓度的增加呈增强的变化趋势。多种因素会影响POD同工酶的表达, 其编码基因由一类超级基因家族的Px基因组成[38]。本试验中, 藜麦种子萌发期共呈现了7个POD同工酶位点, 50 mmol· L-1盐浓度迫后每个位点的表达活性增加, 之后随着盐浓度的增加表达活性降低, 但同工酶位点数增加。说明盐碱胁迫下基因的表达受盐浓度的影响, 高浓度的盐胁迫下藜麦种子萌发期部分基因转录、表达水平降低。这与孙静等[39]的研究结果一致。CAT同工酶的表达与植物的胁迫适应能力有密切关系, 藜麦种子萌发期CAT同工酶的表达与盐浓度的关系与POD同工酶相似。前人的研究表明, GR同工酶的组成会受热激[40]盐[41]、干旱、镉胁迫[42]的影响, 本研究中大于100 mmol· L-1的盐浓度胁迫下会诱导1个新的GR同工酶位点的表达。
综上所述, 盐浓度和盐组分均抑制藜麦种子萌发, 且盐浓度的抑制效应大于盐组分, 碱性盐的抑制作用强于中性盐。GR为藜麦抵御盐害的关键酶, 50 mmol· L-1的盐碱浓度下藜麦通过抗氧化酶活性的增加抵御盐害, 100~200 mmol· L-1盐浓度下, POD和CAT活性显著下降, 说明50 mmol· L-1盐碱浓度为藜麦的耐盐碱阈值。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|