作者简介:李新乐(1989-),男,内蒙古巴彦淖尔人,在读博士。E-mail: nxylxl@126.com
定量生长季内荒漠植物新固定碳在植物-土壤的分配规律,对理解全球碳循环有着重要意义。采用野外原位13C-CO2脉冲标记法,测定植物各器官及土壤13C丰度值,比较不同标记时间段白刺新固定碳分配在不同器官、土壤和呼吸损失中的分配规律,并量化了白刺光合碳向地上、地下碳库的转移。结果表明:不同标记时间段内13C-新固定碳在白刺叶、茎、根、土壤中的分配差异明显。在标记后1 h内,叶片和茎中13C丰度值迅速上升到最高值,13C丰度值分别达到520.1‰和592.5‰,比对照分别增加14和20倍,此后13C丰度值随时间推移逐渐下降,直至趋于稳定;而标记后18 h在根系和土壤中发现被标记的13C,13C丰度值分别达到9.5‰和-23.8‰,白刺新固定碳经地上部呼吸和土壤呼吸损失量分别在标记1和18 h后达到最大。标记32 d后,白刺新固定碳在地上部和地下部13C分配比例分别占35.59%和32.49%,呼吸损失(地上呼吸+土壤呼吸)占31.92%。荒漠植物白刺生长季年固碳量为2895.6 kg C·hm-2·yr-1,表明白刺在荒漠生态系统碳循环中起着重要的碳汇作用。
Characterizing the carbon turnover in terrestrial ecosystems is critical for understanding and predicting carbon dynamics in ecosystems. We used in situ13C pulse labeling to track photosynthetic carbon fluxes of Nitraria tangutorum from shoot to root and soil in the Ulanbuh Desert. The objectives of this study were: 1) To determine the transfer dynamics of newly photosynthesized carbon to different carbon pools including leaves, stems, roots, soil, and respiration. 2) To quantify the allocation rate of newly fixed carbon among different carbon pools. 3) to estimate the carbon budget of a N. tangutorum desert ecosystem. It was found that the distribution of13C-newly fixed carbon in leaves, stems, and roots of N. tangutorum and in soil was significantly different in different labeling periods. The13C abundance value in leaves and stems rose rapidly to the highest value after labeling for 1 h, at which point the13C abundance value was 520.1‰ and 592.5‰, 14 and 20 times higher than the control, respectively. Thereafter, the13C abundance value gradually decreased with time until it stabilized. The labeled13C was found in the roots and soil after labeling 18 h, and the13C abundance values reached 9.5‰ and -23.8‰, respectively. The amount of newly fixed carbon lost through shoot respiration and soil respiration reached a maximum after labeling for 1 h and 18 h, respectively. At the end of the labeling period, about 35.59% of labeled carbon was transferred to the shoots, 16.67% was retained in root, 31.92% was lost as respiration (shoot respiration+soil respiration) and 15.82% remained in the soil. In the three carbon pools, i.e., shoot, root, and soil pools, shoots consistently had the highest proportion of13C in the plant-soil system during the 32 days. Based on the13C partitioning pattern and biomass production, we estimate a total of 2895.6 kg C·ha-1·yr-1 was fixed by these desert plants during the vegetation growth season. This study suggests that N. tangutorum plays an important role in carbon sequestration in the carbon cycle of desert ecosystems.
植物光合碳是“ 大气-植物-土壤” 系统碳循环的起点, 光合碳由地上部向地下部转运, 用作根系呼吸和根系发育, 转移至根系中的光合碳以根系分泌物或植物残体形式将同化的碳水化合物输入土壤[1], 以根系沉积物形式向土壤根际环境中输入碳转化为微生物量碳中的一部分, 或以有机质形式贮存于土壤碳库中。因此, 碳是植物体主要组成元素, 也是土壤有机质重要组成部分。中国科学院有关研究人员在PNAS(美国科学院院报, Proceedings of the National Academy of Sciences)发布的中国陆地生态系统碳收支最新研究成果显示, 中国陆地生态系统在过去几十年一直扮演着重要的碳汇角色, 其中灌丛生态系统碳储量为(6.69± 0.32) Pg C, 贡献了中国陆地生态系统固碳总量的8%[2]。全球干旱区面积约52亿 hm2, 占陆地生态系统面积的35%[3]。我国荒漠化土地面积为261.16万 km2, 占国土面积的27.2%[4]。因此, 面积广阔的荒漠地区在全球碳循环过程中起着重要作用。
定量新固定碳在植物组织、土壤和呼吸损失中的分配, 是准确评估陆地生态系统碳收支的重要基础[5]。目前, 植物新固定碳的分配尚缺乏完善的理论或数学模式, 是全球碳循环研究的难点和热点[6], 主要原因在于植物地下碳分配, 如根系生长、死亡、脱落、分解、根际分泌、土壤微生物分解等环节, 几乎都无法通过原位直接观测得到[7]。弄清植物新固定碳向地下的分配及转化已经成为准确模拟生态系统碳循环、预测其对环境变化响应的关键[7, 8]。13C同位素标记技术是追踪和定量研究植物新固定碳在“ 大气-植物-土壤” 连续体中运输和分配的有效方法, 其最大的优势在于能够追踪不同组分碳的去向, 定量植物新固定碳向不同碳库的分配, 有助于预测新固定碳对生态系统碳循环和碳固定的贡献, 已经被广泛用来研究植物新固定碳的分配[9, 10]。
近年来, 大量研究表明, 植物新固定碳的分配因植物种类和生态系统类型的不同而有差异, 也会因植物物候、土壤养分、环境条件的不同而变化。如青藏高原高寒矮蒿草(Kobresia humilis)草甸植物将59%的新固定碳分配至地下系统, 而作物运输到土壤碳库的新固定碳低于33%[11], 牧草将30%~50%的光合产物转移到地下[12], 谷类作物[小麦(Triticum aestivum)和大麦(Hordeum vulgare)]约有20%~30%的光合碳分配到地下部[13], 水稻(Oryza sativa)光合碳约有2%~10%以根际沉积碳的形式输入土壤[14]。然而, 先前的研究多集中在森林树种幼苗、作物或草地植物等方面[15, 16, 17], 对干旱区荒漠植物新固定碳在植物组织、土壤和呼吸损失之间分配的研究极其缺乏。尽管有个别研究报道了CO2浓度倍增和土壤干旱对两种盆栽幼龄沙生灌木碳分配的影响[18], 但实验结果来源于室内盆栽实验, 不能真实的反应野外自然状态下荒漠植物新固定碳分配情况。
唐古特白刺(Nitraria tangutorum)是我国西北荒漠地区主要的优势种和建群种, 它的根系非常发达, 对干旱的适应性极强, 在维持荒漠生态系统平衡方面具有重要作用[19]。本研究以荒漠植物白刺为研究对象, 采用13C稳定同位素标记技术, 在野外原位追踪荒漠植物白刺新固定碳在茎、叶、根、土壤和呼吸损失中的分配动态, 量化白刺新固定碳在植株各组织及土壤中的分配, 以此为基础估算荒漠生态系统固定碳量及其向不同碳库的分配。
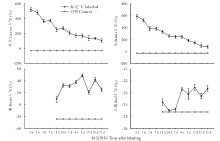
研究区位于内蒙古自治区巴彦淖尔市磴口县, 中国林业科学研究院沙漠林业实验中心二场内, 地理位置为E 106° 43', N 40° 24', 海拔约1050 m。该区是河套平原与乌兰布和沙漠的结合部, 属于中温带大陆性季风气候, 年平均气温7.6 ℃, 多年平均降水量约145 mm, 降水主要集中在6-9月, 约占全年降水的60%~70%, 年蒸发量约2381 mm, 无霜期136 d。 植被类型属于温带灌木荒漠, 唐古特白刺是研究地点的优势植物, 能够阻挡风沙并形成白刺灌丛沙包, 沙包高约1~3 m, 直径约6~10 m, 植被盖度约为45%~75%, 伴生种有沙鞭(Psammochloa villosa)、油蒿(Artemisia ordosica)等。群落盖度为20%~30%。土壤类型沙包上为风沙土, 沙包之间没有流沙覆盖处为灰棕漠土[20]。实验期间的降水和气温变化如图1所示。
13CO2标记气室为50 cm× 50 cm× 50 cm的正方体, 四周为金属框, 标记气室侧壁用透明PVC薄板制作, 透明薄膜封顶。为使标记气体在标记室内迅速混合均匀, 在标记室内正中央安装一个小电风扇。13CO2通过$Na^{13}_{2}$CO3与H2SO4在标记室内发生化学反应产生。标记气室共制作12个, 分别安装于对照和实验样地内。由于白刺的年龄难以确定, 因此在选择样地时选择生长状况相似、大小相近的白刺沙包, 各样地土壤条件、环境条件相同。
1.3.1 样品采集 本研究在2017年的7月中旬进行, 在野外进行原位13C同位素脉冲标记实验。实验选择晴朗天气, 提前1 d安装好13CO2气体标记室, 以减少对土壤的扰动。标记后分不同时间段(0, 1 h, 3 h, 7 h, 18 h, 24 h, 2 d, 4 d, 8 d, 17 d, 25 d 和 32 d)分别采集白刺叶、茎、根、土壤和气体样品。植物样品烘干后粉碎待测定其全C 和δ 13C值; 土壤样品过2 mm 的土壤筛, 过筛的土壤样品风干后贮存在4 ℃条件下, 供测定其全C 和δ 13C值; 气体样品密封保存并尽快完成分析测试。样品采集重复3 次。
1.3.2 13C测定 上述气体样品、植物固体样品和土壤样品利用中国林业科学研究院稳定同位素实验室EA-IRMS测定仪器(元素分析仪-同位素比率质谱分析联用仪, Flash EA 1112 HT-DELTA V Advantage, Scientific, Inc., USA)测定其13C丰度值(δ 13C, ‰ ), 同时可得到固体样品中的含C量(%)。其原理为: 样品在元素分析仪中高温燃烧后生成CO2, 质谱仪通过检测CO2的13C与12C比率, 并与国际标准物(Pee Dee Belemnite或PDB=0.011237)比对后计算出样品的δ 13C比率值。δ 13C 测定精度: ± 0.1‰ 。具体计算公式如下。
13C的绝对比值:Rsample=
13C的丰度:13C (at%)=
白刺新固定13C进入茎、叶、根、土体和呼吸损失中, 各组分固定13C量[13C excess (at%)]:
13C excess (at%)=13C of samples (at%)-13C of natural abundance (at%) (3)
式中: 13C of samples (at%)为标记组分13C丰度(%); 13C of natural abundance (at%)为不标记组分13C丰度(%)。
进入各器官及土壤的固定碳量:
13C amount (mg· m-2)=13C excess (at%)× C pool size (g· m-2)× 10 (4)
式中:C pool size分别代表各器官和土壤的总碳量。
各组分13C分配比例P13Ci (%):
P13Ci=(13Ci/13C)× 100 (5)
式中:13C为根、茎、叶、土壤固定和呼吸损失13C量之和。
地上净初级生产力采用收获法测定, 考虑到白刺沙包迎风坡、背风坡, 阴面和阳面的区别, 分别在其东南、东北、西南和西北4个方向约1/2沙包半径处设置1 m× 1 m样方, 共4个, 在10月20日将每个样方内当年生长的新生叶片和新枝条全部收获, 视为该样方当年地上净初级生产力。
数据的统计分析与制图采用Microsoft Excel 2017 和SigmaPlot 10.0, 其中采用单因素方差分析法(One-Way ANOVA)和最小显著差异法(LSD)比较同一时间白刺不同器官和土壤中的13C含量差异, 以及同一器官在不同时间上13C含量差异。
不同标记时间段内13C-新固定碳在白刺叶、茎、根、土壤中的分配差异明显。由图2可知, 白刺植株在没有进行标记之前, 叶片和茎中的13C丰度均在-23.5‰ ~-17.9‰ 之间, 并且没有显著差异(P> 0.05)。在标记后1 h内, 叶片和茎中13C丰度值迅速上升到最高值, 13C丰度值分别达到520.1‰ 和 592.5‰ , 比对照分别增加14和20倍, 此后13C丰度值随时间推移逐渐下降, 直至32 d 后趋于稳定; 而标记后1 h内根系和土壤中还未发现标记的13C, 直到标记后18 h, 在根系和土壤中发现了被标记的13C, 13C初始丰度值分别达到9.5‰ 和-23.8‰ , 并且从18 h到标记结束13C丰度值呈现波动状态, 最大丰度值分别为49.2‰ (标记后8 d)和-22.5‰ (标记后17 d)。
从图3白刺新固定碳经地上部呼吸和土壤呼吸损失后的13C丰度变化来看, 标记1 h后, 经过地上呼吸损失的13C丰度迅速达到最大, 13C丰度值为1082.2‰ , 比对照高63倍, 随后13C丰度值迅速下降, 到标记后4 d与对照没有显著差异(P> 0.05)。而标记后18 h, 土壤呼吸损失的13C丰度迅速上升到最大值, 此时13C丰度值为445.8‰ , 比对照高13倍, 随后13C丰度值迅速下降, 与地上呼吸类似, 在标记后4 d与对照没有显著差异(P> 0.05)。
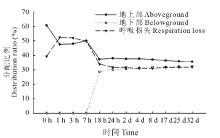
从图4中可知, 在标记后0~1 h, 白刺叶片吸收的13C量大部分都集中在地上部分, 其所占比例达60.69%, 之后随着时间的递增, 由于叶片吸收的光合碳逐渐被呼吸消耗和转运到根系, 分配到地上部的13C量逐渐降低, 其中在标记后1~18 h期间, 地上部13C量显著下降, 标记后24 h, 13C分配比例变化趋于稳定; 而地下部13C分配比例随时间递增呈现先迅速升高后保持稳定的趋势, 最终, 在进行13C标记后的第32天, 分配到地下部的13C量达到稳定。白刺新固定碳在标记后0~18 h内经过呼吸损失较多, 并且在标记后1 h呼吸损失量最大, 达到52.42%, 标记18 h至标记结束, 呼吸损失量保持稳定。最终, 在标记32 d后, 白刺新固定碳在地上部和地下部13C分配比例分别占35.59%和32.49%, 呼吸损失占31.92%。
通过测定白刺植株地上部净初级生产力为380 g· m-2, 白刺地上部、根系的含碳量分别为(60.1± 0.01)%和(57.1± 0.08)%, 根据13C在白刺生长盛期各个组分的分配比例可以计算出植物地上部和地下根系的生长季固碳量。由表1 可知, 白刺地上部同化累积的碳量最多, 达1030.6 kg C· hm-2· yr-1, 其中叶片和茎分别积累了521.2和509.4 kg C· hm-2· yr-1; 大约有940.8 kg C· hm-2· yr-1分配到地下部, 其中根系中积累了482.6 kg C· hm-2· yr-1, 土壤中积累了458.2 kg C· hm-2· yr-1。白刺生长季固碳量为2895.6 kg C· hm-2· yr-1, 由此可知白刺具有较强的固碳能力。
| 表1 植物-土壤系统中新固定碳通量 Table 1 Destination of newly fixed C in the plant-soil system at the end of the label period and estimated annual C flux to different C pools |
目前, 陆地生态系统碳收支的估算方法主要包括生物量和土壤碳储量清查法、碳通量观测法, 卫星遥感、大气CO2浓度反演以及生态系统模型法等, 但这些方法均只能测定植被碳库或土壤碳库的大小, 不能反映植物新固定碳向植物组织、土壤和呼吸损失的分配动态[21]。人工添加13C同位素被称为同位素标记试验, 通常有3种方法:脉冲标记、重复脉冲标记和持续标记[22]。其中, 脉冲标记是一次性注入标记物, 容易在野外实施。当植物新固定碳在不同碳库稳定分配时, 基于质量平衡关系, 可计算出各碳库的分配量[23]。目前已经有大量研究采用13/14C同位素标记技术在室内研究植物新固定碳的分配[15, 24, 25], 野外原位开展的植物新固定碳分配的研究鲜有报道, 本研究在野外原位条件下, 采用13C同位素标记技术测定荒漠植物白刺新固定碳在叶、茎、根、土壤和呼吸损失等各部分的分配, 据此估算荒漠生态系统碳收支的变化, 这将为更准确的评估干旱区荒漠生态系统碳收支提供科学依据。
植物新固定碳在茎、叶、根系和土壤中的稳定分配及转化时间往往因植物种类、物候期、环境条件的不同而存在差异[26, 27, 28], 通常需要2~4周, 因此, “ 新” 一般是指数星期的时间尺度[1]。本研究表明白刺将16.7%累积在根系, 31.9%被土壤呼吸消耗, 15.8%存留在土壤碳库中。对青藏高原高寒矮蒿草草甸植物的碳分配研究表明, 大部分新固定的碳在一天之内完成向各个碳库的分配, 约有59%的新固定碳向地下系统分配, 且在示踪期内, 分配到活根系的新固定碳比例始终最高, 其中有30.9%存在于活根, 17.2%随土壤呼吸作用返回大气, 7.3%经过转化成为新的土壤碳[11]。蒺藜苜蓿(Medicago truncatula)将38.4%的新固定碳分配至地下部分, 其中46%存在于根中, 22%进入土壤, 32%通过根际呼吸返回到大气中[29]。玉米(Zea mays)通过根际分泌和根系呼吸消耗的新固定碳分别为0.5%和16.0%[30]。小麦生长期内15%~39%的新固定碳转移至地下部, 其中35%~48%被根系和根际微生物消耗[31]; 黑麦草(Lolium perenne)将56%~69%的新固定碳转移至地下部, 其中52%~62%集中在根系, 24%~31%被根系呼吸消耗, 13%~21%存留在土壤碳库中[32]。Kuzyakov 等[33]用脉冲标记实验共同研究了地上-地下碳的分配, 发现牧草植物同化的碳大约30%~50%进入到地下, Hafner等[9] 研究发现, 标记27 d 后20%~40%的光合碳进入到地下。本研究与以上研究得出的结果基本一致。植物新固定的碳将分配到地下部用于根系生长, 不断以根际沉积物的形式损失13C[34], 同时茎叶和根呼吸也释放13C; 再加上植株不断生长, 生物量继续增加, 未标记部分同化13C, 稀释了白刺新固定的13C, 因此导致了32 d 后植株13C丰度值的下降。本研究还表明, 白刺茎、叶在标记后1 h内13C丰度值迅速上升到最高值, 而根系在标记后18 h发现被标记的13C, 这与Ostle等[35]研究结果类似, 他认为光合碳向根系及土壤中的传输与分配与茎叶相比存在一定滞后性, 根系中光合碳含量在标记后的24~48 h达到峰值。
白刺生长季年固碳量估算值为2895.6 kg C· hm-2· yr-1, 任昱[36]对白刺固碳能力的研究表明, 白刺生长季固碳量为5116 kg C· hm-2· yr-1, 本研究白刺的固碳量明显低于该值, 这可能是其将枯落物也作为固碳量的一部分估算造成的。党晓宏等[37]以西鄂尔多斯地区5种天然荒漠灌丛为材料, 依据年光合固碳量将荒漠灌丛分为3类:年光合固碳高灌丛-沙冬青(Ammopiptanthus mongolicus)、霸王(Zygophyllum xanthoxylum):6216~8892 kg C· hm-2· yr-1; 年光合固碳中等灌丛-四合木(Tetraena mongolica)、红砂(Reaumuria songarica):1742~3962 kg C· hm-2· yr-1; 年光合固碳低等灌丛-半日花(Helianthemum songaricum):386 kg C· hm-2· yr-1。与上述研究结果相比, 本研究白刺固碳量在荒漠灌木中属于中等水平。
使用13C同位素标记技术能够准确估计荒漠植物新固定碳在叶、茎、根、土壤和呼吸损失中的分配比例。白刺将35.59%的新固定碳用于地上部分的生长和发育, 16.67%集中在根系, 31.92%被呼吸消耗, 15.82%存留在土壤碳库中。通过估算荒漠植物白刺生长季年固碳量可知, 白刺具有较强的固碳能力, 对增强荒漠生态系统碳储量、发挥荒漠碳汇功能具有重要意义。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|