作者简介:李建宏(1986-),男,甘肃临潭人,讲师,博士。E-mail: lijianhong@gsau.edu.cn
为明确植物根际促生菌Gnyt1菌株的特性及其分类学地位,以菌株Gnyt1为对象,对其促生特性、生物学特性以及对植物的影响等进行了系统研究,并结合表型特征、生理生化特性以及16S rRNA基因的序列信息等多种方法确定了Gnyt1的分类地位。结果显示,菌株Gnyt1固氮酶活性为3193.07 nmol C2H4·h-1·mL-1,能高效溶解无机磷和有机磷,能同时分泌植物生长素(IAA)、赤霉素(GA3)、玉米素(t-Z)等3种植物激素,对温度和pH的耐受性好,对青霉素、链霉素、罗红霉素、头孢拉定4种抗生素没有耐药性,对青稞、番茄、油菜、当归、苜蓿5种作物均无致病性,促生性状相对稳定,对青稞有明显的促进生长、提高产量的作用。初步确定其分类地位为蕈状芽孢杆菌。研究结果显示Gnyt1菌株综合特性优良,具进一步开发利用价值。
The aim of this research was to define the characteristics and taxonomic status of the plant-growth-promoting rhizobacterial strain, Gnyt1. The plant-growth-promoting properties, and biological characteristics were assessed, and taxonomic status determined from consideration of phenotypic, physiological and biochemical characteristics as well as 16S rRNA sequencing. We found nitrogenase activity in Gnyt1 up to 3193 nmol C2H4·h-1·mL-1. Inorganic and organic phosphorus could both be dissolved efficiently by Gnyt1. The bacterium can also produce three plant hormones: indole-3-acetic acid (IAA), gibberellin (GA3) and trans-Zeatin (t-Z). Gnyt1 had a good tolerance to temperature and pH, but had no resistance to the antibiotics penicillin, streptomycin, roerythromycin, and cefradine. Gnyt1 also had no detected pathogenicity to the crop species Hordeum vulgare var. nudum, Lycopersicon esculentum, Brassica napus, Angelica sinensis, and Medicago sativa. The growth-promoting properties were found to be stable and Gnyt1 promoted the growth and yield of naked barley. Its taxonomic status was preliminarily identified as Bacillus mycoides. The results show that the Gnyt1 rhizobacterial strain has excellent overall properties, making it a strong candidate for further development and utilization.
微生物资源不仅是新时代具有战略意义的资源, 更是一类开发潜力巨大的可再生资源, 是世界各国都优先发展的方向[1]。植物根际促生菌(plant growth-promoting rhizobacteria, PGPR)是定殖于植物根系附近, 具有促进植物生长的功能, 或具有抑制植物病原菌作用的一大类细菌[2]。植物根际促生菌作为植物根际微生物的功能性组分, 是非常重要的微生物资源。植物根际促生菌中的某些类群可以促进土壤中难溶性养分的溶解, 如促进磷、钾元素的溶解释放; 而另有一些类群可以通过自身代谢作用固定空气中的氮素, 使之成为植物可以吸收利用的硝态氮或铵态氮; 还有一些类群可以分泌诸如植物生长素(indole-3-acetic acid, IAA)、赤霉素(gibberellin, GA)、玉米素(trans-Zeatin, t-Z)等植物激素, 促进植物的生长[3]。此外, 还有某些类群可以有效抑制镰刀菌(Fusarium)、丝核菌(Rhizoctonia)等植物病原菌的生长, 起到防治植物病害的作用[4]。目前, 我国农业所遇到的作物养分与肥料供应问题、作物病害问题、连作障碍问题、土壤污染与退化问题、间套作和水旱轮作问题都与根际系统相关[5, 6, 7], 归纳来看, 都是根— 土界面的物质交换和理化变化问题, 因此, 都能从植物根际促生菌中找到突破口[3, 8]。
植物根际促生菌的发现和其调控技术的完善为解决我国农业生产中的问题提供了新思路, 其应用潜力已被广泛认可, 越来越多的研究者投身于植物根际促生菌的研究, 大量性能优良的促生菌株被筛选出来, 并有部分已在生产中得到了应用, 其产品也日趋多样化, 如各种含促生菌的微生物肥料、土壤生物改良剂等[9, 10]。本课题组从西北地区不同生境下数十种植物根际分离出了具有不同功效的优良植物根际促生菌上千株, 其中部分菌株已被用来制作生物肥料或促生菌剂[11, 12, 13], 进入中试阶段。Gnyt1菌株是分离自甘肃天祝县高寒草地优势植物珠芽蓼(Polygonum viviparum)根际的一株优良促生菌, 对其进行了初步的研究, 研究数据显示该菌株具有促生性能, 将其试制为促生菌制剂, 发现其具有促进植物生长、提高土壤肥力的作用[14]。但是, 从工业化开发的角度来看, 前期的工作还不够系统, 一般而言, 适合于工业化开发的微生物资源不仅要求其具备良好的功能特性, 而且还必须具备良好的生物学特性, 如较高的生长速度、易于满足的培养条件、生物安全性以及稳定性, 这些方面是工业微生物应用价值非常重要的评判标准, 其性能高低, 直接决定着菌株能否进入规模化开发阶段。鉴于此, 本研究以Gnyt1菌株为材料, 对其性能进行系统的研究, 以期对其有更为全面的认识, 为开发利用奠定基础, 同时也为其他PGPR资源的深入研究提供参考。
试验于2016年6月在甘肃农业大学草业学院实验室进行。菌株Gnyt1现保存于甘肃农业大学草业学院草地生物多样性实验室。对照菌株Jm92、Lx191、LSH11、Jm170等均为课题组前期研究中积累的优良菌株材料, 其特性见表1。
| 表1 对照菌株的特性 Table 1 The characteristics of PGPR strains |
致病性检测试验中供试的青稞(Hordeum vulgare)品种为“ 藏青” , 种子由甘肃省农业科学院提供; 供试番茄(Lycopersicon esculentum)品种为“ 巨粉宝石” , 种子市售; 供试油菜(Brassia campestris)品种为“ 互丰010” , 种子市售; 供试当归(Angelica sinensis)苗购自甘肃省渭源县会川镇; 供试苜蓿(Medicago sativa)品种为“ 甘农三号” , 种子市售。
耐药性检测试验中供试青霉素为注射用青霉素钠(80万单位, 河南新乡华星药厂), 链霉素为注射用硫酸链霉素(100万单位, 华北制药集团爱诺有限公司), 罗红霉素(华北制药集团爱诺有限公司), 头孢拉定(武汉欣欣佳丽生物科技有限公司)。
盆栽所用土壤采挖自甘肃省农业科学院试验田, 加入少量蛭石备用。将准备好的混有蛭石的土壤过3 mm的土壤筛, 辐照灭菌(委托兰州绿源辐照有限责任公司完成), 装入已消毒的花盆(直径18 cm, 深19 cm)备用。
1.2.1 菌株促生特性的测定 采用乙炔还原法(acetylene reduction assay, ARA)测定菌株固氮能力, 以固氮酶活性表示[17, 18]; 采用钼蓝比色法(molybdenum blue colorimetry, MBC)测定溶磷能力[17, 18]; 采用高效液相色谱法(high performance liquid chromatography, HPLC)测定分泌植物激素能力[14]。
1.2.2 菌株生物学特性研究 设置平行实验, 每个温度梯度设3次重复, 分别将活化后菌株接种置于4、8、12、16、20、24、28、32、36、40、44 ℃培养, 在培养第32 h时取样, 测定其OD600和有效活菌数, 对比分析不同温度对菌株生长的影响。
配制溶菌肉汤(Luria-Bertani, LB)培养基(胰蛋白胨10 g, 酵母提取物5 g, NaCl 10 g, 琼脂粉20 g, 蒸馏水定容至1000 mL, 调节至pH 7.0), 灭菌后在无菌条件下使用1 mol· L-1的NaOH溶液和HCl溶液将培养液初始pH值分别调节至2、3、4、5、6、7、8、9、10、11、12、13, 将待测菌株和对照菌株的对数期培养液(24 h)等量接种于不同初始pH的培养液中, 每个梯度设3次重复, 置于28 ℃培养48 h, 测定其OD600和有效活菌数, 对比分析不同pH对菌株生长的影响。
采用滤纸片法[19]分别测试菌株对青霉素、链霉素、罗红霉素、头孢拉定4种抗生素的耐受性。
分别选择青稞、番茄、油菜、当归、苜蓿进行试验, 采用灌根法和叶面接种法, 测试菌株对植物的致病性。
将菌株活化后在LB培养基上连续转接50代, 取其第10、20、30、40、50代的培养物, 分别测试其固氮、溶磷、分泌植物激素(以IAA为指标)的能力, 测试方法如1.2.1所述, 以此对比菌株的稳定性。
1.2.3 供试菌株对青稞的影响 挑选饱满、无破损的种子, 双氧水浸种30 min消毒, 无菌水浸泡2 h, 然后置于25 ℃培养箱内催芽处理, 发芽后挑选长势一致的幼苗进行栽培。每盆栽培15株, 栽培7 d后选择长势一致的幼苗, 每盆留苗10株。将活化后的菌株接种于LB培养液, 180 r· min-1, 28 ℃培养, 血球计数板检验菌体浓度, 待菌体浓度达到108 cfu· mL-1时终止培养, 用移液枪吸取培养液, 滴加到幼苗根部, 每苗加2 mL, 对照为灭菌的LB培养液。置于室温、自然光下培养, 定期浇水。待种子成熟期测定青稞的株高、产量、地上生物量、地下生物量、千粒重等指标。
1.2.4 菌株分类地位的确定 菌株表型特征观察:活化菌株, 进行菌落形态观察、芽孢染色、革兰氏染色[17]。生理生化特征研究:依据国标《食品安全国家标准-食品微生物学检验-蜡样芽胞杆菌检验》[20]的方法, 分别设置动力试验、溶血试验、根状生长测试、溶菌酶耐受性测试、蛋白质毒素结晶测试、V-P测试、柠檬酸盐利用测试、明胶液化测试等生理生化实验, 观察并记录实验结果。
16S rRNA基因分析:用试剂盒(OMEGA)提取菌株总DNA, 琼脂糖凝胶电泳法分析DNA的纯度, 紫外分光光度法测定其纯度[19]。引物选用16S rRNA基因扩增通用引物27F-1492R(由上海派森诺生物科技股份有限公司提供), 序列分别为, 27F:5'-AGAGTTTGATCCTGGCTCAG-3'; 1492R:5'-GGTTACCTTGTTACGACTT-3'。PCR扩增反应体系和扩增反应程序参照李雪萍等[19]的方法。扩增产物检测合格后直接送交测序, 测序工作委托上海派森诺生物科技股份有限公司完成。获得序列后登陆NCBI数据库, 进行BLAST比对。
采用SPSS 19.0软件对试验数据进行One-Way ANOVA分析, Duncan氏新复极差法进行差异显著性检验, Excel 2010绘图, 使用CLUSTALX 1.83软件和MEGA 5.1.2软件构建菌株系统进化树。
2.1.1 菌株固氮及溶磷能力 如表2所示, 对照菌株Jm92、LSH11、Jm170的固氮酶活性均低于Gnyt1, 且Gnyt1菌株的固氮酶活性高出3个对照菌株数十倍之多, 显示了Gnyt1菌株的巨大应用潜力。不同的菌株溶解无机磷的能力不同(表2), 供试菌株的溶无机磷量远高于4个对照菌株, 差异显著(P< 0.05)。4个对照菌株中, LSH11菌株的溶无机磷量最高, 达264.22 μ g· mL-1, 最低的是Jm170, 为33.68 μ g· mL-1。不同菌株溶解有机磷的能力不同, 供试菌株Gnyt1溶解有机磷的能力仅次于Jm92, 而高于LSH11和Lx191两个菌株, 而Jm170未检测出对有机磷的溶解能力, 综上, 可以看出, 菌株Gnyt1溶解有机磷的能力虽非最强, 但也较高, 因此具有开发利用前途。
| 表2 菌株固氮酶活性、溶磷能力的比较 Table 2 Comparison of nitrogen fixation activities, phosphorus dissolving ability of strain(mean± SD, n=3) |
2.1.2 菌株分泌植物激素能力 如表3所示, 供试菌株Gnyt1和4株对照菌株Jm92、Lx191、LSH11、Jm170均有不同程度地分泌植物激素的能力, 说明分泌植物激素能力在PGPR中是一种常见的功能, 但不同菌株分泌植物激素的种类不同, 如Gnyt1和Jm170具有分泌IAA、GA3、t-Z等3种植物激素的能力, 而Jm92有分泌IAA和GA3的能力, LSH11则具有分泌IAA和t-Z的能力, Lx191只能分泌IAA。就同一植物激素来看, 不同菌株分泌能力差别很大, 分泌IAA的能力以供试菌株Gnyt1为最高, 另外两种激素GA3和t-Z的分泌能力也以供试菌株Gnyt1为最高。综上, 就分泌植物激素能力而言, 最突出的为供试菌株Gnyt1, 其不仅分泌植物激素的种类多, 分泌量也最高。
| 表3 样品中植物激素的含量 Table 3 The amount of plant hormones in thesample (mean± SD, n=3) (μ g· mL-1) |
2.2.1 菌株对温度的耐受性 如图1所示, 本研究选用的供试菌株和对照菌都对温度变化具有敏感性, 温度对其生长的影响十分明显, 在4 ℃, 各菌株都停止生长, 而到8 ℃, 各菌株都有微弱的生长, 但生长速率不同, 其中以Jm170生长相对最好。到12 ℃时, 各菌株生长变得较为明显。1628 ℃时, 各菌株都是随生长温度越高、生长越好。但超过28℃, 不同菌株的趋势不同, Lx191、Gnyt1和Jm92的生长速率仍随温度升高而加快, 而其余两株菌则生长受到了抑制, 到36 ℃时, Gnyt1的生长速率与32 ℃接近, 证明Gnyt1的最佳生长温度应在3236 ℃, 而Lx191和Jm92的生长速率则到36 ℃时达到最高。到40 ℃以上, 所有菌株的生长都明显受到了抑制。
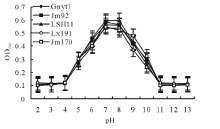
2.2.2 菌株对不同pH的适应能力 如图2所示, 供试菌株Gnyt1和4株对照菌株都对pH具有敏感性, pH值的改变引起菌株生长速率的强烈变化, pH低于4时, 所有菌株都不生长, 酸环境抑制了菌体酶活性, 从而抑制了菌株的生长。在pH为4时, 菌株开始生长, 但生长十分微弱, 在该条件下, 供试菌和对照菌的差异不明显, pH为6时各菌株的生长速率进一步加快, 不同菌株的差异较pH为5时增大; pH为7时, Jm92、LSH11及Jm170等3株菌的生长速率达到最高。而Lx191和Gnyt1两株菌pH为8时的生长速率和pH为7时相近, 推测其最适pH应在7和8之间。当pH继续增大, 到9以上时, 所有菌株的生长都受到了严重的抑制, 但Lx191和Gnyt1两株菌到pH为10时仍能微弱生长, pH为11以上所有菌株停止生长。
2.2.3 菌株的耐药性 本研究选择了几种常见的抗生素, 检验菌株对其耐受性。由图3可以看出, 本研究所测试的目的菌Gnyt1和4种对照菌对青霉素、链霉素、罗红霉素及头孢拉定的反应不同。同一种菌对不同抗生素的敏感程度不同, 以供试菌Gnyt1为例, 其对罗红霉素的敏感性最高, 其抑菌圈半径最大, 其次是青霉素和头孢拉定, 而链霉素的抑菌圈半径最小。而不同菌对同一种抗生素的敏感程度也不同, 以链霉素为例, 菌株Jm92对其极为敏感, 抑菌圈半径较大, 而Lx191的敏感程度最低, 抑菌圈最小, 其余菌株居于二者之间。但总体而言, 本研究选用的5株菌对4种抗生素均没有耐药性, 可见其具有生物安全性。
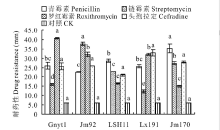 | 图3 菌株的耐药性 CK为无菌水, 不同小写字母表示差异显著。Fig.3 Bacterial resistance 下同。CK is sterile water, and different lowercase letters indicate significant differences. The same below. |
2.2.4 菌株致病性的测定 本试验主要测定了两种处理方式下, 供试菌和对照菌对作物致病的情况。如表4所示, 在菌液灌根的处理组, 5株菌对青稞、番茄、油菜、当归、苜蓿均未发现其有致病性, 证明其在根际并不能引起作物发病。在叶面接种的处理组, Gnyt1、Jm92、Lx191等3株菌对5种植物均不致病, 但LSH11和Jm170处理油菜时, 发现个别植株出现了叶斑病症状, 疑似细菌性叶斑病, 但从该叶斑上, 并没有分离出与LSH11和Jm170相似的菌株, 因此, 其原因还要进一步分析。综上, 供试菌Gnyt1在两种接种方式下供试植物均未发病, 说明Gnyt1菌株具有生物安全性, 有进一步开发利用的潜力。
| 表4 菌株致病性测试结果 Table 4 The pathogenicity of the tested strains |
2.2.5 菌株的性状稳定性 如表57所示, 无论是供试菌Gnyt1, 还是对照菌Jm92、LSH11、Lx191和Jm170, 在纯培养条件下随着菌株传代次数的增加, 其各性状都呈下降趋势。可见, 在纯培养条件下, 菌株功能退化是一种普遍存在的现象。但不同的性状其退化程度有所不同, 如固氮能力和分泌IAA能力退化较为明显, 而溶无机磷能力则退化不明显。
| 表5 菌株的固氮性状稳定性测试结果 Table 5 Results of stability on nitrogen fixation activities (mean± SD, n=3) |
菌株在纯培养条件下(表5), 固氮酶活性随传代次数增加都出现了下降, 但不同菌株变化的趋势有所不同, Gnyt1菌株的下降率略低于其他菌株, 且前30代基本能保持稳定。在纯培养条件下(表6), 菌株分泌IAA的能力随传代次数增加均会下降, 其中LSH11菌株传代到第50代, 分泌IAA能力消失, 而Lx191菌株传代至40代时分泌IAA能力即消失。本研究的目的菌Gnyt1随传代次数增加分泌IAA的能力也在下降, 传代前期下降速度较缓慢, 30代后下降速度加快。
| 表6 菌株的分泌IAA性状稳定性测试结果 Table 6 Results of stability on produce IAA activities (mean± SD, n=3) |
菌株在纯培养条件下(表7), 随传代次数增加, 各菌株的溶磷能力都出现了下降, 但不同菌株变化的趋势有所不同, Gnyt1菌株的下降率略低于其他菌株, 且前30代基本能保持稳定。
| 表7 菌株的溶磷性状稳定性测试结果 Table 7 Results of stability on phosphate solubilization activities (mean± SD, n=3) |
2.3.1 对青稞株高的影响 如图4所示, 青稞种植中施入PGPR菌对青稞株高有显著的促进生长作用。无论是目的菌株Gnyt1, 还是对照菌Jm92、LSH11、Lx191和Jm170, 施入根际后, 均能起到促进青稞生长的作用。但不同菌株促生能力不同, 促生作用最强的是Gnyt1菌株, 其次是Jm92菌株, 结合2.1.1的研究结果可以看出, 这两个菌株有相对较强的固氮能力, 而青稞作为禾本科的作物, 其对氮肥的依赖较高, 因此这两个菌株在青稞根际使用时促生能力突出。促生能力最弱的是LSH11菌株, Jm170和Lx191菌株居中。
2.3.2 对青稞生物量的影响 如图5所示, PGPR对青稞生物量的增加有很明显的促进作用, 施入PGPR制剂后, 无论是地上生物量还是地下生物量, 处理组都较CK有显著的提高。不同菌株对青稞生物量的影响不同, Gnyt1菌株对青稞生物量的促进作用最强, 其次是Jm92和Lx191菌株, 相对最弱的是Jm170菌株。地上生物量和地下生物量的规律基本一致。而将图5和图4进行对比可以发现, 二者变化的趋势相近, 但青稞株高对不同菌株的反应更为敏感。
2.3.3 对青稞产量的影响 单株籽粒产量是评判粮食作物重要的指标, 而千粒重则反映颗粒的大小和饱满程度, 二者是产量构成的重要因素。如图6所示, 促生菌株对青稞的单株产量有很明显的影响, 施入促生菌剂, 青稞的单株籽粒产量有了很明显的增加, 无论是目的菌株Gnyt1, 还是对照菌株Jm92、LSH11、Lx191和Jm170, 其菌剂都能有效提高青稞的单株产量, 证明其确实能增加土壤中氮、磷等养分的含量, 促进植物生长。但不同菌株菌剂的促生效果有差异, 其趋势和生物量及株高基本一致, 均为Gnyt1菌株最强, Jm92和Lx191菌株次之, 相对最弱的是LSH11菌株。如图7所示, 促生菌对青稞的千粒重也有促进作用, 各菌株都有作用, 但不同菌株间的差异不明显。
2.4.1 菌株形态特征 经菌落形态、革兰氏染色、芽孢染色等观察试验, 最终得出:本研究目的菌株Gnyt1菌落呈乳白色, 不透明, 边缘不圆整, 表面不光滑、不隆起, 革兰氏阳性; 菌体长杆状, 具圆端, 链状排列、中生芽孢, 且芽孢椭圆形, 孢囊不膨大。根据形态特征和本课题组前期的研究, 可以初步认为该菌株为蜡样芽孢杆菌组(Bacillus cereus Group)的菌株, 但其为圆端, 与典型的蜡样芽孢杆菌(B. cereus)不符合。
2.4.2 生理生化特征分析 如表8所示为本研究目的菌株Gnyt1和蜡样芽孢杆菌组(B. cereus Group)菌株生理生化特性的对比, 将其结果与国家标准《食品微生物学检验-蜡样芽胞杆菌检验》[20]所规定的指标进行对比, 可以发现, Gnyt1菌株的生理生化特性与蕈状芽孢杆菌(Bacillus mycoides)的生理生化特征的吻合度为100%。
| 表8 Gnyt1菌株的生理生化特性与蜡样芽孢杆菌组内菌株对照 Table 8 Physiological and biochemical characteristics of strain Gnyt1 and comparison of strains in the Bacillus cereus Group |
2.4.3 16S rRNA基因序列分析 通过在GenBank数据库中进行BLAST比对(图8), 与Gnyt1菌株16S rRNA基因序列相似度较高的菌株有炭疽杆菌(Bacillus anthracis)、蜡样芽孢杆菌、Bacillus toyonensis、苏云金芽孢杆菌(Bacillus thuringiensis)、蕈状芽孢杆菌、Bacillus weihenstephanensis、兵马俑芽胞杆菌(Bacillus bingmayongensis)、假真菌样芽孢杆菌(Bacillus pseudomycoides)等, 其中, 与蕈状芽孢杆菌和Bacillus weihenstephanensis的相似度最高, 达100%。
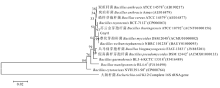 | 图8 Gnyt1菌株的系统进化分析Fig.8 The phylogenetic tree of strain Gnyt1 and its closely related type strains in the same group |
2.4.4 Gnyt1菌株分类地位的确定 结合表型特征的观察结果、生理生化特性的分析以及16S rRNA基因序列分析的结果, 最终初步确定Gnyt1菌株为蕈状芽孢杆菌(B. mycoides)(但其准确分类地位还需要依靠二者之间的DNA-DNA同源性杂交等实验结果来确定), 该菌株由甘肃农业大学草业学院草地微生物多样性实验室保存, 保存系列编号为GAU-48。将该菌株提交至中国典型培养物保藏中心专利保藏, 保藏号为CCTCCM 2017177。将Bacillus mycoides Gnyt1菌株16S rRNA基因序列提交至NCBI, 获得序列登陆号为:KY887028。
本研究所选用的供试菌株Gnyt1和优良的对照菌株Jm92、LSH11、Lx191、Jm170均具有多功能性, 即都具有两种或两种以上的促生能力。但Gnyt1促生性能最为突出, 其固氮酶活性为3193.04 nmol C2H4· h-1· mL-1, 高出优良对照菌株中固氮能力最强菌株Jm92数十倍之余, 显示了其巨大的固氮潜力。微生物固氮是除了植物光合作用之外地球上第二重要的生物化学反应, 具有固氮能力的微生物将存在于空气或土壤中的氮素通过固氮酶的催化作用而形成植物可以吸收利用的氮素, 要比人类发明的化学固氮在效率上优越的多[21]。此外, Gnyt1对无机磷溶解量为564.34 μ g· mL-1, 比对照菌株中溶解无机磷最强菌株LSH11更突出, 有研究表明, 溶磷量的多寡与分泌有机酸的能力有关, 这些有机酸可降低土壤局部的pH值, 使一些难溶性磷酸盐在酸性条件下分解; 还使一些与有机酸结合的金属离子(如Al3+、Fe3+、Ca2+、Mg2+)发生络合或鳌合, 减少了易与磷酸根结合的金属阳离子, 使磷酸根离子被释放出来[22], 使无机磷有效的溶解和被植物吸收。此外, 其分泌的植物激素不仅种类多, 分泌量也最高, 而其他对照菌株分泌植物激素的能力都弱于Gnyt1, 如Lx191只有分泌IAA能力, 没有分泌植物激素GA3和t-Z的能力。马文彬[18]研究发现, 菌株分泌的植物激素不仅促进植物吸收矿物质和水分, 还可抑制病原微生物, 使植物的生理活性提高, 促进植物生长发育。一般而言, 植物的生长并不是某一个因素的作用, 它是诸多环境因子共同作用的结果, 因此, 针对某个单一因素的改善其效果往往有限且容易顾此失彼, 例如化肥, 就是单一的增加某种成分, 虽然能在一定程度上起到增产的作用, 但是“ 顾此失彼” 的情况也不容忽视, 短期产量增加了, 土壤质量的破坏也很严重。Gnyt1的多功能性正好弥补了这种缺陷, 因为其功能多样, 所以能够全面、均衡的提高土壤质量, 提高农作物产量, 这也正是Gnyt1制剂作为微生物肥料的潜力所在。
无论是供试菌株Gnyt1, 还是对照菌株Jm92、LSH11、Lx191和Jm170, 在纯培养条件下, 固氮性状、溶磷能力和分泌植物激素性状都随着菌株传代次数的增加其能力呈下降趋势。可见, 在纯培养条件下, 菌株功能退化是一种普遍存在的现象, 但菌株Gnyt1有强大的固氮、溶解有机磷、分泌植物激素的能力, 即使在培养至第50代, Gnyt1的固氮酶活性和溶解无机磷量仍比其他对照菌株强, 分别为1256.31 nmol C2H4· h-1· mL-1和287.51 μ g· mL-1。如韩华雯等[12]2013年测定Jm92菌株的固氮酶活性为75.34 nmol C2H4· h-1· mL-1, 而本研究的测定为61.82 nmol C2H4· h-1· mL-1, 还有如Lx191菌株的溶解无机磷能力, 冯瑞章等[13]在2009年测定其无机磷增量时数值为200.2 μ g· mL-1, 而本研究中仅为173.08 μ g· mL-1, 下降很明显, 排除了测定方法的误差, 推测其与菌株特性的退化有关。Gnyt1不同性状其退化程度有所不同, 如固氮能力和分泌IAA能力退化较为明显, 而溶解无机磷能力则退化不明显。分析其原因, 菌株溶解无机磷, 主要是菌株产酸引起的, 是细胞的基本功能之一, 而分泌IAA和固氮, 则非必要功能[23], 故不同菌株之间退化程度也有所不同。要解决此类业界难题, 一方面要不断地选育和改良菌株, 另一方面, 更要不停地从不同的环境中分离筛选, 得到更好的菌株。
近年来, 抗生素在农业上已成为防治病害的重要手段。而随着抗生素的滥用, 由此导致的环境恶化、病原菌耐药性增强、药物残留以及相关食品安全性等问题也日益为人们所关注[23]。有研究发现抗生素的广泛应用导致的细菌耐药性及抗生素抗性基因污染比较普遍[24], 因此, 工业微生物的开发, 应该充分重视耐药性的问题, 本研究对供试菌株进行了耐药性验证, 结果发现菌株Gnyt1对罗红霉素和头孢拉定的敏感性最高, 其次是青霉素, 而链霉素最弱, 但总体而言, 菌株对4种抗生素均没有耐药性, 可见其具有生物安全性。通过对菌株温度的测定表明, 菌株Gnyt1的最佳生长温度为3236 ℃, 而对照菌株Lx191和Jm92的生长速率在36℃时达到最高, 到40 ℃以上, 所有菌株的生长都明显受到了抑制, 徐岩[25]研究表明在发酵工业中, 微生物生长的温度一般在2040 ℃, 在发酵过程中, 需要控制适当的温度, 才能使菌体生长和代谢产物的合成顺利进行。靳国杰等[26]研究发酵温度(1525 ℃)对霞多丽干白葡萄酒香气质量的影响, 发现随发酵温度的升高, 葡萄酒的果香特征(青苹果、菠萝、香蕉、柠檬、梨等)先增后减。较高的发酵温度有利于形成甜果香与不良气味。由此可见, 菌株Gnyt1在发酵工程中也具有良好的应用前景。
刘二伟等[27]研究发现发酵液培养基的pH对微生物生长具有非常明显的影响, pH也是影响发酵过程中各种酶活的重要因素。大多数微生物生长的pH范围是68, 最适pH在7和8之间。本实验发现Lx191和Gnyt1两株菌pH为8时的生长速率和pH为7时相近, 推测其最适pH应在7和8之间。当pH继续增大, 到9以上时, 所有菌株的生长都受到了严重的抑制, 但Lx191和Gnyt1两菌株在pH为10时仍能微弱生长, pH为11以上所有菌株停止生长。pH是发酵过程中重要的环境因子, 它的改变会引起各种酶活的变化, 影响菌体对基质的利用, 甚至改变菌体的代谢途径和细胞结构, 最终影响产品的形成, 且每种微生物都有适合生长的范围, 同一种微生物在不同的生长阶段和不同生化过程中, 对环境pH也有不同的要求[27]。
在菌液灌根的处理组, 菌株对青稞、番茄、油菜、当归、苜蓿均未发现其有致病性, 无致病性的菌株是优良微生物肥料的关键所在。工业微生物不仅要具备卓越的功效, 还应满足工业化生产的需要, 如较高的生长速度、易于满足的培养条件、生物安全性以及稳定性, 这些方面是工业微生物应用价值非常重要的评判标准, 其性能高低, 直接决定着菌株能否进入规模化开发的阶段[28]。
本研究发现施入促生菌剂, Gnyt1菌株对青稞生物量的促进作用最强, 地上生物量和地下生物量的规律基本一致; 单株籽粒产量有了很明显的增加, 无论是目的菌Gnyt1, 还是对照菌Jm92、LSH11、Lx191和Jm170, 其菌剂都能有效提高青稞的单株产量, 促进植物生长。但不同菌株菌剂的促生效果有差异, 其趋势和生物量及株高基本一致, 均为Gnyt1菌株最强, Jm92和Lx191菌株次之, 相对最弱的是Jm170菌株。韦泽秀等[29]研究发现施用谷特菌能提高青稞分蘖能力, 促进青稞群体生长; 其次, 谷特菌能促进青稞根系发育, 有利于青稞抗倒伏, 在拔节期施用谷特菌能提高青稞灌浆能力, 增加青稞穗粒数, 提高青稞产量, 而本研究也得到了相似的结论。
本课题组刘婷[14]曾对Gnyt1菌株进行过鉴定, 当时鉴定认为其为蜡样芽孢杆菌(B. cereus), 该结论是基于16S rRNA基因序列得出的, 本研究在后期研究中, 发现该菌株与典型的B. cereus有差异, 原因如下:1)菌体形态, B. cereus末端为方形, 而Gnyt1菌株末端为圆形; 2)根状生长试验中, Gnyt1菌株为阳性, 而B. cereus的根状生长试验的结果应为阴性(GB 4789.14-2014); 3)动力试验的结果是Gnyt1菌株沿穿刺线呈绒毛状生长, 而典型的B. cereus应沿穿刺线扩散生长。以上3个现象与鉴定结果相矛盾, 为解决这一疑惑, 本研究运用了国标《食品安全国家标准-食品微生物学检验-蜡样芽胞杆菌检验》(GB 4789.14-2014)[20]的方法, 对该菌株的分类地位进行了重新确定, 在此基础上, 还运用了16S rRNA基因分析技术进行再次鉴定, 结果发现, 该菌株的某些特征与典型的蜡样芽孢杆菌并不匹配, 而与B. mycoides完全吻合。将16S rRNA基因序列在GenBank数据库中进行比对, 结果序列与B. mycoides和B. cereus的相似度都很高, 结合表型特征和生理生化实验特征, 认为该菌株归属到B. mycoides更为适合。B. mycoides和B. cereus均为B. cereus group的菌株, 表型和16S rRNA基因序列的相似度均很高, 因此鉴别存在困难, 本研究采用了多种鉴定方法相结合的手段, 将其分类地位确定为Bacillus mycoides。
本研究以课题组前期研究中获得的优良菌株Gnyt1为研究对象, 从菌株特性和全基因组序列信息两个角度入手, 对Gnyt1菌株进行了较为深入的研究, 得到以下结论:1)Gnyt1菌株具有较强的固氮、溶磷以及分泌植物激素的能力; 2)Gnyt1菌株具有生长速度快、稳定期活菌浓度高, 适合高密度发酵, 对温度和pH的适应范围较宽的特点; 此外, 其没有耐药性和致病性。但在纯培养条件下, 随传代次数增加, 促生特性下降, 传代至第30代以后, 促生特性下降明显; 3)盆栽实验显示Gnyt1菌株可以促进植物(青稞)的生长, 增加农作物子实体和营养体的产量, 提高有效成分的含量; 4)结合表型特征、生理生化特征、16S rRNA基因序列特征等方面, 将Gnyt1菌株鉴定为蕈状芽孢杆菌Bacillus mycoides。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|