作者简介:张翠梅(1994-),女,甘肃华池人,在读博士。E-mail: Zhangcm1710@163.com
以强抗旱陇中苜蓿、中抗旱陇东苜蓿和弱抗旱甘农3号紫花苜蓿为试验材料,采用营养液沙培法,以-1.2 MPa PEG-6000模拟干旱胁迫,比较不同胁迫时间(0、3、6、9、12和15 d)对不同抗旱性苜蓿品种幼苗根系形态及解剖结构的影响。结果表明:随胁迫时间的延长,陇中苜蓿的根尖数、根系干重、根系总长度、根系总表面积和木质部面积不断增大;陇中苜蓿和陇东苜蓿的维管束直径、维管束面积和韧皮部面积均不断增大;甘农3号的根系总长度、根系总表面积及皮层占根系直径比例不断增大,而其根系干重、原生和次生木质部导管直径、维管束直径及维管束面积不断减小。胁迫6 d后,陇中苜蓿和陇东苜蓿的根系总长度、根系总表面积和根体积均显著高于甘农3号;胁迫9 d后,陇中苜蓿根系平均直径、根体积、根系干重、维管束面积、木质部面积和次生木质部导管数目均显著高于陇东苜蓿和甘农3号。供试苜蓿均可通过增加根系总长度及次生木质部导管数目响应干旱胁迫。此外,陇中苜蓿可通过增加根体积、根尖数和改善根系解剖结构来适应干旱;陇东苜蓿通过增加维管束直径、维管束面积和韧皮部面积来适应干旱。相比之下,胁迫时间超过9 d时,甘农3号内部输导组织结构的变化削弱了其输导水分的能力。
This research studied the effects of drought stress on root morphology and anatomical structure of alfalfa ( Medicago sativa) varieties with differing drought tolerance. At the seedling stage, M. sativa cv. Longzhong (strongly drought-tolerant), Longdong (moderately drought-tolerant) and Gannong No.3 (drought-sensitive) were exposed to 15 days of drought stress simulated by PEG-6000 with a water potential of -1.2 MPa. Root samples of each variety were collected every 3 days. With increasing stress exposure time, root tip number, root dry weight, total root length, total root surface area and xylem area of Longzhong as well as vascular bundle diameter and the areas of vascular bundle and phloem in roots rose continuously, as expected in growing seedlings. Meanwhile, for Longdong only the latter three measures rose continuously. For Gannong No. 3, total root length, total root surface area, and the proportion of cortex thickness to root diameter increased continuously while the root dry weight, primary and secondary xylem vessel diameters, vascular bundle diameter and vascular bundle area continuously decreased. After 6 days stress, total root length, total root surface area and root volume in Gannong No.3 were significantly lower than those in Longzhong and Longdong. After 9 days stress, the average root diameter, root volume and root dry weight, vascular bundle area, xylem area and the number of secondary xylem vessels were all significantly higher in Longzhong than in Longdong and Gannong No.3. The common responses of the tested alfalfa varieties to drought were an increased total root length and number of secondary xylem vessels. Moreover, Longzhong showed significant advantages of increased root volume and root tip number and improved root anatomical structure; Longdong was able to enhance vascular bundle diameter and the areas of vascular bundle and phloem to adapt to drought stress. In contrast, when the stress exposure time exceeded 9 days, the ability of Gannong No.3 plants to transport water was curtailed because of alterations in its internal conducting tissue.
干旱是制约世界生态环境、植物分布和生产力的最基本因素。全球干旱、半干旱地区约占陆地面积的35%, 且有逐年增加的趋势。干旱胁迫所导致的作物减产, 超过其他环境胁迫所造成减产的总和[1, 2]。紫花苜蓿(Medicago sativa)是世界上栽培最广的一种优良豆科牧草, 具有较高的经济价值和社会效益。紫花苜蓿作为我国西北干旱和半干旱地区主栽牧草, 对该地区畜牧业的发展和生态环境的改善发挥着重要作用[3, 4]。然而, 我国西北地区日益加剧的干旱和土地盐渍化, 已对紫花苜蓿的分布及产量构成了严重威胁[5, 6]。
根系是植物吸收、转化和储藏营养物质的重要器官, 其生长发育受到自身遗传因素和外部环境的共同影响。当出现水分短缺时, 根系能最先感知土壤中的水分亏缺并作出相应反应[7]。根系生长的好坏直接影响地上部的生长、形态建成及产量, 而植物根系的解剖结构和形态特征是其生长发育水平和对外界环境适应的直接体现, 最终影响植物的抗旱能力[7, 8, 9]。前人对干旱胁迫下, 玉米(Zea mays)[9], 小麦(Triticum aestivum)[10, 11], 达乌里胡枝子(Lespedeza davurica)[12]和紫穗槐(Amorpha fruticosa)[13]幼苗根系的解剖结构研究发现, 根系皮层厚度减小、内皮层加厚、导管数量增加、导管管壁增厚、导管直径降低、韧皮部的薄壁组织细胞壁强烈木质化和根直径变细等是植物响应干旱胁迫适应性的表型特征。此外, 根系的一些形态特征指标, 如根长、根体积、根直径、根系干重等能够反映根系的健壮程度, 可作为抗旱性评价的根系形态指标[8, 14, 15]。
紫花苜蓿具有发达的直根系统, 与农作物相比, 可利用更深层的土壤水分, 表现出较强的耐旱性[16]。前人已对苜蓿根系生长发育特性及形态解剖学观察等方面做了相关研究。白文明等[17]、郭正刚等[18]、万素梅等[19] 和陈积山等[20]的研究表明, 紫花苜蓿根系形态性状(总根长、根系生物量与根冠比)与植株水分利用效率间具有显著相关性。主根长、侧根数、根系总体积和根系生物量在不同紫花苜蓿品种间差异显著。李文娆等[21]研究发现, 干旱胁迫下, 苜蓿的根系表面积和直径≥ 1 mm的侧根数目显著增加, 主根变细、根系生物量下降, 且这些变化的幅度随生长年限的增长而减弱。田晨霞等[22]研究表明, 盐碱胁迫促进了苜蓿根部的发育, 主要表现在根部直径显著变粗, 木质导管直径显著变小但数量增多。程伟燕等[23]研究发现, 抗旱的特莱克紫花苜蓿(Rec M. sativa)根系较深, 侧根分布密集, 根表皮的最外层细胞排列紧密。综上所述, 不同紫花苜蓿品种的生长发育能力不同, 且在适应水分亏缺, 降低水分消耗时所采取的抗旱策略也不同。然而, 目前有关干旱胁迫对不同抗旱性苜蓿品种根系形态及解剖结构影响的研究相对较少。因此, 本研究采用-1.2 MPa PEG-6000模拟干旱胁迫, 分析比较干旱胁迫对不同抗旱性苜蓿品种根系形态特征及解剖结构的影响, 以期阐明苜蓿根系抗旱能力与其形态及解剖结构之间的联系, 为进一步深入研究苜蓿的抗旱机制提供一定的理论依据。
以3个不同抗旱性紫花苜蓿品种, 即强抗旱陇中苜蓿(M. sativa cv. Longzhong)、中抗旱陇东苜蓿(M. sativa cv. Longdong)和弱抗旱甘农3号紫花苜蓿(M. sativa cv. Gannong No.3)为试验材料[24]。种子由甘肃农业大学草业生态系统教育部重点实验室提供。
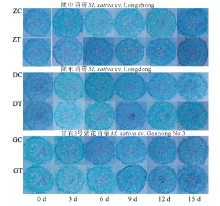
2017年 9 月, 在甘肃农业大学草业学院采用营养液沙培法, 选用灭菌后的细沙(121 ℃, 高温灭菌26 min), 装入高度为11 cm, 直径为9 cm的培养钵中, 摆放在长× 宽× 高(25 cm× 15 cm× 10 cm)的塑料方盆中。选取饱满且大小一致的苜蓿种子经0.1% HgCl2溶液消毒5 min后, 用蒸馏水冲洗干净, 再用吸水纸吸干, 均匀播种于培养钵中, 播种后转移至光照培养室中[每天光照14 h, 光通量密度400 μ mol· m-2· s-1, 昼夜温度分别为(25± 1) ℃和(20± 1) ℃, 相对湿度60%左右]。每天浇水保证其正常出芽, 10 d后进行间苗, 每钵保留10株长势一致的幼苗, 并采用Hoagland营养液浇灌。幼苗生长至42 d时, 每隔2 d每盆浇灌300 mL含PEG-6000(水势为-1.2 MPa)的Hoagland营养液进行胁迫处理, 以仅含Hoagland营养液的处理为对照, 连续培养15 d, 分别在处理后0、3、6、9、12和15 d取苜蓿幼苗根系测定根系形态特征及观察根系解剖结构。
1.3.1 幼苗根系形态特征及根系干重测定 根系形态:将各处理的根系用去离子水冲洗干净, 采用台式扫描仪(Epson Experssion 10000XL, EU-88, Seiko Epson Corp., Japan)对根系进行扫描并将图像存入电脑, 扫描仪的分辨率为300 dpi。采用WinRHIZO根系分析系统软件(Regent Instruments, Inc., Quebec, Canada)对根系的图像进行分析, 测量根系总长度、根系总表面积、根系平均直径、根体积和根尖数等特征参数。每个处理重复6次。
采用烘干法测定根系干重。处理结束后, 将各处理的苜蓿幼苗用去离子水冲洗干净, 按地上部和地下部分开, 取苜蓿幼苗根系, 擦干水分, 105 ℃杀青 15 min, 70 ℃烘干至恒重后称重。
1.3.2 苜蓿幼苗根系解剖结构观察 参照李和平[25]的方法制作石蜡切片观察苜蓿幼苗主根的解剖结构。用蒸馏水冲洗根系样品, 滤纸吸干表面水分后切成 0.3 cm 根段, 以福尔马林-乙酸-乙醇(formalin-aceto-alcohol, FAA)固定液(90 mL 50%乙醇+5 mL 38%甲醛+5 mL 冰乙酸)固定。采用 LEICA (Germany)全自动切片机制作高精度切片(厚 8 μ m), 番红/固绿双重染色, 使用生物光学显微镜(Zeiss Axioskop 40 Germany)观察石蜡切片中根系解剖结构并实行同期拍照。 采用Axio-Vision软件测算根系解剖结构特征参数, 包括维管束直径和维管束面积、木质部面积、韧皮部面积、木质部导管直径和数目、皮层厚度和根直径。每个处理取6个样本, 每个样片随机选取 10个视野。
采用Microsoft Excel 2010和Origin 8.0软件整理数据, SPSS 19.0 软件进行显著性方差分析, Photoshop CS5软件进行图片合成。
2.1.1 干旱胁迫对不同抗旱性苜蓿品种根系总长度和根系总表面积的影响 随胁迫天数的延长, 供试苜蓿的根系总长度和根系总表面积均呈不断增加的趋势(图1)。整个胁迫期间, 陇中苜蓿和陇东苜蓿的根系总长度均显著高于甘农3号, 且在胁迫第15天时, 分别较甘农3号高出33.07%和27.85%(P< 0.05)。胁迫第15天时, 陇中苜蓿、陇东苜蓿和甘农3号的根系总长度均增至最高值, 分别较对照高出32.10%、8.89%和20.10%(P< 0.05)。胁迫第3至15天时, 供试苜蓿的根系总表面积与对照相比差异不显著, 但陇中苜蓿的根系总表面积均显著高于甘农3号。
2.1.2 干旱胁迫对不同抗旱性苜蓿品种根系平均直径和根体积的影响 随胁迫天数的增加, 供试苜蓿的根系平均直径及陇中苜蓿和陇东苜蓿的根体积均呈不断增大的趋势(图2)。胁迫第0至6天时, 陇中苜蓿和陇东苜蓿的根体积均显著高于甘农3号。胁迫第9和15天时, 陇中苜蓿的根系平均直径和根体积均显著高于对照, 且在胁迫第15天时, 分别较对照高出23.63%和116.00%(P< 0.05)。胁迫第9至15天时, 陇中苜蓿的根系平均直径和根体积均显著高于陇东苜蓿和甘农3号。胁迫第15天时, 陇中苜蓿根系平均直径较陇东苜蓿和甘农3号分别高出12.58%和25.38%, 根体积较两个品种分别高出56.73%和240.52%(P< 0.05)。
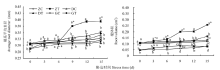 | 图2 干旱胁迫对不同抗旱性苜蓿品种根系平均直径和根体积的影响Fig.2 Effects of drought stress on average root diameter and root volume of different drought-tolerant alfalfa varieties |
2.1.3 干旱胁迫对不同抗旱性苜蓿品种根尖数和根系干重的影响 随胁迫时间的延长, 陇中苜蓿的根尖数和根系干重不断增加; 甘农3号的根系干重不断下降; 而陇东苜蓿的根尖数和根系干重与对照相比差异不显著(图3)。胁迫第6天时, 陇中苜蓿的根尖数开始显著增加, 而甘农3号的根系干重开始显著下降(P< 0.05)。胁迫第6至15天时, 陇中苜蓿和陇东苜蓿的根尖数均显著高于甘农3号。胁迫第9至15天时, 陇中苜蓿的根系干重均显著高于陇东苜蓿和甘农3号, 但后两者的根系干重变化差异不显著。胁迫第15天时, 陇中苜蓿的根尖数较陇东苜蓿和甘农3号高出24.51%和16.12%, 根系干重较两个品种分别高出85.94%和107.37%(P< 0.05)。
2.2.1 干旱胁迫对不同抗旱性苜蓿品种幼苗主根维管束直径和维管束面积的影响 随胁迫时间的延长, 陇中苜蓿和陇东苜蓿的维管束直径和维管束面积呈不断增大的变化趋势, 而甘农3号的维管束直径和维管束面积在胁迫第12和15天时显著低于对照(图4)。胁迫第0和3天时, 陇中苜蓿和陇东苜蓿的维管束直径和维管束面积均显著高于甘农3号。胁迫第9至15天时, 陇中苜蓿的维管束面积均显著高于陇东苜蓿和甘农3号。胁迫第15天时, 陇中苜蓿和陇东苜蓿的维管束直径分别较对照增加了11.86%和19.88%, 两者的维管束面积分别较对照增加了25.15%和36.94%; 甘农3号的维管束直径和维管束面积却较对照下降了16.92%和31.11%(P< 0.05); 此外, 陇中苜蓿的维管束直径较陇东苜蓿和甘农3号分别高出16.73%和42.08%, 维管束面积较陇东苜蓿和甘农3号分别高出24.39%和75.46%(P< 0.05)。
 | 图4 干旱胁迫对不同抗旱性苜蓿品种主根维管束直径和维管束面积的影响Fig.4 Effects of drought stress on vascular bundle diameter and vascular bundle area in the taproots of different drought-tolerant alfalfa varieties |
2.2.2 干旱胁迫对不同抗旱性苜蓿品种幼苗主根木质部面积和韧皮部面积的影响 随胁迫时间的延长, 陇中苜蓿的木质部面积及陇中苜蓿和陇东苜蓿的韧皮部面积呈不断增大的趋势, 而甘农3号的韧皮部面积自胁迫第12天时显著减小(图5)。胁迫第6至15天时, 陇中苜蓿的木质部面积均显著高于陇东苜蓿和甘农3号; 且在胁迫第15天时, 较陇东苜蓿和甘农3号分别高出64.23%和57.68%(P< 0.05)。整个胁迫期间, 除胁迫第6天外, 陇中苜蓿的韧皮部面积均显著高于甘农3号。胁迫第15天时, 陇中苜蓿和陇东苜蓿的韧皮部面积分别较对照增加了34.24%和67.16%, 而甘农3号的韧皮部面积较对照下降了38.71%(P< 0.05)。陇中苜蓿和陇东苜蓿的韧皮部面积较甘农3号分别高出87.84%和72.40%(P< 0.05), 而陇中苜蓿和陇东苜蓿的韧皮部面积差异不显著。
 | 图5 干旱胁迫对不同抗旱性苜蓿品种主根木质部面积和韧皮部面积的影响Fig.5 Effects of drought stress on xylem area and phloem area in the taproots of different drought-tolerant alfalfa varieties |
2.2.3 干旱胁迫对不同抗旱性苜蓿品种主根木质部导管直径和数目的影响 随胁迫时间的延长, 供试苜蓿的原生木质部导管直径和次生木质部导管直径均呈先增大后减小的变化趋势(图6A, C)。胁迫第9至15天时, 甘农3号的次生木质部导管直径均显著低于对照。胁迫第9至12天时, 陇中苜蓿的次生木质部导管直径均显著高于陇东苜蓿(P< 0.05)。胁迫第15天时, 陇中苜蓿和陇东苜蓿的原生木质部导管直径较甘农3号分别高出15.50%和15.61%, 次生木质部导管直径分别较甘农3号分别高出24.07%和20.83%(P< 0.05)。
 | 图6 干旱胁迫对不同抗旱性苜蓿品种主根木质部导管直径和数目的影响Fig.6 Effects of drought stress on the xylem vessels diameter and number in the taproots of different drought-tolerant alfalfa varieties |
供试苜蓿的原生木质部导管数目变化因品种不同而异, 次生木质部导管数目随胁迫时间的延长呈不断增多的变化趋势(图6B, D)。整个胁迫期间, 陇中苜蓿和陇东苜蓿的原生木质部数目与对照相比差异不显著。胁迫第3至12天时, 陇东苜蓿的次生木质部导管数目均显著高于对照; 陇中苜蓿的次生木质部导管数目仅在胁迫第12和15天时显著高于对照。 胁迫第6至15天时, 陇中苜蓿的次生木质部导管数目均显著高于陇东苜蓿和甘农3号; 且在胁迫第15天时, 分别较陇东苜蓿和甘农3号高出40.24%和33.72%(P< 0.05)。
2.2.4 干旱胁迫对不同抗旱性苜蓿品种主根皮层厚度和皮层厚度占根系直径比例的影响 随胁迫天数的增加, 供试苜蓿的皮层厚度及陇东苜蓿和甘农3号的皮层厚度占根系直径比例呈不断增大的趋势(图7)。陇中苜蓿、陇东苜蓿和甘农3号的皮层厚度分别在胁迫第6、9和12天时开始显著增加; 且在胁迫第15天时增至最高值, 分别较对照高出22.61%、38.49%和35.05%(P< 0.05)。胁迫第3至9天时, 陇中苜蓿的皮层厚度均显著高于甘农3号, 而陇东苜蓿的皮层厚度仅在胁迫第3天时显著高于甘农3号。胁迫第12和15天时, 以甘农3号的皮层厚度占根系直径比例最大, 分别较陇中苜蓿和陇东苜蓿高出40.33%、33.37%和60.02%、36.46%(P< 0.05)。
2.2.5 干旱胁迫下不同抗旱性苜蓿品种幼苗主根解剖结构的变化 由以下根系主根组织解剖图可知(图8), 干旱胁迫明显促进了供试苜蓿根系输导组织的发育。在同一显微倍数下, 随胁迫时间的延长, 和对照相比, 陇中苜蓿和陇东苜蓿的维管束面积增大, 而甘农3号的维管束面积则减小; 供试苜蓿的木质部导管数目增多, 排布较为密集, 且在胁迫第12和15天时, 陇中苜蓿根系内的导管较其他两个品种排布得更为密集。
植物的根系是直接吸收和利用土壤中水分与养分的器官, 地下根系的生长状况很大程度上决定了地上部分的生长。根系结构能够直接反映植物根系的生长状况, 所以研究干旱胁迫下植物的根系结构的变化对明确其生长发育具有重要意义[20]。前人研究表明[18, 19, 21, 26], 抗旱性强的紫花苜蓿品种主要通过根长的增长、根体积的增加及根系直径变细来响应干旱。本研究中, 供试苜蓿的根系总长度均随胁迫时间的延长而不断增加, 说明干旱胁迫会显著影响苜蓿根系的发育及形态, 同时改变苜蓿根系生长的进程。陇中苜蓿还可通过显著增加根体积, 增大根系与周围环境的接触机会, 以保证吸收更多的水分与养分。张规富等[27]对油茶(Camellia oleifera)幼苗根系形态的研究中也得出过相似的结果。此外, 不同抗旱性苜蓿品种响应干旱胁迫时存在着形态学差异[28]。本研究中, 胁迫第9至15天时, 陇中苜蓿的根系平均直径、根体积和根系干重均显著高于陇东苜蓿和甘农3号。胁迫第15天时, 陇中苜蓿的根系平均直径、根体积和根尖数均显著高于对照, 但陇东苜蓿和甘农3号的以上指标与对照相比差异不显著。说明重度胁迫时, 强抗旱陇中苜蓿能及时通过改变根系形态特征, 获取更多的水分, 减少水分不足对其生长的影响[29]。相比之下, 陇东苜蓿和甘农3号通过改变其根系形态特征适应重度胁迫的能力较弱。干旱胁迫下, 陇中苜蓿的根系干重显著增加, 甘农3号的根系干重显著降低; 而陇东苜蓿的根系干重未发生显著变化。说明不同抗旱性苜蓿品种体内光合作用产物向根系分配的策略不同, 而陇中苜蓿体内光合作用产物向根系分配能力可能强于甘农3号[30]。
根系吸水主要是水分经过根表皮、皮层、内皮层到达中柱木质部导管, 并沿导管向上运输的过程, 因而水分在根内的吸收和运输与根系的解剖结构密切相关。根系解剖结构对干旱胁迫的适应性特征也是重要的根系抗旱表型指标[31]。根系皮层组织的结构和性质会影响根系总的新陈代谢消耗, 内外皮层细胞壁的木栓化程度影响径向水分流动, 木质部导管的数量和直径影响轴向水分运输[8, 32]。正常供水及胁迫条件下, 植物根系皮层厚度占根系直径比例与其抗旱性成负相关[11, 33, 34]。本研究发现, 随胁迫时间的延长, 供试苜蓿的皮层厚度均不断增大, 胁迫第3至9天时, 陇中苜蓿的皮层厚度显著高于甘农3号; 胁迫第12至15天时, 供试苜蓿品种间皮层厚度变化差异不显著, 而甘农3号的皮层厚度占根系直径比例显著高于陇中苜蓿和陇东苜蓿。说明干旱胁迫下, 甘农3号根系皮层厚度增加的幅度可能要高于根直径的增加幅度, 但皮层厚度的增加会增大根系运输水分的阻力, 从而使其在根系吸水能力和根水流导度方面表现出劣势。前人对干旱胁迫下玉米根系解剖结构的研究中也得出过相似的结论[33, 34]。
维管柱主要由中柱鞘、木质部和韧皮部组成, 用于输导水分、营养物质, 并有一定支持功能。木质部中最重要的输水组织是导管, 主要起输导水分及支持作用[7]。王周锋等[33]和刘胜群等[9]研究表明, 相比不耐旱玉米品种, 耐旱玉米初生胚根的木质部导管数量较多且导管直径较小。本研究发现, 干旱胁迫下, 苜蓿根系维管柱的解剖结构变化因苜蓿品种及胁迫时间不同而异。随胁迫时间的延长, 陇中苜蓿和陇东苜蓿的维管束直径、维管束面积和韧皮部面积均不断增大; 而甘农3号的维管束直径和维管束面积均在胁迫第12至15天时显著下降。胁迫第9至15天时, 陇中苜蓿的维管束面积和木质部面积均显著高于陇东苜蓿和甘农3号。说明强抗旱苜蓿品种的输导组织较弱抗旱性苜蓿品种发达。随胁迫时间的延长, 陇中苜蓿通过增大其根系输导组织内部的维管束面积、木质部面积和韧皮部面积, 提高运输水分的能力, 表现出明显的抗旱优势; 而重度干旱胁迫可能会限制陇东苜蓿和甘农3号维管束输导水分的能力。
前人研究表明, 根系导管直径变小是甘草(Glycyrrhiza uralensis)和紫穗槐幼苗响应干旱胁迫的适应性特征[13, 35], 而赵祥等[12]则认为, 导管直径越大, 越有利于植物体内水分运输。本研究发现, 胁迫第0至12天时, 供试苜蓿的次生木质部导管数目随胁迫时间的延长呈不断增多的变化趋势; 胁迫第15天时, 陇中苜蓿和甘农3号的次生木质部导管直径均显著低于对照。说明干旱胁迫下, 根系导管数目增多是苜蓿响应干旱胁迫的共性反应; 根系导管直径变小可能是陇中苜蓿和甘农3号适应重度干旱胁迫, 增强抗性所做出的主动响应[36]。相比之下, 陇东苜蓿在响应干旱胁迫时根系导管直径变化不敏感。以上结果说明不同植物根系木质部导管组织响应干旱胁迫时的变化策略不同, 这些变化最终会影响到其对水分的输导能力及抗水分胁迫能力[7, 8, 11]。此外, 胁迫第3天时, 甘农3号的次生木质部导管直径显著高于陇中苜蓿和陇东苜蓿, 而在胁迫第15天时, 甘农3号的原生和次生木质部导管直径却显著低于陇中苜蓿和陇东苜蓿。说明次生木质部导管直径在供试苜蓿的轴向水分运输中发挥着重要作用, 这可能是区分不同苜蓿品种抗旱能力的关键指标[8, 37]。相比甘农3号, 陇中苜蓿和陇东苜蓿在严重水分亏缺情况下均能通过较大的导管直径增加根系的水流导度, 将更多的水分及时运输到地上部分, 以维持植株的正常生长。
苜蓿根系形态和解剖结构的变化因品种及干旱胁迫时间不同而异。供试苜蓿均可通过增加根系总长度及次生木质部导管数目响应干旱胁迫。此外, 强抗旱陇中苜蓿通过改善根系形态特征(根尖数、根体积和根系平均直径)和内部输导组织结构(维管束直径、维管束面积、木质部面积和韧皮部面积)来适应干旱。陇东苜蓿主要通过增加维管束直径、维管束面积和韧皮部面积来适应干旱。干旱胁迫下, 甘农3号的根系干重、维管束直径和维管束面积显著降低, 而皮层占根系直径比例显著增加, 内部输导组织结构的变化降低了其输导水分的能力。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|