作者简介:滕珂(1989-),男,山东淄博人,博士。E-mail: tengke.123@163.com
ERF转录因子是植物体内最大的一类转录因子之一,在调控植物生长发育和响应环境胁迫等方面发挥着重要的作用。研究利用RACE技术,从日本结缕草中克隆到 ZjERF1基因(GenBank登录号为MH294481),开放阅读框为630 bp,编码209个氨基酸残基,含有1个高度保守的AP2结构域,属于典型的ERF转录因子。利用染色体步移技术,成功获得ATG上游1581 bp的启动子序列,生物信息学分析表明其中含有多个响应MeJA等激素和非生物胁迫的作用元件。为分析其转录激活特性,构建了pGBKT7-ZjERF1载体,转化Y2HGold酵母感受态细胞,结果表明其具有较强的转录激活活性。为探析其亚细胞定位情况,成功构建35 S:: ZjERF1: YFP载体,本生烟草瞬时表达结果证明ZjERF1定位于细胞核。为进一步研究 ZjERF1的表达特征,利用实时荧光定量的方法进行了验证,结果表明: ZjERF1在日本结缕草茎中表达量最高,并且与叶片的衰老程度呈正相关性;此外 ZjERF1的表达可受200 μmol·L-1 ET、10 μmol·L-1 MeJA和300 mmol·L-1 NaCl处理的诱导,但受到20%PEG4000的抑制。研究表明 ZjERF1是一个可参与多种信号转导途径的优良转录因子,为进一步探索 ZjERF1基因的功能及其调控机制奠定了基础。
The ERF transcription factors (TFs) are one of the largest groups in plants and play important roles in plant developmental progress and responses to abiotic stresses. In this study, one novel ERF gene, ZjERF1 (GenBank No. MH294481), was isolated from Zoysia japonica using the RACE method. The open reading frame of ZjERF1 is 630 bp in length, encoding 209 amino acids. One highly conserved AP2 domain was found in ZjERF1, indicating ZjERF1 was a typical ERF TF. By genome walking, a 1581 bp upstream sequence from the ATG of ZjERF1 was obtained. Bioinformatics analysis revealed that there were several cis-elements in response to MeJA and abiotic stresses in the promoter. To investigate the transcriptional activation character, a pGBKT7- ZjERF1 vector was constructed and then was transformed into Y2HGold yeast cells; the results showed that ZjERF1 had strong transcriptional activity. To reveal the subcellular localization character, 35S:: ZjERF1: YFP was generated. The transient expression analysis in Nicotiana benthamiana demonstrated that ZjERF1 was localized in the nucleus. To further explore the expression characteristics, real-time quantitative PCR was carried out. The results showed that ZjERF1 was expressed most abundantly in the stem and its transcriptional abundance was positively correlated with leaf senescence. Moreover, its expression could be induced by 200 μmol·L-1 ET, 10 μmol·L-1 MeJA or 300 mmol·L-1 NaCl but was suppressed by 20% PEG4000. Taken together, these findings proves that ZjERF1 is a functional TF involved in various signaling pathways and paves the way for further study of the function of ZjERF1 and its regulatory mechanism in Z. japonica.
植物为适应在生长发育过程中遭受到的多种生物胁迫及非生物胁迫, 进化出了复杂的分子调控机制[1]。转录因子是一类能够结合启动子作用元件的DNA结合蛋白, 通过激活或抑制相关基因的转录来发挥功能[2]。AP2/ERF转录因子家族以APETALA2 (AP2) 结构域来命名, 是植物中最大的一类转录因子家族之一, 广泛参与DNA结合。根据所含AP2结构域的数量, AP2/ERF转录因子可以分为AP2、RAV和ERF(ethylene responsive factor, 乙烯响应元件结合蛋白)等类型[3]。AP2转录因子含有两个AP2结构域, 主要在花的发育和形态建成过程中起作用。RAV转录因子包含一个AP2/ERF结构域和一个B3结构域, 参与植物生长发育和非生物胁迫应答[4]。ERF转录因子只含有一个AP2 结构域, 根据其结合的位点可分为两类:一类通过结合靶基因的GCC-box来对其转录进行调控, 参与乙烯(ET)、茉莉酸(JA)和水杨酸(SA)等激素的信号转导途径; 另一类通过结合CCGAC位点参与多种非生物胁迫途径[5, 6]。
目前, 前人已经在拟南芥(Arabidopsis thaliana)[6]、水稻(Oryza sativa)[7]、柑橘(Citrus reticulata)[8]和菜心(Brassica campestris)[9]等多种植物中克隆并鉴定出了ERF转录因子, 并对其功能展开了深入研究。拟南芥AtERF7结合GCC-box抑制下游基因的转录, 减弱了保卫细胞对ABA的敏感性, 提高了植物细胞的保水能力[10]。水稻OsERF922可通过调控ABA合成相关基因的表达来调节内源ABA的含量, 从而改变水稻对盐胁迫的适应能力[11]。柑橘CitERF13通过结合CitPPH启动子的DRE(dehydration-responsive element, 干旱响应元件)来调控其表达, 促进叶绿素降解[8]。进一步研究揭示了CitERF13可通过抑制叶绿素合成、CO2羧化作用等多种途径抑制光合效率[12]。菜心BrERF72是一种可受MeJA(methyl jasmonate, 茉莉酸甲酯)诱导, 细胞核定位且具有转录激活活性的转录因子, 可通过直接结合BrLOX4、BrAOC3和BrOPR3启动子的GCC或DRE/CRT(C-repeat, C重复元件)来参与JA合成途径, 进而调控植物叶片衰老[9]。
结缕草(Zoysia japonica)是一种重要的暖季型草坪草, 因其耐践踏、抗旱性强、耐盐等优点而广泛应用于运动场草坪的建植及城市绿化[13, 14]。然而, 目前结缕草的遗传资源研究仍十分有限, 在GenBank中仅有500多条EST(expressed sequence tags, 表达序列标签)序列[15]。深入挖掘结缕草优良的基因资源, 不仅可以增强对结缕草抗逆分子机理的认识, 而且有助于结缕草性状改良育种。虽然已经从一些模式植物中克隆得到ERF基因, 但是ERF在结缕草中的功能研究还鲜有报道, 其功能并不清楚。本研究利用RACE(rapid amplification of cDNA ends, cDNA末端快速克隆)技术首次从日本结缕草中克隆得到ZjERF1基因, 同时利用染色体步移方法对其启动子进行了克隆, 并对ZjERF1基因与其启动子进行了生物信息学分析; 研究了ZjERF1的转录激活活性和亚细胞定位特征, 并分析了激素及盐、干旱胁迫处理后ZjERF1基因的表达情况, 旨在为深入研究ZjERF1基因的功能提供基础。
本研究所用的日本结缕草品种‘ Meyer’ 由江苏省中国科学院植物研究所刘建秀研究员惠赠, 种植于温室, 农杆菌EHA105、亚细胞定位载体3302Y3、酵母双杂交载体pGBKT7、Y2HGold酵母菌株及本生烟草(Nicotiana benthamiana)均由本实验室保存。RACE试剂盒、反转录试剂盒、BglⅡ 快切酶、BamHⅠ 快切酶、pMD-19T、PrimeSTAR HS DNA Polymerase、Infusion连接酶和酵母缺陷型培养基等购于宝生物公司(TaKaRa)。RNA提取试剂盒、PCR产物纯化试剂盒购自OMEGA公司。大肠杆菌感受态DH5α 购于天根生化科技公司。PCR Mix、SYBR Mix购自康为世纪公司。PEG4000、乙烯(ET)、脱落酸(ABA)和茉莉酸甲脂(MeJA)购于SIGMA-ALDRICH。
1.2.1 ZjERF1克隆与生物信息学分析 利用试剂盒提取健康生长的日本结缕草叶片RNA。根据前期转录组数据设计5'/3'RACE的引物(表1), 按照RACE试剂盒说明书进行5'/3'RACE。反应结束后经琼脂糖凝胶电泳检测, 将PCR产物纯化后连接克隆载体pMD-19T, 检测为阳性的菌液送北京睿博兴科生物技术有限公司测序, 利用DNAMAN 8.0拼接测序结果。根据拼接序列设计引物ZjERF1-F/R, 以日本结缕草cDNA为模板扩增基因全长, 反应程序为95 ℃ 10 min; 95 ℃ 30 s, 57 ℃ 30 s, 72 ℃ 45 s, 30个循环; 72 ℃ 5 min, 12 ℃保温。目的片段纯化后连接克隆载体, 检测后测序, 测序正确的菌液提取质粒用于后续实验。
| 表1 引物列表 Table 1 Primer list of this study |
利用DNAMAN 8.0软件预测基因编码的氨基酸序列。保守结构域分析及同源比对利用NCBI的Blast功能, 用CLUSTALW (https://www.genome.jp/tools-bin/clustalw)和BoxShade (https://embnet.vital-it.ch/software/BOX_form.html)在线软件作图。蛋白质的亲疏水性、分子量及等电点推导用ProtParam。信号肽预测使用SignalP 4.1。系统进化树利用MEGA 5.0软件构建。亚细胞定位情况预测用Softberry网站。
1.2.2 ZjERF1启动子克隆与作用元件预测分析 CTAB(cetyltrimethyl ammonium bromide, 溴化十六烷基三甲铵)法提取健康生长的日本结缕草叶片DNA, 根据ZjERF1基因gDNA序列的5'端设计染色体步移的3条特异性引物SP1、SP2、SP3(表1), 以日本结缕草基因组DNA为模板进行染色体步移, 反应结束后将2、3轮产物进行琼脂糖凝胶电泳检测, 条带单一的PCR产物送去测序。根据染色体步移测序结果设计引物ZjERF1-Pro-F/R(表1)扩增启动子序列, 反应程序为95 ℃ 10 min; 95 ℃ 30 s, 57 ℃ 30 s, 72 ℃ 90 s, 30个循环; 72 ℃ 5 min, 12 ℃保温, PCR产物纯化后连接pMD-19T载体, 阳性菌液送测序。通过PLACE网站(https://sogo.dna.affrc.go.jp )预测ZjERF1基因启动子可能存在的作用元件。
1.2.3 ZjERF1转录激活活性验证 以测序正确的pMD-ZjERF1质粒为模板, BD-ERF1-F/R为引物(表1), 用PrimeSTAR进行PCR扩增, 反应程序为98 ℃ 10 s, 98 ℃ 10 s, 68 ℃ 30 s, 25个循环; 72 ℃ 3 min, 12 ℃保温。利用BamHⅠ 单酶切pGBKT7载体, PCR仪中反应15 min。将PCR产物及载体单酶切产物进行纯化, 之后在In-Fusion连接酶的作用下进行同源重组。连接产物转化DH5α , 挑取单克隆送公司测序, 测序正确的菌液提质粒, 保菌备用。利用LiAC(lithium acetate, 醋酸锂)法[16], 将pGBKT7-ZjERF1转化为酵母感受态细胞, 涂布于一缺培养基(SD-Trp), 30 ℃培养2 d左右。挑取单克隆, PCR鉴定为阳性的菌液, 以pGBKT7空载体为对照, 分别稀释10、100倍上样, 利用Cannon EOS 60D拍照。
1.2.4 ZjERF1亚细胞定位 设计亚细胞定位载体构建引物3302Y3-ERF1-F/R(表1), 以含有目的基因的质粒为模板扩增目的条带, 用In-Fusion连接酶将PCR纯化产物连接入BglⅡ 单酶切过的3302Y3载体。构建好的亚细胞定位载体35S::ZjERF1:YFP转化农杆菌EHA105。采用瞬时表达的方法, 将成功转化目的质粒的农杆菌注射本生烟草叶片, 暗培养48 h[17]。以3302Y3空载体为对照, 利用激光共聚焦显微镜(Leica SP-5)观察YFP荧光在细胞中的分布情况。
1.2.5 ZjERF1的表达分析 剪取正常生长的日本结缕草成熟植株的根、茎、叶做组织差异分析; 剪取幼嫩叶片、成熟叶片、衰老叶片, 做不同发育时期的表达分析。选取5盆长势一致的日本结缕草分别喷施200 μ mol· L-1 ET、10 μ mol· L-1 ABA、10 μ mol· L-1 MeJA, 浇灌300 mmol· L-1 NaCl和20% PEG4000。在处理第0、1、3、6、12、24 h分别剪取不同处理的叶片, 液氮速冻后-80 ℃保存。提取上述样品总RNA, 经NanoDrop ND-1000检测合格后反转录为cDNA。设计荧光定量引物qERF1-F/R(表1), 以日本结缕草Actin基因(GenBank登录号:GU290546)为内参进行qRT-PCR反应, 每个样品设置3个生物学重复, 4个技术重复。用2-Δ Δ Ct法计算基因的相对表达量[18]。
利用Excel 2010计算表达量, SPSS 18.0进行方差分析, SigmaPlot 12.5作图。
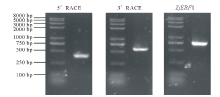
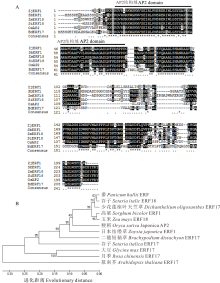
通过RACE方法从日本结缕草中克隆得到目的基因, 命名为ZjERF1(图1)。该基因开放阅读框为630 bp, 编码209个氨基酸(GenBank登录号:MH294481)。保守结构域分析表明, 该基因编码的蛋白属于ERF转录因子家族。氨基酸序列同源比对结果显示, ZjERF1与玉米(Zea mays)、高粱(Sorghum bicolor)及水稻同源性均在80%以上(图2A)。一级结构分析表明, 该基因编码蛋白分子量为22.48 kD; 理论等电点为5.0, 其中阴性氨基酸(Asp+Glu)29个, 阳性氨基酸(Arg+Lys)21个; 亲水性平均系数为-0.285, 属于亲水性蛋白。信号肽预测结果表明, ZjERF1不含信号肽; 构建系统进化树发现, ZjERF1与粳稻(Oryza sativa)AP2/ERF-like(BAD19440.1)亲缘关系最近(图2B)。亚细胞定位预测结果显示, ZjERF1定位于细胞核。
染色体步移结束后, 将2、3轮PCR产物进行琼脂糖凝胶电泳检测(图3A), 条带清晰的PCR产物送公司测序, 测序结果经比对分析, 最终获得ZjERF1基因ATG上游1581 bp序列。根据得到的序列设计引物扩增ZjERF1启动子, 得到目的条带与预期相符, 经测序分析确定为ZjERF1启动子序列。PLACE启动子在线预测分析发现, ZjERF1启动子序列中除了有CAAT-box、TATA-box等基本顺式作用元件, 还含有与光、植物激素等相关的顺式调控元件。该序列上有1个脱落酸响应元件(ABRE: ABA-responsive element, 茉莉酸响应元件), 8个茉莉酸甲酯响应元件(4个CGTCA-motif, 4个TGACG-motif)和1个水杨酸响应元件。此外, 还有HSE(heat shock element, 热休克元件)、MBS(MYB binding site, MYB转录因子结合位点 )、LTR(low-temperature responsiveness, 低温响应元件)和TC-rich repeat等若干与非生物胁迫关的应答元件(图3B)。
尽管大量研究发现AP2/ERF家族的转录因子具有转录激活或转录抑制的作用, 而ZjERF1的转录活性特征并不清楚。为分析ZjERF1是否具有激活活性, 将构建成功的pGBKT7-ZjERF1载体转化Y2HGold酵母感受态细胞, 以pGBKT7空载体为对照。结果显示, 在SD-Trp培养基上对照和pGBKT7-ZjERF1均可正常生长。之后, 将成功转化目的质粒的菌液分别稀释1、10和100倍后点样在SD-Trp-His-Ade培养基上观察其生长情况。结果表明, 对照不能在SD-Trp-His-Ade培养基上生长, 而pGBKT7-ZjERF1可正常生长。本试验表明:ZjERF1具有较强的自激活活性(图4)。
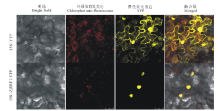
亚细胞定位预测结果显示, ZjERF1定位于细胞核, 为了进一步研究ZjERF1的定位情况, 构建35S::ZjERF1:YFP载体, 以空载35S::YFP为对照, 质粒成功转化农杆菌后注射本生烟草叶片, 48 h暗培养后在Leica SP-5激光共聚焦显微镜下观察黄色荧光蛋白分布(yellow fluorescence protein, YFP), 结果发现, 转35S::YFP的荧光信号分布于整个细胞中, 而ZjERF1定位于细胞核(图5)。
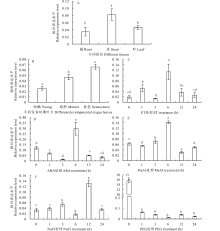
荧光定量结果显示, ZjERF1在根、茎、叶中均有表达, 但在茎中的表达量显著高于根和叶片, 分别是根中的2.37倍, 叶片中的1.77倍(图6A); ZjERF1在不同发育时期的叶片中表达量也明显不同, 与衰老程度呈正相关性, 其在衰老叶片中的表达量最高, 幼嫩叶片中的表达量最低。其中衰老叶片的表达量分别是成熟叶片的1.41倍, 幼嫩叶片的2.59倍(图6B)。
ET、ABA及MeJA激素处理后的荧光定量结果表明:ZjERF1的表达可以受到ET的诱导, 在处理的第6 h达到最高水平, 为初始水平的5.12倍(图6C); ZjERF1的表达在喷施ABA后的前3 h呈下降趋势, 但在处理的第6 h表达量显著升高, 为第3 h的20.0倍, 之后又表现出显著下降的趋势(图6D); ZjERF1的表达总体上受到MeJA的诱导, 在处理6 h达到峰值, 为初始水平的2.31倍(图6E)。
高盐和干旱胁迫处理后的荧光定量数据显示:在处理的24 h内, 300 mmol· L-1的NaCl处理诱导了ZjERF1的表达, 具体表现为在第3 h开始升高, 为第1 h的1.39倍, 而在第12 h达到峰值, 为处理前的3.99倍(图6F)。而20%的PEG4000处理显著抑制ZjERF1的表达, 表达量随着处理时间的延长逐渐下降, 在6 h达到最低值, 为初始水平的1.47× 10-3倍(图6G)。
目前关于ERF基因的研究主要集中在拟南芥和水稻等模式植物中, 在结缕草上的研究却鲜有报道。本研究利用RACE的方法从日本结缕草中克隆得到ZjERF1基因, 蛋白保守结构域分析表明, ZjERF1属于ERF转录因子家族。ZjERF1拥有1个高度保守的含有65个氨基酸残基的AP2 DNA结构域, 具有高度结合GCC-box的潜力, 能够调控相关基因的表达[6]。构建系统进化树发现ZjERF1与粳稻AP2/ERF-like(BAD19440.1)的亲缘关系最近。拟南芥中的研究发现, EAR motif对于ERF转录因子发挥转录抑制的作用至关重要[19]。本研究转录激活活性分析表明, ZjERF1具有较强的转录激活活性, 可以发挥转录调控的功能, 分析这可能与其不含EAR-motif 有关。亚细胞定位结果显示, ZjERF1定位于细胞核, 这与柑橘CitERF13[20]、小麦(Triticum aestivum)TaERF W17[21]、菜心BrERF72[9]的定位结果一致。以上结果表明:ZjERF1属于典型的ERF转录因子, 具有转录激活活性, 定位于细胞核, 可调控下游相关基因的表达, 能够参与多种转录调控过程。
启动子作为基因的组成部分, 控制转录起始的过程, 它在一定程度上决定了基因表达的时间、部位及强度, 启动子的研究是基因表达调控研究的基础[22]。作用元件是RNA聚合酶直接结合的区域, 对启动子的活性影响显著[23]。前人研究表明, 不同植物中的ERF转录因子可同时响应茉莉酸、脱落酸、非生物胁迫等因素的调节[9, 24]。本研究通过染色体步移的方法获得了ZjERF1基因ATG上游1581 bp序列, 分析发现, 该序列上除了含有TATA-box、CAAT-box等基本作用元件以外, 还存在着多个响应MeJA、ABA和非生物胁迫诱导(干旱、热、冷)的作用元件。据此推断ZjERF1是一个非常重要的转录因子, 可同时参与激素信号传导和响应非生物胁迫过程, 并在其中行使着不同的功能, 值得深入开展研究。此外, 启动子作用元件分析预测ZjERF1可受MeJA等激素和非生物胁迫的调节, 为进一步研究ZjERF1的表达特征提供了依据。
不同组织荧光定量结果显示, ZjERF1在根、茎、叶中均有表达, 其中茎中的表达量显著高于其在根和叶片中的表达量, 这与拟南芥AtRAP2.6的表达特征一致[24]。不同发育时期的叶片荧光定量结果表明, ZjERF1在衰老叶片中的表达量最高, 这与菜心BrERF72的研究结果一致[9]。植物叶片的衰老与乙烯的合成密切相关, 而ERF作为乙烯途径中的一个关键转录因子, 在叶片衰老过程中发挥着重要功能[25, 26]。本研究发现喷施ET可诱导ZjERF1的表达, 这与ORA59的表达情况一致[27]。这表明ZjERF1可响应乙烯信号, 推测可以在乙烯调控的一系列信号转导过程中发挥转录调控功能。研究表明ABA是一种促衰老激素, 外源ABA可以诱导衰老相关的基因的表达[28]。本研究发现ABA可调控ZjERF1基因的表达, 这与拟南芥AtRAP2.6[24]和柽柳(Tamarix hispida)ThERF7[29]的表达情况一致, 说明ZjERF1可参与ABA调节的叶片衰老过程。菜心中的研究结果表明, BrERF72可受JA的诱导, 并通过直接结合JA合成基因的启动子来调节JA的合成, 证明了ERF可参与JA调节的叶片衰老[9]。本研究中发现ZjERF1启动子含有多个响应MeJA的作用元件, 并且MeJA处理显著诱导ZjERF1的表达, 因此ZjERF1可能参与了调控植物衰老的进程, 需要进一步的研究挖掘下游靶基因。此外, 我们还发现ZjERF1的表达在NaCl处理的第12 h急剧升高, 这与ThERF7的表达情况类似; 而ZjERF1的表达在PEG处理的24 h内始终表现出受抑制的趋势, 与ThERF6的情况一致[29]。以上分析说明ZjERF1的表达可受多种条件的调控, 推测其在激素信号传导和非生物胁迫中发挥着不同的作用。
日本结缕草ZjERF1基因开放阅读框为630 bp, 编码209个氨基酸。保守结构域分析表明, ZjERF1属于ERF转录因子家族。同时, 通过染色体步移的方法得到ZjERF1基因ATG上游1581 bp的启动子序列, 该序列含有多个响应MeJA及非生物胁迫的作用元件。转录激活分析表明, ZjERF1具有较强的转录激活活性。亚细胞定位结果显示, ZjERF1定位于细胞核。荧光定量数据表明, ZjERF1在衰老叶片中的表达量最高, 且ZjERF1的表达受ET、MeJA及盐和干旱处理的调节。本研究表明ZjERF1可响应多种因素的调节, 并在激素信号传导和非生物胁迫中发挥着不同的作用, 为进一步探索ZjERF1基因的功能及其转录调控机制奠定了基础。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|