作者简介:胡娜(1993-),女,甘肃庆阳人,在读硕士。E-mail: 2524768559@qq.com;李葆春(1971-),女,甘肃陇南人,副教授,博士。E-mail: libc@gsau.edu.cn。
**共同第一作者
以盐生植物盐生草为材料,研究不同重金属胁迫下其种子萌发特性,探讨盐生草种子萌发期对不同重金属的耐受程度,旨在为盐生草对重金属污染土壤修复提供理论依据。以5种主要土壤重金属污染物(Cu、Zn、Ni、Cd、Pb)胁迫处理盐生草种子,对其发芽率、发芽势、株高、鲜重、干重、根系活力和离子含量进行测定,并对以上指标进行聚类分析和主成分分析。结果表明:在5种不同重金属胁迫下,低浓度处理对盐生草种子萌发影响较小,高浓度则产生抑制作用;但是其对幼苗生长指标的影响不同,其中,株高、鲜重和根系活力在低浓度Zn2+、Pb2+处理下与对照差异不显著,但在5.00 mmol·L-1 Zn2+和3.00 mmol·L-1 Pb2+胁迫下显著降低,以上指标均低于各重金属胁迫下对照的55%和52%;低浓度Cu2+、Ni2+、Cd2+显著抑制盐生草幼苗的株高、鲜重和根系活力,且分别在3.00 mmol·L-1 Cu2+和Ni2+、0.20 mmol·L-1 Cd2+胁迫下降低最为显著,株高、鲜重和根系活力均低于各金属胁迫下对照的40%、46%和53%;组织内各金属离子含量随处理浓度的升高而增大,同时在5.00 mmol·L-1 Zn2+,3.00 mmol·L-1 Pb2+、Cu2+、Ni2+和0.20 mmol·L-1 Cd2+胁迫下升高幅度最大。聚类分析结果显示,以3.00 mmol·L-1 Zn2+,1.00 mmol·L-1 Pb2+、Cu2+、Ni2+ 和0.10 mmol·L-1 Cd2+为结点,将各金属胁迫浓度聚为两类,并对上述结点下各指标进行主成分分析,发现在重金属Zn2+、Pb2+、Ni2+胁迫下,发芽指标贡献率最大,Cu2+、Cd2+胁迫下,生物量指标贡献率最大。上述结果说明,在重金属Zn2+浓度低于3.00 mmol·L-1,Cu2+、Ni2+和Pb2+浓度低于1.00 mmol·L-1,Cd2+浓度低于0.10 mmol·L-1的处理环境下,其对盐生草种子萌发和幼苗生长的影响较小;发芽指标可首选为评价盐生草萌发期耐重金属Zn2+、Pb2+和Ni2+的重要参数,生物量可首选为评价盐生草萌发期耐重金属Cu2+和Cd2+的重要参数。
**These authors contributed equally to this work.
In order to better understand the tolerance of halophyte Halogeton glomeratus to different heavy metals, this research focused on its seed germination and seedling growth when exposed to different heavy metal stresses. Indicators of seed germination and seedling growth, including the germination percentage, germination energy, plant height, fresh weight, dry weight, root activity and ion content of H. glomeratus seeds treated with five major soil heavy metal pollutants (Cu, Zn, Ni, Cd, Pb), were measured and data analysed by cluster and principal component analyses. It was found that lower concentrations of the five different heavy metals had little effect on seed germination, while higher concentrations had an inhibitory effect. However, the effects on seedling growth index were different. The plant height, fresh weight and root activity showed no significant difference under the lower concentrations of Zn2+ and Pb2+, but showed a significant decrease under the lower concentrations of Cu2+, Ni2+ and Cd2+.Especially, the decrease was most obvious at 5.00 mmol·L-1 Zn2+, 3.00 mmol·L-1 Pb2+, Cu2+, Ni2+ and 0.20 mmol·L-1 Cd2+, and which is the lowest concentration of inhibition effect. The plant height, fresh weight, dry weight, root activity and ion content were lower than the control under the concentration of 5.00 mmol·L-1 Zn2+, all of them showing a decrease to 55%, and which showed a decrease to 52%, 40%, 46% and 53% of the control for 3.00 mmol·L-1 Pb2+, Cu2+, Ni2+ and 0.20 mmol·L-1 Cd2+, respectively. Furthermore, the ion contents of the plant tissue increased with increase in heavy metal concentrations, and these increases first became obvious at 5.00 mmol·L-1 Zn2+, 3.00 mmol·L-1 Pb2+, Cu2+, Ni2+ and 0.20 mmol·L-1 Cd2+. On cluster analysis, the metal stress concentrations were clustered into two categories based on 3.00 mmol·L-1 Zn2+, 1.00 mmol·L-1 Pb2+, Cu2+, Ni2+ and 0.10 mmol·L-1 Cd2+, respectively. In addition, the principal component analysis showed that germination indices are mainly affected by Zn2+(PCA 1), Pb2+ (PCA 1) and Ni2+(PCA 1+PCA 2) treatments, and biomass has most affected by the Cu2+(PCA 1+PCA 2) and Cd2+(PCA 1+PCA 2)treatments.These results indicated that there was little effect on seed germination and seedling growth of H. glomeratus while the heavy metal concentrations were lower than 3.00 mmol·L-1 Zn2+, 1.00 mmol·L-1 Pb2+, Cu2+, Ni2+ and 0.10 mmol·L-1 Cd2+. The germination indexes can be used for evaluating the tolerance of H. glomeratus to Zn2+, Pb2+ and Ni2+ during the germination period, and biomass can be used to evaluate the tolerance of H. glomeratus to Cu2+ and Cd2+.
近年来随着城市化、工业化进程不断加快, 重金属在土壤中大量富集, 其不但破坏生态环境, 还影响植物生长发育, 进入食物链最终危害人体健康[1, 2]。目前全世界约1× 107 hm2的土壤遭受重金属污染, 我国受重金属污染的耕地约占总耕地面积的1/6, 由重金属污染导致的作物产量下降超过1× 108 t· yr-1, 造成经济损失达2× 1010元[3, 4]。因此, 充分利用土地资源, 进行经济有效的土壤重金属污染修复, 对改善生态环境, 保证农业可持续发展和人类健康具有重要意义。
重金属是指密度大于5的金属元素, 主要包括镉(Cd)、砷(As)、铅(Pb)、铬(Cr)、汞(Hg)以及有一定毒性的铜(Cu)、锌(Zn)、镍(Ni)等[5]。重金属污染具有富集性、不可逆性和难治理等特点, 目前国际上治理土壤重金属污染的方法主要有物理化学修复、微生物修复、植物修复和农业措施修复等[6, 7, 8]。相较于其他修复方法, 植物修复法具有保护土壤微环境、耗费低、适应性强、无二次污染物等优点[9], 因此, 通过种植绿色植物来隔离或解毒土壤重金属污染似乎有望比传统技术更经济, 更有效, 更环保。近年来, 植物修复土壤重金属污染的研究方兴未艾, 例如景天科的东南景天(Sedum alfredii)是一种已被鉴定的锌和镉超积累植物, 能在富含锌、镉、镍的土壤上正常生长[10]。相对甜土植物, 盐生植物在进化上形成特殊的信号转导途径和离子运输调控机制[11], 在土壤盐碱地改良、重金属污染修复等方面发挥着重要作用[12]。
种子在不同重金属胁迫状况下的萌发特性以及萌发期对不同重金属的耐性程度直接影响着植株的生长发育, 因此, 植物的早期生长阶段是决定重金属对植物毒性作用的重要指标。当植物体内重金属过量、超过某一临界值, 会对植物产生胁迫作用, 导致其体内代谢紊乱, 生长发育受到抑制, 研究表明, Zn2+对紫花苜蓿(Medicago sativa)种子萌发和幼苗生长具有“ 低促高抑” 的毒物刺激效应, 且对幼苗根生长的抑制程度大于幼苗芽的生长[13]。Cu2+导致野生赖草(Leymus secalinus)胚芽中MDA含量升高, 对胚芽产生损害作用[14]。高浓度 Cd2+、Zn2+ 对烟草(Nicotiana tabacum)种子造成氧化损伤, 使其抗氧化酶活性降低, 代谢紊乱[15]。禾本科植物在高浓度Cu2+、Cd2+ 和 Pb2+ 胁迫下出现“ 无根苗” [16]。
盐生植物盐生草(Halogeton glomeratus), 隶属藜科(Chenopodiaceae)盐生草属(Halogeton), 是一年生草本植物。为干旱、半干旱区广布的荒漠物种, 主要生长于蒙古、中亚及我国西北旱区等地[17, 18], 地上多分枝的肉质化茎、叶组织具有耐盐抗旱、富集重金属等特性。本实验室前期研究表明, 盐生草通过将盐分区隔在液泡内而具有较强的耐盐特性, 其不但在盐渍地生长良好, 且为金属矿区优势种群[19, 20], 是理想的进行土壤重金属污染修复的野生资源, 但关于盐生草萌发期对不同重金属的耐性还未知。鉴于此, 本研究从修复重金属污染土壤角度出发, 以我国西北旱区特色盐生植物盐生草为材料, 模拟土壤重金属污染, 对盐生草种子进行不同类型及浓度的重金属胁迫, 研究其在不同重金属胁迫下的种子萌发及幼苗生长特性, 并结合聚类分析和主成分分析, 探索其萌发期对不同重金属的耐受性以及各指标的相对贡献率, 以期进一步提高盐生草利用价值, 并为重金属污染土壤改良提供理论依据。
试验于2018年7-9月在甘肃农业大学甘肃省干旱生境作物学重点实验室麦类遗传育种实验室进行, 供试材料为2017年采集于甘肃省民勤县戈壁滩的盐生草种子, 千粒重为0.38 g, 室温干燥保存。
硫酸铜(CuSO4· 5H2O)、硫酸锌(ZnSO4· 7H2O)、氯化镍(NiCl2· 6H2O)、硫酸镉(Cd3O12S3· 8H2O)、氯化铅(PbCl2), 次氯酸钠溶液(NaOCl, 有效氯≥ 8.0%), 2, 3, 5-三苯基四唑氯化物(2, 3, 5-Triphenyl-2H-tetrazolium chloride, TTC), 乙酸乙酯, 95%、75%乙醇, 所用试剂均为分析纯试剂。
1.3.1 浓度设置 前期对盐生草种子进行萌发预试验, 根据萌发情况筛选不同重金属浓度梯度, 最终设定浓度梯度分别为:Cu2+(0.00, 0.10, 0.30, 0.50, 1.00, 3.00, 5.00, 10.00, 20.00, 30.00, 50.00, 100.00 mmol· L-1); Zn2+和 Ni2+(0.00, 0.10, 0.30, 0.50, 1.00, 3.00, 5.00, 10.00, 20.00, 30.00, 50.00 mmol· L-1); Cd2+(0.00, 0.05, 0.10, 0.20, 0.40, 0.60, 0.80, 1.00, 1.50, 2.00, 2.50, 3.00, 4.00 mmol· L-1); Pb2+(0.00, 0.10, 0.30, 0.50, 1.00, 3.00, 5.00, 8.00, 10.00 mmol· L-1)。用蒸馏水进行上述溶液配制。
1.3.2 种子消毒 选取适量均匀一致饱满的种子于2 mL离心管中, 用75%酒精准确消毒30 s, 蒸馏水清洗3次, 再用质量体积分数为2%的次氯酸钠溶液反复颠倒清洗1.5 min后, 用蒸馏水清洗4次, 再于离心管中吸入2 mL蒸馏水, 迅速倒于经灭菌的含有两层滤纸的玻璃培养皿中, 待用[21]。
1.3.3 萌发试验 选取经高压灭菌的含有2层定性滤纸(90 mm)的玻璃培养皿作为盐生草种子的发芽床, 移液枪吸取5 mL不同浓度的重金属溶液于上述培养皿中, 用消毒的镊子挑取处理后的盐生草种子, 将其整齐排列在上述培养皿中, 每盘培养皿60粒种子, 每个处理5次生物学重复, 以蒸馏水为对照, 记号笔标记, 封口膜封口。将培养皿置于12 h光照/12 h黑暗, 温度25 ℃, 光照强度4000 Lx, 相对湿度80%的环境下进行萌发试验[22]。
1.3.4 发芽指标测定 以种子露白为标准[18], 按7 d发芽率, 3 d发芽势进行发芽种子数统计, 计算种子发芽率、发芽势。计算公式如下:
发芽率=(露白种子粒数/供试种子粒数)× 100%(7 d)
发芽势=(露白种子粒数/供试种子粒数)× 100%(3 d)
1.3.5 株高扫描 用WinRHIZO图像扫描仪对生长7 d的幼苗进行株高扫描, 每盘培养皿随机选取6株幼苗, 平均值作为株高指标。
1.3.6 生物量测定 以每盘培养皿为一个单位, 将所有发芽种子于蒸馏水中轻轻漂洗数秒钟, 以除去幼苗表面黏附的多余重金属离子, 后将幼苗置于干净的定性滤纸上, 待水分吸干后测量鲜重(fresh weight, FW), 然后将幼苗装入信封袋, 置于60 ℃ 烘箱中, 3 d后用1/10000分析天平进行干重(dry weight, DW)称量。
1.3.7 根系活力测定 将新鲜植株(0.2 g)浸泡于2.5 mL的100 mmol· L-1 磷酸钾缓冲液(pH 7.0)和2.5 mL 的0.4% TTC中, 黑暗下于25 ℃温浴13 h, 除去TTC溶液, 用5 mL蒸馏水洗涤根系, 将减少的TTC用5 mL 95%乙醇代替在60 ℃下提取30 min, 并在485 nm处读取吸光度[23]。
1.3.8 重金属含量测定 以各重金属的不同处理浓度为一个单位, 将发芽幼苗放入干净研钵中, 将其研至粉末状, 装入PCR管, 用原子吸收分光光度法[24]进行不同重金属离子含量测定。
运用Genstat 19th Edition(64 bit)软件进行单因素方差分析(ANOVA), 采用Duncan’ s多重比较的方法统计处理间差异显著性(P< 0.05), 所有结果由平均值± 标准误(means± standard error)表示; 通过SPSS 20.0进行聚类分析和主成分分析。
低浓度Cu2+对盐生草种子的发芽率和发芽势无明显影响, 高浓度则产生抑制作用(表1)。发芽率在3.00 mmol· L-1 Cu2+胁迫下显著低于对照(P< 0.05), 而发芽势在Cu2+≥ 1.00 mmol· L-1 时较对照显著降低(P< 0.05), 二者均在最大胁迫浓度(100.00 mmol· L-1)下达到最低值, 此时发芽率为81.67%, 较对照降低11.64%, 发芽势为77.50%, 较对照降低15.25%。
| 表1 Cu2+ 、Zn2+、Ni2+对盐生草种子萌发的影响 Table 1 Effects of Cu2+, Zn2+, Ni2+ on the seed germination of H. glomeratus (%) |
对生长7 d的盐生草幼苗进行株高、干鲜重、根系活力和组织内离子含量测定, 发现随处理浓度的升高, 株高、干鲜重和根系活力均呈降低趋势, 组织内Cu2+含量呈上升趋势。其中, 低浓度Cu2+(0.10 mmol· L-1)对株高和鲜重抑制作用显著(P< 0.05), 当Cu2+浓度为3.00 mmol· L-1时, 株高和鲜重分别较对照降低78.24%和79.03%(图1a, b); 低浓度Cu2+(0.10~1.00 mmol· L-1)处理对幼苗干重无显著影响(P> 0.05), 高浓度Cu2+(3.00~100.00 mmol· L-1)则产生抑制作用(图1b); 根系活力呈现与株高、鲜重相同的趋势, 即随处理浓度的升高先迅速降低后趋于稳定, 在3.00 mmol· L-1 Cu2+胁迫下仅为对照的18.02%(图1c); 在低浓度Cu2+(0.10~1.00 mmol· L-1)胁迫下, 组织内Cu2+含量保持较低水平, 而3.00 mmol· L-1 Cu2+处理下迅速上升至15.67 g· kg-1, 在30.00 mmol· L-1时达到最大值(图1d), 说明在重金属Cu2+胁迫下, 各指标的降低与组织内Cu2+含量有一定的相关性。
为进一步明确盐生草幼苗对重金属Cu2+的耐性程度, 对以上种子萌发和幼苗生长指标进行聚类分析, 得出在欧式距离为15时, 将Cu2+处理下的12个浓度梯度聚为两类, 其中以0.00~1.00 mmol· L-1为第Ⅰ 类, 3.00~100.00 mmol· L-1为第Ⅱ 类(图2); 对1.00 mmol· L-1 Cu2+处理下的各指标进行主成分分析(表2), 提取了2个主成分, 主成分1贡献率为62.73%, 主成分2贡献率为37.27%, 累计贡献率达100.00%, 其中主成分1在鲜重上具有最高载荷(0.99), 其次是根系活力(0.97), 主成分2在株高上具有最高载荷(0.95), 考虑主成分1的贡献率约为主成分2贡献率的2倍, 因此生物量可首选为评价盐生草萌发期耐重金属Cu2+的重要参数。
 | 图2 不同浓度Cu2+对盐生草影响的聚类分析Fig.2 Cluster analysis of the effects of different concentrations of Cu2+ on H. glomeratus |
| 表2 不同重金属对盐生草影响的主成分分析 Table 2 Principal components of the effects of different heavy metals on H. glomeratus |
在Zn2+胁迫下, 盐生草种子发芽率和发芽势随重金属浓度的升高呈现先缓慢上升而后降低的趋势, 均在0.30 mmol· L-1时达到最大值, 分别为93.93%和93.44%, 但与对照差异不显著(P> 0.05)(表1); 在不同浓度的Zn2+胁迫下, 盐生草种子发芽率较高, 且差异不显著(P> 0.05), 分布在93.93%~89.23%, 与低浓度Zn2+(0.30 mmol· L-1)处理相比, 发芽势在Zn2+浓度高于10.00 mmol· L-1时受到显著性抑制(P< 0.05), 且于50.00 mmol· L-1 Zn2+胁迫下抑制效果最明显, 发芽势为84.69%, 相比0.30 mmol· L-1 Zn2+处理降低8.75%。
Zn2+对盐生草幼苗生长影响较小, 各指标在低浓度Zn2+胁迫下与对照差异不显著(P> 0.05), 高浓度则产生明显抑制作用, 其中, 株高、鲜重和根系活力均于0.50 mmol· L-1 Zn2+时开始显著低于对照(P< 0.05), 当Zn2+浓度为1.00 mmol· L-1时, 上述指标分别降低为对照的68.34%、76.66%和80.52%, 3.00 mmol· L-1 Zn2+处理下为对照的44.04%、54.29%和59.10%, 而干重受其影响小, 仅在最大Zn2+浓度(50.00 mmol· L-1)下显著低于对照(P< 0.05)(图3a, b, c); 通过测定离子含量, 发现组织内Zn2+含量随处理浓度的升高呈上升趋势, 1.00 mmol· L-1 Zn2+胁迫下其体内Zn2+含量为3.31 g· kg-1, 3 mmol· L-1 Zn2+胁迫下显著升高, 后呈直线上升趋势(图3d)。
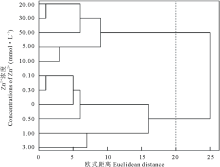
对以上数据进行聚类分析, 发现在欧式距离为20时将Zn2+处理下的不同浓度聚为两类, 以0.00~3.00 mmol· L-1为第Ⅰ 类, 5.00~50.00 mmol· L-1为第Ⅱ 类(图4), 说明盐生草幼苗在一定浓度的Zn2+胁迫下可以正常生长, 但当Zn2+≥ 5.00 mmol· L-1 时, 植株生长受到影响; 对3.00 mmol· L-1 Zn2+处理下的各指标进行主成分分析, 结果显示提取了1个主成分, 其特征值为5.58, 贡献率高达92.95%, 在发芽势和发芽率上具有最高载荷, 均为0.99(表2), 可见发芽势和发芽率可首选为评价盐生草萌发期耐重金属Zn2+的重要参数。
发芽率、发芽势在整个Ni2+处理浓度范围内均低于对照, 但低浓度胁迫下与对照差异均不显著(P> 0.05), 仅在高浓度时产生抑制作用(表1)。发芽率仅在Ni2+胁迫浓度≥ 10.00 mmol· L-1 时与对照差异显著(P< 0.05), 后处理间无明显差异; 而发芽势在3.00 mmol· L-1 Ni2+ 处理下显著低于对照(P< 0.05), 后随处理浓度的升高缓慢降低, 当Ni2+浓度为50.00 mmol· L-1 时, 发芽势为83.70%, 相比对照降低9.44%。由此可知, 重金属 Ni2+ 对盐生草种子萌发影响较小, 在整个胁迫浓度下均保持较高的发芽势和发芽率, 种子活力较高。
Ni2+对株高、干鲜重和根系活力均有明显抑制作用, 随处理浓度的升高先显著降低后趋于平缓(图5a, b, c)。在0.10~1.00 mmol· L-1 Ni2+ 处理下, 株高从对照的91.13% 降低至66.43%, 鲜重从对照的84.09%降低至52.40%, 株高和鲜重均在3.00 mmol· L-1 Ni2+下降低最为显著(P< 0.05), 分别为对照的33.18%和26.97%, 后处理间差异不显著(P> 0.05); 干重在0.50 mmol· L-1 Ni2+ 处理下较对照显著降低(P< 0.05), 之后无明显变化; 根系活力随Ni2+浓度的升高呈降低趋势, 在1.00和3.00 mmol· L-1 Ni2+ 处理下分别为对照的71.66%和46.30%; 组织内 Ni2+ 含量在低浓度(0.10~1.00 mmol· L-1 Ni2+)处理下相对较低, 且增加缓慢, 3.00 mmol· L-1 Ni2+ 胁迫下急速上升至11.92 g· kg-1, 约为1.00 mmol· L-1 Ni2+ 处理下的4倍, 后随处理浓度的增大缓慢升高(图5d)。
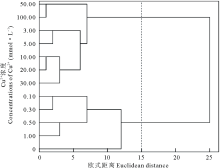
聚类分析结果显示, 在欧式距离为15时, 将Ni2+处理下的11个浓度梯度聚为两类, 0.00~1.00 mmol· L-1为第Ⅰ 类, 3.00~50.00 mmol· L-1为第Ⅱ 类(图6), 说明当Ni2+浓度≥ 3.00 mmol· L-1 时会严重影响盐生草种子萌发和幼苗的正常生长; 对1.00 mmol· L-1 Ni2+处理下的各指标进行主成分分析, 提取了2个主成分, 主成分1特征值为4.36, 贡献率为72.60%, 其在发芽势上具有最大载荷, 主成分2特征值为1.64, 贡献率为27.40%, 累计贡献率达100.00%, 其在发芽率上具有最高载荷(表2), 而发芽势和发芽率均属于种子萌发指标, 所以在重金属Ni2+胁迫下, 种子萌发越整齐, 萌发数越多, 则表现为对其耐性越强。
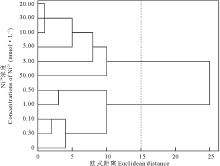 | 图6 不同浓度Ni2+对盐生草影响的聚类分析Fig.6 Cluster analysis of the effects of different concentrations of Ni2+ on H. glomeratus |
由表3可知, Cd2+对盐生草种子发芽率、发芽势有不同程度的影响, 其中, 发芽率在低浓度(0.05~0.10 mmol· L-1 Cd2+)时略高于对照, 但差异不显著(P> 0.05), 当Cd2+≥ 1.00 mmol· L-1时, 发芽率显著降低, 其中在4.00 mmol· L-1 Cd2+胁迫下达最低, 为86.02%, 较对照降低6.49%, 发芽势在0.20 mmol· L-1 Cd2+ 处理下较对照显著降低(P< 0.05), 后处理间差异不显著, 在最大浓度(4.00 mmol· L-1 Cd2+)时达最低, 为84.33%, 较对照降低7.95%; 说明重金属Cd2+在一定程度上抑制了盐生草种子活力, 使其萌发率降低。
| 表3 Cd2+和Pb2+对盐生草种子萌发的影响 Table 3 Effects of Cd2+ and Pb2+ on the seed germination of H. glomeratus (%) |
Cd2+胁迫下, 株高和干鲜重随处理浓度的升高而降低, 低浓度Cd2+(0.05~0.10 mmol· L-1)显著(P< 0.05)抑制了幼苗生长和生物量的积累, 0.20 mmol· L-1 Cd2+ 处理下抑制效果最明显, 株高、鲜重、干重分别较对照降低47.01%, 65.04%和39.52%, 后随处理浓度的升高, 株高和鲜重有不同程度的降低, 但干重在不同水平间差异不显著(P> 0.05), 与种子发芽指标相比, 幼苗生长对重金属Cd2+的浓度更敏感(图7a, b)。对根系活力测定发现, 低浓度处理下幼苗根系仍保持较高活力, 0.20 mmol· L-1 Cd2+胁迫下迅速降低为对照的一半(49.26%), 后随处理浓度的升高而降低(图7c); 组织内Cd2+含量在低浓度(0.05~0.10 mmol· L-1)胁迫下相对较低, 0.20 mmol· L-1 Cd2+处理下迅速升高至3.78 g· kg-1, 后以剂量依赖性方式增大, 当处理浓度≥ 2.00 mmol· L-1 时组织内Cd2+含量缓慢降低趋于稳定(图7d), 说明盐生草对Cd2+具有一定耐性, 且能富集一定浓度的Cd2+于体内。
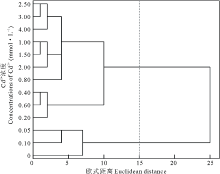
对以上指标进行聚类分析, 发现在欧式距离为15时将Cd2+处理下的浓度聚为两类, 0.00~0.10 mmol· L-1为第Ⅰ 类, 0.20~4.00 mmol· L-1为第Ⅱ 类(图8), 说明盐生草幼苗在Cd2+浓度≤ 0.10 mmol· L-1 时能维持正常生长, 高于此浓度则植株生长代谢受阻, 进一步对0.10 mmol· L-1 Cd2+处理下的萌发指标和幼苗生长指标进行主成分分析, 提取了2个主成分, 主成分1贡献率为56.59%, 在发芽势和干重上具有较高载荷, 主成分2贡献率为43.41%, 在鲜重上载荷最高, 两者累计贡献率为100.00%(表2), 说明在0.10 mmol· L-1 Cd2+胁迫下, 种子萌发越整齐, 生物量积累越多, 则表现为对重金属Cd2+耐性越强。
Pb2+胁迫下, 盐生草种子发芽率和发芽势随处理浓度的升高呈先升高后降低的趋势, 0.10~1.00 mmol· L-1 Pb2+处理下, 发芽率和发芽势略高于对照, 但差异不显著(P> 0.05), 均在1.00 mmol· L-1 Pb2+胁迫下达到最大值94.82%, 分别较对照增加2.54%和3.67%, 3.00 mmol· L-1 Pb2+处理下显著降低(P< 0.05), 后随处理浓度的升高, 各处理间差异不显著(P> 0.05)(表3)。由此可见, 一定浓度的Pb2+更有利于盐生草种子萌发。
在Pb2+胁迫下, 株高、干鲜重和根系活力随处理浓度的升高先平稳变化后显著降低(P< 0.05)。其中, 株高、干重和根系活力在0.10 mmol· L-1 Pb2+ 处理下达到最大值, 鲜重在0.50 mmol· L-1 Pb2+处理下达到最大值, 1.00 mmol· L-1 Pb2+处理下, 株高、根系活力分别为对照的70.60%和89.15%(图9a, c), 而干鲜重和对照差异不显著(P> 0.05), 但在3.00 mmol· L-1 Pb2+胁迫下时各指标均显著降低(P< 0.05), 株高、鲜重和根系活力分别为对照的42.25%、53.58%和50.22%, 此时组织内Pb2+含量也迅速升高(图9d), 相比较而言, 根系活力对高浓度Pb2+更敏感, 可能是因为环境中过多的Pb2+首先富集在植物根部, 对其造成严重毒害, 导致根系活力迅速降低, 从而进一步影响其他生理代谢, 最终影响植物生长。
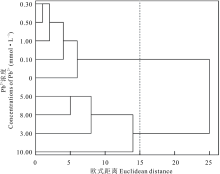
根据盐生草萌发和幼苗生长指标, 对以上处理浓度进行聚类分析, 发现在欧式距离为15时, 将其聚为两类, 以0.00~1.00 mmol· L-1为第Ⅰ 类, 以3.00~10.00 mmol· L-1为第Ⅱ 类(图10), 说明盐生草幼苗在一定浓度Pb2+胁迫下能保持正常生长, 浓度过高幼苗生长则受到显著抑制; 进一步对1.00 mmol· L-1 Pb2+处理下的各指标进行主成分分析, 发现提取了1个主成分, 其特征值为5.76, 贡献率高达92.93%, 其中发芽势和发芽率载荷最高(表2), 说明发芽势和发芽率可作为评价盐生草萌发期耐重金属Pb2+的重要参数。
Cu作为植物所必需的微量元素之一, 植物体内Cu2+含量过多、过少都会对植物生长产生影响, 过少会影响植物体内多种氧化还原反应和光合电子传递, 过多则会对植物产生铜盐毒害, 导致植株生长缓慢, 甚至枯萎死亡[25]。本研究结果表明, 低浓度Cu2+对盐生草种子萌发影响较小, 高浓度则产生抑制作用, 这与 Zhou等[26]研究结果一致。株高、干鲜重和根系活力均随Cu2+处理浓度的升高而降低, 且于3.00 mmol· L-1时降低最为显著, 各幼苗生长指标均低于对照的40%, 同时组织内Cu2+含量在低浓度胁迫下相对较低, 3.00 mmol· L-1 Cu2+胁迫下则迅速升高, 这可能是因为溶液中Cu2+最先接触植物根部, 致使根尖细胞分裂速度减慢, 达到某一临界值时对植物根系产生严重毒害, 导致其活力降低, 从而严重抑制幼苗生长和生物量积累[27]。聚类分析和主成分分析表明, 盐生草在Cu2+≥ 3.00 mmol· L-1胁迫下生长受到严重抑制, 生物量可首选为评价盐生草萌发期耐重金属Cu2+的重要参数。
Zn是植物生长发育必需的微量营养元素, 在维持和稳定生物膜功能完整性, 保证叶绿素的形成以及6大类功能酶(氧化还原酶、转移酶、水解酶、裂解酶、异构酶和合成酶)活性等方面发挥着重要作用[28]。研究表明, 植物体内一定浓度的Zn2+对植物生长发育有促进作用, 当超过某一临界值时便会对植物产生毒害, 主要体现在萌发受阻, 生长抑制, 光合、呼吸作用减弱等方面[29]。本研究中, 在低浓度Zn2+胁迫下, 盐生草种子发芽率、发芽势、株高、干鲜重和根系活力均高于对照, 高浓度则产生抑制作用, 这与陈俊任等[30]研究结果相似。萌发和幼苗生长指标在5.00 mmol· L-1 Zn2+处理下均低于对照的55%, 同时组织内Zn2+含量在此时也显著升高, 说明各指标的降低与组织内Zn2+含量有一定相关性, 可能是体内过多的Zn2+破坏了植物代谢平衡, 导致生长受阻。聚类分析和主成分分析结果表明, 盐生草在Zn2+≥ 5.00 mmol· L-1胁迫下无法正常生长, 发芽指标可首选为评价盐生草萌发期耐重金属 Zn2+ 的重要参数。值得注意的是, 与Ni2+和Cu2+相比, 各萌发指标和幼苗生长指标在Zn2+胁迫下最高, 其次是Ni2+和Cu2+, 说明盐生草对这3种金属的耐性顺序为:Zn2+> Ni2+> Cu2+, 有研究证明, 相比其他金属, Zn2+对植物的毒害作用最弱[30, 31], 这可能是因为Zn2+参与多种代谢途径, 植物对Zn2+的需求量大于其他微量元素, 此外, 金属的价态不同也会导致其对植物的毒害强度不同, 高浓度Se能显著抑制烟草的农艺性状, 且Se(VI)抑制效果大于Se(IV), 同时烟草体内Se(VI)积累量明显高于Se(IV)[32]。
Ni对植物新陈代谢起着重要作用, 研究发现, Ni2+毒害会严重抑制植物侧根的形成及生长, 影响其对水分和养分的吸收, 进一步引起植物生理代谢失调[33]。本研究中, 发芽率和发芽势在低浓度Ni2+(0.00~1.00 mmol· L-1)处理下与对照差异不显著, 高浓度时受到显著抑制作用, 这与龚磊等[34]的研究结果一致。株高、鲜重和根系活力随处理浓度的增大而降低, 在3.00 mmol· L-1 Ni2+处理下差异最显著, 各指标均低于对照的46%, 同时, 组织内Ni2+含量在此胁迫浓度下升高幅度最大, 结合聚类分析和主成分分析结果, 推测盐生草幼苗在 Ni2+≥ 3.00 mmol· L-1胁迫下无法正常生长, 发芽指标可首选为评价盐生草萌发期耐重金属Ni2+的重要参数。
在所有重金属中, Cd是最受关注的元素之一, 在大量关于Cd毒性的研究中, 已报道Cd2+对不同物种的毒性最大。本研究中, 低浓度Cd2+延缓盐生草种子萌发, 高浓度则产生抑制作用, 可能是因为Cd2+抑制种子内储藏淀粉和蛋白质的分解, 从而影响种子萌发所需的物质和能量, 致使种子萌发受阻[35]。植物受Cd2+毒害时, 线粒体和叶绿体受到破坏, 导致呼吸、光合作用减弱, 叶片发黄, 生物量下降[36]。本研究中, 盐生草幼苗在0.00~0.10 mmol· L-1 Cd2+胁迫下能维持正常生长, 0.20 mmol· L-1处理下, 株高、鲜重和根系活力均迅速降低, 同时Cd2+含量也急速升高, 这说明盐生草幼苗在Cd2+≥ 0.20 mmol· L-1时生长严重受阻, 而强耐Cd2+植物柳枝稷(Panicum virgatum)在0.01 mmol· L-1 Cd2+胁迫下便受到显著抑制[37], 说明盐生草对Cd2+的耐性更强, 这可能是因为盐生草长期在干旱、半干旱环境下生长, 其体内形成特殊的重金属离子解毒机制, 存在与重金属转运相关的基因。聚类和主成分分析结果表明, 生物量可首选为评价盐生草萌发期耐重金属Cd2+的重要参数。
Pb是植物非必需元素, 其在植物体内的过量积累不但会对植株产生毒害, 进入食物链还会对人体的多个器官和系统造成损伤, 是人类可能的致癌物质[38]。本研究中, 在低浓度Pb2+胁迫下, 盐生草种子发芽率、发芽势、株高、干鲜重和根系活力略高于对照, 高浓度处理下则显著降低, 且在3.00 mmol· L-1 Pb2+处理下各指标显著低于对照的52%, 组织内 Pb2+ 含量也在低浓度胁迫下相对较低, 3.00 mmol· L-1 Pb2+胁迫下显著升高, 并具有浓度效应, 这说明盐生草对重金属Pb2+具有一定耐性, 而低浓度下出现升高可能是植物对生长环境变化时产生的一种应激反应, 但这种刺激作用受到浓度的限制[39]。聚类和主成分分析结果表明, 盐生草在Pb2+≥ 3.00 mmol· L-1时无法正常生长, 发芽指标可首选为评价盐生草萌发期耐重金属Pb2+的重要参数。
在以上5种不同重金属胁迫下, 与种子萌发相比, 幼苗生长对重金属浓度更敏感, 这可能是因为在充足的氧气和适宜的温度环境下, 水分是种子萌发的另一重要因素, 健康种子得到足够的水分便能迅速发芽, 并且种皮对种胚具有一定的保护作用, 研究发现, 被重金属处理过的种子, 经蒸馏水洗涤后其发芽率高于未洗涤的种子, 说明种皮表面对重金属离子具有一定的黏附作用, 可以适当减少进入种胚的金属离子[40]。幼苗是植株生长最脆弱的时期, 其抗逆能力最弱, 种子萌发后, 胚芽和胚根极易受金属离子毒害[40], 少量的金属离子胁迫便能使胚芽和胚根生长能力减弱, 进一步使幼苗生长受阻, 这便导致即使在逆境中种子能正常萌发, 也不能成苗。
盐生草种子萌发和幼苗生长指标随着重金属胁迫浓度的提高而呈现出不同程度的下降趋势, 其中, 在重金属Zn2+浓度低于3.00 mmol· L-1, Cu2+、Ni2+和Pb2+浓度低于1.00 mmol· L-1, Cd2+浓度低于0.10 mmol· L-1的处理环境下, 其对盐生草种子萌发和幼苗生长的影响较小; 发芽指标可首选为评价盐生草萌发期耐重金属 Zn2+、Pb2+和Ni2+的重要参数, 生物量可首选为评价盐生草萌发期耐重金属Cu2+和Cd2+的重要参数。本研究在一定程度上揭示了盐生草萌发期对重金属Cu、Zn、Ni、Cd、Pb的耐性程度, 为土壤重金属污染修复提供了参考依据, 但关于其耐重金属胁迫的生理和分子机制需要进一步研究。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|