作者简介:赵娜(1981-),女,河南驻马店人,助理研究员,硕士。E-mail: hnzona@sina.com
本试验旨在研究青贮饲用油菜对山羊瘤胃发酵参数及微生物多样性的影响。将24只3月龄左右宜昌白山羊[平均体重(14.83±0.32) kg,公母各半]随机分为2组。试验组饲喂含有青贮饲用油菜的全混合饲粮,对照组饲喂含有青贮全株玉米的全混合饲粮,预试期7 d,正饲期90 d。试验结束时,每组屠宰6只羊,取瘤胃液测定pH、氨态氮、瘤胃液菌体蛋白质、挥发性脂肪酸等指标,并采用16S高通量测序方法分析瘤胃中菌群结构。结果表明,试验组与对照组山羊的平均日增重、干物质采食量和料重比无显著差异( P>0.05)。试验组与对照组间山羊瘤胃液pH值、氨态氮无显著差异( P>0.05);试验组山羊瘤胃液菌体蛋白含量和异丁酸含量显著高于对照组( P<0.05),其他挥发性脂肪酸含量差异不显著( P>0.05);瘤胃菌群结构分析结果表明,试验组和对照组相对丰度大于0.1%的菌门,分别有15和14个,两组中共有的菌门按照丰度排序依次是拟杆菌门、厚壁菌门、变形菌门、螺旋体门和Saccharibacteria,但各菌门丰度组间差异不显著( P>0.05)。属水平上,两个组山羊瘤胃液中普雷沃氏菌属的微生物含量均最多。试验组与对照组有显著差异的菌群 Prevotella_1丰度从21.10%减少到16.66%,模糊分类群丰度从1.95%增加到3.19%( P<0.05)。综上所述,饲喂青贮饲用油菜能保持山羊瘤胃内环境及微生物菌群结构稳定,维持瘤胃正常发酵。
The purpose of this experiment was to study the effects of feeding rape silage on the rumen fermentation parameters and rumen flora composition of goats. Twenty-four Yichang white goats of about 3 months old [average weight (14.83±0.32) kg, 12 male and 12 female] were randomly divided into two groups. The experimental group was fed a total mixed ration containing ensiled forage, and the control group was fed a total mixed ration containing ensiled whole maize. There was a pre-test period of 7 days and a feeding period of 90 days. At the end of the experiment, 6 goats were slaughtered in each group, and the rumen fluid was used to measure pH, ammonia nitrogen, rumen liquid bacterial protein, volatile fatty acids and other indicators. High-throughput sequencing (16S) method was used to analyze the bacterial population structure in the rumen. There was no significant difference in average daily gain, dry matter intake or feed ratio between the experimental group and the control group ( P>0.05). There was no significant difference in rumen fluid pH and ammonia nitrogen between goats in the two groups ( P>0.05). The contents of bacterial protein and isobutyric acid in rumen fluid of goats fed ensiled forage rape were significantly higher than those of the control group ( P<0.05), and differences in levels of other volatile fatty acids did not significantly ( P>0.05) between the two groups. There were 15 bacterial taxa with relative abundance greater than 0.1% identified in the experimental group and 14 in the control group. The most taxa common to both experimental and control groups were Bacteroides, Firmicutes, Proteobacteria, Spirochaetae and Saccharibacteria. At the genus level, the most abundant taxon was Prevotella.Compared to the control group, the only significant differences in bacterial abundance observed in the experimental group were a reduction in Prevotella_1 from 21.10% to 16.66% abundance and an increase in ambiguous taxa (for which reads could not be assigned to a species) from 1.95% to 3.19% abundance. For all other taxa, there was no significant difference between the control and experimental groups in the species abundance in the rumen flora. In summary, in this experiment feeding of silage rape maintained the rumen environment and microbial community structure of Yichang white goats without disruption to normal rumen fermentation.
近年来, 中国草食动物养殖业快速发展, 伴随而来的是饲草需求持续增加, 供给矛盾显现, 尤以冬春季节缺口更为明显。油菜(Brassica campestris)易越冬, 种植成本低、生物产量大、蛋白和脂肪含量高[1], 中国南北地区都适宜种植, 可以缓解冬春季节饲草不足的矛盾。近年来, 饲用油菜相关研究逐渐得到重视, 且已有数个饲用双低油菜品种如华油杂62、饲油1号、饲油36号等[2, 3]。杨雪海等[4]研究了不同生长阶段的油菜饲用营养价值。刘彦培等[5]报道了结实期全株油菜及油菜秸秆的混合青贮技术, 青贮方式能较好保存油菜及其秸秆, 且增强其适口性。王亚犁[6, 7]研究了饲用油菜复合青贮育肥秦川牛、滩羊等, 动物体增重效果明显。饲用油菜经青贮后适口性更好, 但其对反刍动物瘤胃发酵参数及菌群结构的影响尚未见报道。青贮玉米是反刍动物养殖中常用的饲料原料, 从品种培育、青贮技术、青贮品质、微生物菌落等方面得到了广泛研究[8, 9, 10, 11, 12], 其适口性较好, 对羊有较好的饲养效果[13]。本试验以青贮全株玉米(Zea mays)为对照, 研究青贮饲用油菜对山羊瘤胃发酵参数、瘤胃菌群结构的影响, 为饲用油菜在肉羊生产中的应用提供参考依据。
青贮饲用油菜:品种为华油杂62, 收割时期为结荚初期。青贮后外观为青黄色, 具有酸香气味。风干样中粗蛋白质(crude protein, CP)、中性洗涤纤维(neutral detergent fiber, NDF)和酸性洗涤纤维(acid detergent fiber, ADF)含量分别为11.35%、47.11%和33.80%。
青贮全株玉米:品种为雅玉8号, 收割时期为蜡熟期。青贮后外观为青黄色, 具有酸香气味。风干样中粗蛋白质、中性洗涤纤维和酸性洗涤纤维含量分别为13.10%、58.62%和35.71%。
将收割后经晾晒、粉碎、揉丝的饲用油菜或全株玉米分别用ZL 5552型青贮打捆包膜一体机进行打捆成圆柱形青贮捆, 每捆50 kg左右, 置于水泥地面遮雨棚下存放60 d后备用。
将3月龄左右、体重(14.83± 0.32) kg、健康的宜昌白山羊24只(公母各半), 随机分为2组, 每组4个重复, 每个重复3只羊。试验组饲喂含有青贮饲用油菜的全混合饲粮, 对照组饲喂含有青贮全株玉米的全混合饲粮(表1), 预试期7 d, 正试期90 d。
| 表1 全混合饲粮组成 Table 1 Composition and nutrient levels of total mixed rations |
饲养试验于2016年9月至12月在湖北省宜昌市农业科学研究院宜昌白山羊保种繁育场进行。试验羊全舍饲饲养, 佩戴耳号, 预试前驱虫、免疫。试验期间自由采食, 自由饮水。
1.5.1 生产性能测定 每天准确称量记录各处理组的饲料投放量及剩余量。分别于试验开始及结束当天晨饲前逐只称量试验羊空腹体重。计算干物质采食量(dry matter intake, DMI)、平均日增重(average daily gain, ADG)、料重比(feed to gain ration)等指标。
1.5.2 瘤胃内容物的采集与处理 在正饲期最后一天, 每组屠宰6只羊。试验羊只屠宰后立即取出瘤胃, 用无菌手术刀在瘤胃背部切开口, 用已灭菌的50 mL离心管盛取瘤胃内容物, 用盖子密封后投入液氮中冻存待测。
1.5.3 测定方法 干物质、粗蛋白质、中性洗涤纤维、酸性洗涤纤维、钙、总磷的测定均参照张丽英[14]的方法。采用苯酚-次氯酸钠比色法[15, 16]测定氨态氮含量; 采用PHS-3D型pH计测定pH; 参照Bradford[17]提出的考马斯亮蓝法测定菌体蛋白浓度。采用气相色谱法测定挥发性脂肪酸浓度[18]。
1.5.4 微生物群落多样性测序与功能分析 MetaVxTM文库构建和Illumina MiSeq测序:使用Qubit 2.0 Fluorometer (Invitrogen, Carlsbad, CA) 检测DNA样品的浓度, 使用MetaVxTM文库构建试剂盒(GENEWIZ, Inc., South Plainfield, NJ, USA)构建测序文库。以30~50 ng DNA为模板, 使用金唯智设计的一系列PCR引物扩增原核生物16S rDNA上包括V3, V4以及V5的3个高度可变区(如果有真核生物DNA污染, 只扩增V3和V4区)。采用包含“ CCTACGGRRBGCASCAGKVRVGAAT” 序列的上游引物和包含“ GGACTACNVGGGTWTCTAATCC” 序列的下游引物扩增V3和V4区, 采用包含“ GTGYCAGCMGCCGCGGTAA” 序列的上游引物和包含“ CTTGTGCGGKCCCCCGYCAATTC” 序列的下游引物扩增V4和V5区。另外, 通过PCR向16S rDNA的PCR产物末端加上带有Index的接头, 以便进行NGS测序[19]。使用Agilent 2100生物分析仪(Agilent Technologies, Palo Alto, CA, USA)检测文库质量, 并且通过Qubit 2.0 Fluorometer (Invitrogen, Carlsbad, CA)检测文库浓度。DNA文库混合后, 按Illumina MiSeq (Illumina, San Diego, CA, USA)仪器使用说明书进行2× 300/250 bp双端测序(paired-end, PE), 由MiSeq自带的MiSeq Control Software (MCS)读取序列信息。
数据分析:双端测序得到的正反向reads首先进行两两组装连接, 过滤拼接结果中含有N的序列, 保留序列长度大于200 bp的序列。经过质量过滤, 去除嵌合体序列, 最终得到的序列用于操作分类单元(operational taxonomic units, OTUs)分析, 使用VSEARCH(1.9.6)进行序列聚类(序列相似性设为97%)。然后用RDP classifier (ribosomal database program)贝叶斯算法对OTU的代表性序列进行物种分类学分析, 并在不同物种分类水平下统计每个样本的群落组成[20]。基于OTU的分析结果, 采用对样本序列进行随机抽样的方法, 分别计算Shannon、Chao1等Alpha多样性指数, 并作出稀释曲线。通过unweighted unifrac距离矩阵分析比较样本间是否有显著的微生物群落差异。
试验数据经Excel 2007处理后, 数值用“ 平均值± 标准差” 表示, 并用SPSS 18.0进行t检验。
试验组与对照组间山羊平均日增重、干物质采食量及料重比无显著差异(P> 0.05)。饲喂青贮全株玉米和青贮饲用油菜对宜昌白山羊的生产性能影响差异不显著(表2)。
| 表2 宜昌白山羊生产性能 Table 2 Production performance of Yichang white goat |
试验组与对照组间山羊瘤胃液pH值、氨态氮无显著差异(P> 0.05); 试验组山羊瘤胃液中菌体蛋白高于对照组(P< 0.05) (表3)。试验组山羊瘤胃液中异丁酸含量显著高于对照组(P< 0.05), 其他挥发性脂肪酸含量差异不显著(P> 0.05)。
| 表3 瘤胃发酵参数测定值 Table 3 The value of rumen fermentation parameters |
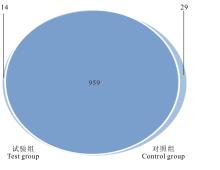
2.3.1 样品序列测序深度和多样性分析 基于相似度大于97%的原则, 将获得的有效序列进行聚类, 共获得1002个OTUs(图1)。其中试验组有973个OTUs, 对照组有988个, 两组间共享的OTUs有959个。说明两个试验组菌群构成同时具有特异性和相似性。经计算, 试验组和对照组的序列覆盖度(coverage)分别为89.36%和91.84%(表4)。
| 表4 样本测序数据质量统计 Table 4 Statistics of effective data |
图2中样品稀释曲线中每条曲线代表一个样本, 用不同颜色标记; 随测序深度增加, OTUs的数量随之增加。当曲线趋于平缓时表示随着抽取的数据量的加大, 检测到的OTUs数目不再增加, 此时的测序数据量较为合理。本试验的测序深度下, 检测到的OTUs数目不再增加, 可以覆盖样品中的大多数微生物。
Alpha多样性指数主要用于评价样品中微生物的丰富性和均匀性。由表5可以看出, 在同一测序深度下, 比较两组的Alpha多样性指数可知, ACE、Chao1、Shannon、Simpson等指数间差异均不显著(P> 0.05)。
| 表5 Alpha多样性指数分析 Table 5 Comparison of Alpha diversity indices of rumen microbial communities calculated |
2.3.2 不同水平瘤胃微生物种群结构分析 各样本进行Illumina Miseq双末端测序, 所得有效序列在不同分类水平上进行物种注释和统计, 宜昌白山羊瘤胃细菌菌群结构包括19门、30纲、53科、113属。试验组和对照组样本中的细菌多样性差异不显著。
从门水平瘤胃液细菌区系物种组成的相对丰度分析(表6), 相对丰度大于0.1%的菌门, 试验组有15个, 对照组有14个, 组间的差异不显著(P> 0.05)。两组中共有的丰度较高的菌门依次是拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、螺旋体门(Spirochaetae)和Saccharibacteria。其他菌门如黏胶球形菌门(Lentisphaerae)、装甲菌门(Armatimonadetes)等虽也有检出, 但每个菌门的相对丰度均不足0.01%。
| 表6 瘤胃液中门水平微生物丰度 Table 6 Phylum level significance analysis of rumen fluid microbes (%) |
从属水平瘤胃液细菌区系物种的相对丰度分析(表7), 相对丰度在0.01%以上的属有85个。在属的水平上, 两个处理组山羊瘤胃液中普雷沃氏菌属(Prevotella)微生物含量均最多。属水平上, 普雷沃氏菌属-1(Prevotella_1)、理研菌属肠道组RC9(Rikenellaceae_RC9_gut_group)、产乙酸糖发酵菌属(Saccharofermentans)、克里斯滕森菌科R-7(Christensenellaceae_R-7_group)、普雷沃氏菌属UCG-003(Prevotellaceae_UCG-003)、普雷沃氏菌属UCG-001(Prevotellaceae_UCG-001)和瘤胃球菌属UCG-011(Ruminococcus_UCG-011)等均为宜昌白山羊瘤胃优势菌群。试验组和对照组数量有显著差异的菌群为普雷沃氏菌属-1(Prevotella_1)(P< 0.05)。不能归类到目前已知菌属的细菌相对丰度高达26.71%和22.91%。与对照组相比, 青贮饲用油菜和青贮全株玉米对宜昌白山羊瘤胃中菌群的种类和丰度影响差异不显著。
| 表7 瘤胃液中属水平菌群分布 Table 7 Level of bacterial flora abundance in rumen fluid (%) |
日粮在瘤胃中发酵、有机酸的代谢情况可以用瘤胃液pH值反映。日粮对瘤胃液pH值影响较大, 一般认为瘤胃液pH值的正常范围为5.5~7.5[21]。本研究中各试验组瘤胃液pH在6.7~6.8, 且组间差异不显著, 说明青贮饲用油菜和青贮全株玉米在瘤胃中的发酵、代谢均正常。
山羊瘤胃中的氨态氮主要来源于食糜中的蛋白氮和非蛋白氮的降解, 其浓度在一定程度上反映了日粮成分中的蛋白降解与合成间所达到的平衡状况。Hume[22]的体内试验表明瘤胃中氨态氮最适浓度为9 mg· dL-1。也有研究表明微生物生长对氨氮浓度耐受的临界范围为6~30 mg· d$L^{-1}$[23] 。本试验的两个处理组的瘤胃氨态氮浓度均适宜瘤胃微生物生长。
微生物经复杂发酵合成的瘤胃微生物蛋白质, 为反刍动物小肠提供大量的可吸收蛋白质, 为畜体提供所需要蛋白质的40%~60%, 是最主要的氮源供应者[24]。瘤胃内碳水化合物和氮的利用效率决定了微生物蛋白质的合成情况。本研究中试验组宜昌白山羊瘤胃液菌体蛋白高于对照组, 说明青贮饲用油菜的营养物质更有利于瘤胃微生物蛋白质的合成。
反刍动物主要的能量来源之一是挥发性脂肪酸, 日粮组成影响瘤胃发酵合成挥发性脂肪酸的效率和浓度等。梁艾东[25]报道, 全株青贮玉米对肉羊瘤胃pH、NH3-N浓度以及乙酸、丙酸、丁酸浓度均有不同程度的影响。但是张显东[26]报道, 全株玉米青贮对绵羊瘤胃液pH值变化有较大影响, 对绵羊瘤胃的NH3-N浓度、挥发性脂肪酸浓度和瘤胃液稀释率影响较小。曲永利等[27]发现饲喂不同收获期玉米青贮日粮对奶牛瘤胃内环境及发酵产物的影响不显著。本研究中两个处理组日粮经瘤胃微生物发酵后的主要产物为乙酸, 瘤胃发酵类型主要是乙酸型。异丁酸是异位酸之一, 本研究中试验组异丁酸含量显著高于对照组, 但是两组间其他挥发性脂肪酸的含量均无显著差异; 试验组山羊瘤胃中菌体蛋白含量也高于对照组, 造成这一现象的原因可能是由于异丁酸可以缓解瘤胃蛋白质降解速度, 提高菌体蛋白质浓度[28]。
瘤胃微生物多样性受多方面的影响, 其中日粮组成对瘤胃微生物有显著的影响。反过来, 瘤胃微生物也影响到宿主的营养、代谢和免疫等[29]。高通量测序技术对不同日粮处理的反刍动物瘤胃内容物样品检测后, 采用可获得大量微生物的生物学信息, 便于更准确地分析日粮与瘤胃微生物的关系[30], 在研究日粮组成对反刍动物瘤胃微生物影响的相关方面效果明显优于传统方法。
本研究经Illumina Miseq双末端测序得知, 试验组和对照组宜昌白山羊瘤胃细菌多样性差异不显著。两组中共享的丰度较高的菌门依次是拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、螺旋体门(Spirochaetae)和Saccharibacteria。这与以往的研究结果相一致[31, 32], 拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria)在很多草食动物胃肠道微生物中均为优势菌门。瘤胃中非纤维性碳水化合物的主要降解者为拟杆菌门微生物, 如普雷沃氏菌属; 而厚壁菌门含有大量分解纤维的菌属, 如瘤胃球菌属、丁酸弧菌属、假丁酸弧菌属等。
在属的水平上, 本试验两个组的山羊瘤胃液中普雷沃氏菌属(Prevotella)的丰度均最高, 提示了此菌属在瘤胃发酵中的重要性。宜昌白山羊瘤胃核心微生物组大部分为普氏菌。反刍动物瘤胃内的普雷沃菌属对多种营养物质的降解都有着极其重要的作用[33]。Avgustin等[34]研究表明普雷沃菌属虽然不能降解纤维素, 但却是瘤胃中主要的蛋白降解菌之一; 普雷沃氏菌属属于耗氢菌, 主要分解蛋白质、淀粉。本研究结果, 对照组山羊瘤胃中Prevotella_1数量高于试验组, 瘤胃液中菌体蛋白含量结果与之相反, 可能是普雷沃菌属中Prevotella_1降解了瘤胃中的菌体蛋白。
本研究发现, 普雷沃氏菌属、理研菌属肠道组RC9(Rikenellaceae_RC9_gut_group)、产乙酸糖发酵菌属(Saccharofermentanst)、克里斯滕森菌科R-7群(Christensenellaceae_R-7_group)、瘤胃球菌属UCG-011(Ruminococcus_UCG-011)等为宜昌白山羊瘤胃优势菌群。瘤胃球菌属(Ruminococcus)曾被认为是瘤胃中主要的纤维降解菌, 该属所含的白色瘤胃球菌和黄色瘤胃球菌能分泌大量的纤维素酶和半纤维素酶[35, 36], 其丰度的提高能显著促进瘤胃内营养物质的消化利用。但已有大量研究表明, 瘤胃球菌属的相对丰度在瘤胃微生物中仅占很小的比例[37, 38], 而本研究中试验组和对照组山羊瘤胃中瘤胃球菌属相对丰度分别达到4.5%和3.5%左右。瘤胃中的纤维降解菌除瘤胃球菌外, 还有产琥珀酸丝状杆菌、溶纤维丁酸弧菌和梭菌等, 但是本次检测结果这几种菌的丰度均不高。
Alpha多样性指数中的Chao1指数、ACE指数反映样品中物种群落的丰富度, Shannon指数、Simpson指数则反映物种的多样性。本研究中在同一测序深度下, 两组的Chao1、Shannon、Simpson等指数间差异均不显著, 说明青贮饲用油菜和青贮全株玉米对瘤胃微生物的丰富度和多样性影响无显著差异。
日粮的营养成分显著影响瘤胃微生物数量、挥发性脂肪酸含量等[39], 本研究中青贮饲用油菜与青贮全株玉米相比, 对宜昌白山羊瘤胃发酵参数、瘤胃菌群结构无不良影响。与青贮玉米相比, 饲用油菜的适宜种植地域广阔, 生物产量更高, 在草食动物的养殖上具有较好的应用前景。
结合瘤胃发酵参数和微生物菌群高通量测序结果, 饲喂青贮饲用油菜能保持山羊瘤胃内环境及微生物菌群结构稳定, 维持瘤胃正常发酵。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|