作者简介:何建军(1995-),男,甘肃临洮人,在读硕士。E-mail: 3355829261@qq.com
本研究以盐生植物盐生草为材料,以不同浓度的PEG-6000模拟干旱胁迫和以不同浓度的4种钠盐(NaCl、Na2SO4、NaHCO3、Na2CO3)进行盐胁迫,探讨其对盐生草种子萌发特性的影响。结果表明:随着PEG-6000浓度的升高,盐生草种子发芽率、发芽势呈现下降的趋势,幼苗鲜重、干重、株高以及根系活力均呈现先上升后下降的趋势。聚类分析和主成分分析结果显示,以6% PEG-6000为结点,将不同浓度PEG-6000处理聚为两类,鲜重可被首选为评价盐生草萌发期耐干旱的重要参数;随着4种钠盐处理浓度的升高,发芽率、发芽势、幼苗鲜重、干重、株高以及根系活力均呈现不同程度的下降趋势,表明盐胁迫对种子的萌发以及幼苗的生长均有抑制作用,当Na+浓度相同时,4种钠盐对盐生草种子萌发及幼苗生长的抑制作用大小为Na2CO3>NaHCO3>NaCl>Na2SO4,聚类分析和主成分分析结果显示,以50.00 mmol·L-1 NaHCO3,62.50 mmol·L-1 Na2SO4,25.00 mmol·L-1 Na2CO3 和100.00 mmol·L-1 NaCl为结点,将各钠盐胁迫浓度聚为两类,其中发芽指标可被首选为评价盐生草萌发期耐NaHCO3、Na2SO4的重要参数,根系活力可被首选为评价盐生草萌发期耐Na2CO3的重要参数,干重可被首选为评价盐生草萌发期耐NaCl的重要参数。
To explore the effects of drought and salt stress on germination characteristics of halophytes, this study simulated drought stress with different concentrations of PEG-6000 and four sodium salts (NaCl, Na2SO4, NaHCO3, Na2CO3) to evaluate the effects of those treatments on the seed germination characteristics of Halogeton glomeratus. It was found the germination percentage and germination energy decreased with increasing PEG-6000 concentration, while the seedling fresh weight, dry weight, plant height and root activity initially increased and then decreased at higher PEG-6000 concentration. Cluster analysis and principal component analysis showed that the different PEG-6000 concentrations could be divided into two groups with 6% PEG-6000 as the point of separation. Fresh weight appeared to be an important parameter. In addition, germination percentage germination energy, seedling fresh weight, dry weight, plant height and root activity declined with increase in concentration of the four sodium salts. This indicated that salt stress inhibited seed germination and seedling growth, with the effects of the four tested sodium salts ranked: Na2CO3>NaHCO3>NaCl>Na2SO4. Cluster analysis and principal component analysis showed that the sodium salt concentrations were divided into two groups with the separation points falling at 50.00 mmol·L-1 NaHCO3, 62.50 mmol·L-1 Na2SO4, 25.00 mmol·L-1 Na2CO3 and 100.00 mmol·L-1 NaCl. Among the plant traits evaluated as indicators of H. glomeratus stress tolerance in the germination stage, the germination index was the key indicator of NaHCO3 and Na2SO4 stress, root activity emerged as the primary indicator of Na2CO3 stress and dry weight was the major indicator of NaCl stress in H. glomeratus.
近年来, 水资源匮乏以及土壤盐渍化已成为影响农业发展及生态环境建设的两大全球性问题[1]。目前, 全世界遭受水土流失的耕地面积约2.5× 109 hm2[2], 受到盐渍化威胁的全球耕地面积约为9.5× 108 h2[3], 在影响作物产量的各种非生物因素中, 干旱和盐碱造成的作物减产约40%, 严重影响了农作物的生长, 制约了农业经济的发展[4]。干旱胁迫下, 植物体内由于水分失衡会发生一系列生理生化响应, 进而引起代谢紊乱, 影响植物正常生长[5]。盐胁迫下会导致植物体内发生渗透胁迫、离子毒害作用, 扰乱植物体内营养元素平衡, 使其出现中毒甚至死亡的现象[6]。
种子萌发期是植物对环境胁迫响应最敏感的时期, 直接影响植株的生长发育[7]。在干旱及盐分胁迫下, 由于植物体内缺水和产生的离子毒害会使植物体内酶的活性发生一系列的变化, 进而限制植物生长发育[8]。种子能否在干旱及盐碱环境下发芽成苗是决定该植株在该环境下完成整个生长发育过程的重要阶段[9]。因此, 研究植物在萌发期的抗旱耐盐性, 以及了解植物抗旱耐盐的生理特点有着重要的意义。
目前, 利用模拟干旱和盐胁迫的方法对植物种子萌发特性的研究受到广泛应用[10, 11, 12]。盐生草(Halogeton glomeratus)属藜科(Chenopodiaceae), 一年生草本植物, 广泛生长于甘肃、青海、新疆、内蒙古、宁夏等荒漠地区, 地上多分枝的肉质化茎、叶组织具有极强的抗旱、耐盐及富集重金属的特性, 被称为荒漠地区抗旱、耐盐先锋植物[13, 14], 然而关于盐生草种子萌发期的抗旱、耐盐性评价的报道较少。基于此, 本研究将盐生草种子分别置于不同浓度PEG-6000和NaCl、Na2SO4、NaHCO3、Na2CO3溶液中, 模拟干旱以及不同盐分胁迫处理, 通过测定发芽指标、鲜重、干重、株高以及根系活力来分析盐生草种子对干旱及不同盐分的胁迫的耐受能力, 并对各项指标进行综合评价分析, 以期为盐生草在干旱、盐碱地的种植及生态治理提供理论依据。
2018年11月在甘肃省会宁县盐碱地采集成熟的盐生草种子, 进行清洗、除杂后备用。千粒重为0.38 g。
1.2.1 浓度设置 根据预试验及参考文献[15]将PEG-6000的浓度梯度设置为CK(0)、2%、4%、6%、8%、10%、15%、20%。为保证4种钠盐处理中Na+浓度相同, 浓度梯度设置如表1所示。以上溶液均由蒸馏水配制。
| 表1 试验中4种不同浓度盐溶液的配制 Table 1 Preparation of four salt solutions with different concentrations in the test (mmol· L-1) |
1.2.2 萌发试验 取饱满、大小均一的盐生草种子于离心管中置于超净工作台, 首先用无菌水冲洗种子表面杂质, 然后用75%的酒精灭菌消毒30 s, 再用无菌水清洗种子表面的酒精至干净, 后用10%的NaClO溶液颠倒清洗数次, 最后用无菌水冲洗4~5次, 得到无菌盐生草种子, 在直径为90 mm的垫有双层滤纸的培养皿中加入5 mL不同浓度的处理溶液, 每个处理均设置4个重复, 以蒸馏水作为对照。再将50粒盐生草种子整齐置于培养皿中, 并用封口膜封口, 每天用分析天平称量蒸发散失的水分, 并加蒸馏水补充, 使渗透势不变。后将培养皿置于培养室中保持温度22 ℃, 8 h光照/16 h 黑暗, 光照强度4000 Lx, 相对湿度80%的环境下进行萌发试验[16]。
1.2.3 发芽指标测定 以种子露白为标准[16]。对3和7 d内发芽种子数进行统计。
发芽率=(7 d内种子发芽数/总种子数)× 100%
发芽势=(3 d内种子发芽数/总种子数)× 100%
1.2.4 株高扫描 将生长7 d的盐生草幼苗, 以每盘培养皿为单位从中随机选取4株幼苗采用WinRHIZO 图像扫描仪(Epson Long Beach, CA, USA)进行株高扫描, 以平均值作为株高指标。
1.2.5 生物量测定 生长7 d后, 由于盐生草幼苗只有细小幼根和刚展开的2片子叶, 单株生物量无法测量, 故以每盘培养皿为一个单位, 测定各不同胁迫浓度对单位幼苗生物量的影响, 用蒸馏水冲洗盐生草幼苗数次, 待冲洗干净后用滤纸吸干表面水分。用电子分析天平称其鲜重(fresh weight, FW)。然后装入信封袋中放置30~40 ℃烘箱, 烘3~4 d至恒重, 取出用电子分析天平称其干重(dry weight, DW)。
1.2.6 根系活力测定 将生长了7 d的盐生草幼苗称取0.20 g, 采用2, 3, 5, -三苯基4唑氯化物(2, 3, 5-triphenyl-2H-tetrazolium chloride, TTC)还原测定法测定其根系活力[17]。
采用Microsoft Excel 2010进行数据处理和图表绘制, 运用SPSS 20.0软件(SPSS Inc., Chicago, USA)进行单因素方差分析(ANOVA), 主成分分析和聚类分析。所有结果由平均值± 标准误(means± standard error)表示, 4次生物学重复。
2.1.1 PEG-6000胁迫对盐生草种子萌发指标的影响 由表2可知, 随着PEG-6000浓度的升高, 盐生草种子的发芽率和发芽势均呈下降的趋势, 且差异显著(P< 0.05)。当PEG-6000浓度为6%时, 发芽率和发芽势分别为62.00%, 11.33%, 与对照相比下降了31.30%, 86.35%。当PEG-6000浓度为20%时, 发芽率和发芽势分别为14.50%, 2.67%, 与对照相比下降了83.93%, 96.78%, 且差异显著(P< 0.05)。表明随着PEG-6000浓度的升高, 盐生草的种子活力会明显降低。在一定的PEG-6000浓度范围下, 盐生草种子可以萌发, 但其萌发明显受到抑制。
| 表2 盐生草种子发芽率和发芽势在PEG-6000处理下的变化 Table 2 Changes of germination percentage and germination energy of H. glomeratus seeds treated with PEG-6000 (%) |
2.1.2 PEG-6000胁迫对盐生草幼苗鲜重和干重的影响 如图1所示, 对PEG-6000胁迫处理7 d的盐生草幼苗测定鲜重、干重, 发现随着PEG-6000浓度的升高, 鲜重、干重均呈现先上升后下降的趋势, 当PEG-6000浓度为4%时均达到最大, 为0.17和0.012 g, 与对照相比差异不显著(P> 0.05)。当PEG-6000的浓度为20%时, 鲜重和干重分别为0.03和0.007 g, 与对照相比下降了75.00%, 36.36%, 且差异显著(P< 0.05)。因此, 在高浓度PEG-6000胁迫下, 盐生草幼苗的生长明显受到了抑制。
2.1.3 PEG-6000胁迫对盐生草幼苗株高和根系活力的影响 如图2所示, 株高的变化趋势与根系活力相近, 均呈现随着PEG-6000浓度的升高而先上升后下降的趋势。PEG-6000浓度为4%时均达到最大, 株高为6.34 cm, 与对照相比上升了1.28%, 但差异不显著(P> 0.05), 根系活力为107.51%, 与对照相比上升了7.51%, 且差异显著(P< 0.05)。当PEG浓度为20%时, 株高为3.82 cm, 与对照相比下降了38.98%, 根系活力为75.40%, 与对照相比显著下降了24.60%。
 | 图2 盐生草幼苗株高和根系活力在PEG-6000处理下的变化Fig.2 Changes of plant height and root activity of H. glomeratus seedlings treated with PEG-6000 |
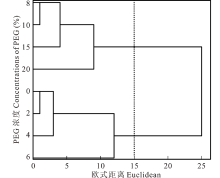
2.1.4 综合聚类分析及主成分分析 为进一步研究PEG-6000胁迫对盐生草幼苗生长的抑制程度, 对PEG-6000胁迫处理下的种子萌发和幼苗生长指标进行聚类分析(图3), 以欧式距离15为界, 将PEG-6000处理的8个浓度梯度聚为了两类, 其中以浓度为0~6%为第Ⅰ 类, 8%~20%为第Ⅱ 类。得出PEG-6000胁迫盐生草萌发生长的临界耐受浓度为6%, 对6%胁迫处理下6个性状指标进行主成分分析(表3), 提取了2个主成分, 主成分1的特征值为4.27, 贡献率为70.27%, 主成分2的特征值为1.78, 贡献率29.73%。累计贡献率达100.00%, 其中主成分1在鲜重和干重上具有最高载荷(1.00), 主成分2在发芽势上具有最高载荷(0.87), 主成分1的贡献率约为主成分2的2倍。
| 表3 盐生草种子萌发特性在PEG-6000处理下的主成分分析 Table 3 Principal component analysis of germination characteristics of H. glomeratus seeds treated with PEG-6000 |
2.2.1 4种钠盐胁迫对盐生草种子萌发指标的影响 如表4可知, 4种钠盐胁迫处理对盐生草种子萌发指标的影响有所不同, 随着Na2SO4浓度的升高, 盐生草种子的发芽率和发芽势呈现先升高后下降的趋势。在Na2SO4浓度为25.00 mmol· L-1发芽率和发芽势均达到最大值, 发芽率为93.00%, 较对照升高4.49%。发芽势为81.50%, 较对照相比升高2.52%。当Na2SO4达到最大处理浓度150.00 mmol· L-1时, 发芽率为9.00%, 较对照降低了89.89%。发芽势为4.67%, 较对照降低了94.13%。表明低浓度Na2SO4胁迫对植物生长具有一定的促进作用, 但超过一定的浓度后表现为抑制。随着Na2CO3, NaHCO3, NaCl浓度的升高, 盐生草种子的发芽率和发芽势总体呈现下降的趋势。当NaCl达到最大处理浓度300.00 mmol· L-1时, 发芽率较对照降低了96.26%; 发芽势较对照降低了97.48%。当NaHCO3达到最大处理浓度300.00 mmol· L-1时, 发芽率较对照降低了97.75%。发芽势较对照降低了97.48%。当Na2CO3达到最大处理浓度150.00 mmol· L-1时盐生草种子不发芽。表明高浓度盐处理均对种子的萌发具有严重抑制作用。4种钠盐溶液相比, 除了具有相同的Na+外, NaHCO3和Na2CO3具有较高的pH值。当4种盐处理在Na+相同的情况下, 100.00 mmol· L-1 NaCl , 100.00 mmol· L-1 NaHCO3, 50.00 mmol· L-1 Na2CO3, 50.00 mmol· L-1 Na2SO4相比, 对盐生草种子萌发的毒害作用为Na2CO3> NaHCO3> NaCl> Na2SO4。与对照相比差异显著(P< 0.05)。
| 表4 盐生草种子发芽势和发芽率在4种盐处理下的变化 Table 4 Changes of germination energy and germination rate of H. glomeratus seeds treated with four salts (%) |
2.2.2 4种钠盐胁迫对盐生草幼苗株高的影响 如图4所示, 盐生草幼苗株高的变化趋势与发芽势和发芽率相接近, 均随着Na2CO3, NaHCO3, NaCl, Na2SO4浓度的增加, 呈现下降的趋势, 且各浓度处理的盐生草幼苗株高均低于对照, Na2SO4处理在浓度低于37.50 mmol· L-1时与对照差异不显著(P> 0.05), Na2CO3, NaHCO3, NaCl各浓度处理均与对照差异显著(P< 0.05)。且当Na2CO3, NaHCO3, NaCl, Na2SO4的浓度分别为25.00, 50.00, 200.00, 150.00 mmol· L-1时, 盐生草幼苗株高降为2.24, 2.18, 2.00, 1.99 cm, 与对照相比了均下降到对照的50.00%以下。Na2CO3, NaHCO3在浓度为75.00~125.00 mmol· L-1, 125.00~300.00 mmol· L-1之间盐生草幼苗株高趋于稳定。在Na+浓度相同的处理条件下, 即Na2CO3, NaHCO3, NaCl, Na2SO4的浓度为50.00, 100.00, 100.00, 50.00 mmol· L-1时, 4种盐处理下的盐生草幼苗株高为1.06, 1.17, 3.10, 3.66 cm, 说明4种盐处理对盐生草幼苗株高的抑制作用大小为 Na2CO3> NaHCO3> NaCl> Na2SO4。
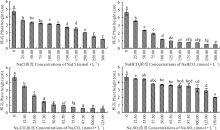 | 图4 盐生草幼苗株高在4种盐处理下的变化Fig.4 Changes of plant height of H. glomeratus seedlings treated with four salts |
2.2.3 4种钠盐胁迫对盐生草幼苗根系活力的影响 由图5可知, 根系活力的变化趋势与株高相近, 随着Na2CO3, NaHCO3, NaCl, Na2SO4浓度的增加, 各盐处理中盐生草幼苗根系活力均呈现下降的趋势, 且各处理组与对照差异显著(P< 0.05)。NaCl, Na2SO4处理浓度分别达到最大300.00 mmol· L-1, 150.00 mmol· L-1时, 盐生草幼苗根系活力分别为50.76%和51.70%。当Na2CO3, NaHCO3浓度分别为87.50, 175.00 mmol· L-1时, 根系活力均低于对照50.00%。说明盐胁迫对盐生草幼苗的根系活力有抑制作用。且在Na+浓度相同的处理条件下, Na2CO3对盐生草幼苗根系活力抑制作用最大, Na2SO4对其抑制作用最小。这说明碱性盐胁迫下对植株幼苗根系的毒害作用大于中性盐胁迫。
 | 图5 盐生草幼苗根系活力在4种盐处理下的变化Fig.5 Changes of root activity of H. glomeratus seedlings treated with four salts |
2.2.4 4种钠盐胁迫对盐生草幼苗鲜重及干重的影响 随着Na2CO3, NaHCO3, NaCl浓度的升高, 盐生草幼苗鲜重均呈现下降的趋势(图6)。Na2CO3, NaHCO3, NaCl 的处理浓度分别在0~25.00 mmol· L-1, 0~50.00 mmol· L-1, 0~100.00 mmol· L-1时与对照相比变化差异不显著(P> 0.05), 后者趋于稳定。随着Na2SO4浓度的增加, 盐生草幼苗鲜重呈现先缓慢上升后下降的趋势, 且处理与对照差异不显著(P> 0.05)。当NaHCO3, NaCl, Na2SO4处理浓度达到最大时, 与对照相比其鲜重下降了99.21%, 95.26%, 67.20%。随着Na2CO3, NaHCO3, NaCl, Na2SO4 浓度的升高, 盐生草幼苗的干重均呈现先上升后下降的趋势。当Na2CO3, NaHCO3, NaCl, Na2SO4浓度为37.50, 75.00, 125.00, 125.00 mmol· L-1时, 盐生草幼苗的干重均降为对照的50.00%以下。
 | 图6 盐生草幼苗鲜重和干重在4种盐处理下的变化Fig.6 Changes of fresh weight and dry weights of H. glomeratus seedlings treated with four salts |
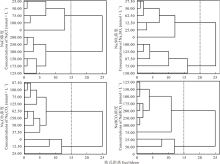
2.2.5 综合聚类分析及主成分分析 首先运用模糊数学(Fuzzy数学)中的隶属函数法对单位不同的各项指标测定值进行标准化[18], 然后对各项测定指标进行聚类分析(图7), Na2CO3胁迫处理下的不同浓度在欧式距离为15时聚为两类, 0~25.00 mmol· L-1为第Ⅰ 类, 37.50~150.00 mmol· L-1为第Ⅱ 类。NaHCO3胁迫处理下的不同浓度在欧式距离为15时聚为两类, 0~50.00 mmol· L-1为第Ⅰ 类, 75.00~300.00 mmol· L-1为第Ⅱ 类。NaCl胁迫处理下的不同浓度在欧式距离为15时聚为两类, 0~100.00 mmol· L-1为第Ⅰ 类, 125.00~300.00 mmol· L-1为第Ⅱ 类。Na2SO4胁迫处理下的不同浓度在欧式距离为20时聚为两类, 0~62.50 mmol· L-1为第Ⅰ 类, 75.00~150.00 mmol· L-1为第Ⅱ 类。Na2CO3, NaHCO3, NaCl, Na2SO4胁迫盐生草幼苗萌发生长的临界耐受浓度分别为:25.00, 50.00, 100.00, 62.50 mmol· L-1。将Na2CO3, NaHCO3, NaCl, Na2SO4耐受临界浓度下的发芽势, 发芽率, 株高, 根系活力, 鲜重, 干重6个测定指标进行主成分分析(表5和表6), 得出不同盐胁迫下的2个主成分的累计贡献率均达到了100.00%。第1主成分的贡献率大约为第2主成分的2倍。结合4种盐胁迫的2个主成分及6个性状的相关系数可以发现, Na2SO4的第1主成分的特征值为3.92, 贡献率为65.41%, 其在鲜重上有最大载荷, 第2主成分的特征值为2.08, 贡献率为34.59%, 其在干重上有最大载荷。NaCl的第1主成分的特征值为4.30, 贡献率为71.71%, 其在干重上有最大载荷, 第2主成分的特征值为1.70, 贡献率为28.29%, 其在发芽势上有最大载荷。Na2CO3的第1主成分的特征值为3.85, 贡献率为64.24%, 其在根系活力上有最大载荷, 第2主成分的特征值为2.15, 贡献率为35.77%, 其在鲜重上有最大载荷。NaHCO3的第1主成分的特征值为3.88, 贡献率为64.70%, 其在发芽率上有最大载荷, 第2主成分的特征值为2.12, 贡献率为35.30%, 其在干重上有最大载荷。
| 表5 2个因子的特征值及贡献率 Table 5 Eigen values of 2 principal components and their contribution and cumulative contribution |
| 表6 各因子成分矩阵 Table 6 Factor matrix of each component |
种子萌发期是植株生长的一个关键时期, 决定植物群体在逆境条件下能否建植成功。而种子的发芽率和发芽势是衡量种子品质的重要指标[19, 20]。本研究表明:一方面, 在干旱胁迫下, 盐生草种子的发芽势和发芽率均呈现随PEG-6000浓度的升高而下降的趋势, 当PEG-6000浓度为20%时, 盐生草种子的发芽率为14.50%, 发芽势为2.67%, 且与对照相比差异显著(P< 0.05)。说明PEG-6000模拟的干旱胁迫对盐生草种子的萌发有抑制作用, 这与徐建欣等[21]对新疆橡胶草(Taraxacum kok-saghyz)种子萌发试验的结论相吻合。另一方面, 在4种钠盐溶液胁迫下, 盐生草种子的发芽势和发芽率总体呈现随盐溶液浓度的升高而下降的趋势。NaCl, Na2SO4两种盐溶液低浓度时对种子萌发抑制作用没有显著差异, 这与李锦锋等[22]对白茎盐生草(Halogeton arachnoideus)萌发试验的结论一致。刘克彪等[23]利用钠盐胁迫处理罗布麻(Apocynum venetum)种子、阎秀峰等[24]用碳酸盐处理星星草(Puccinellia tenuiflora)种子得出低浓度的碳酸盐对种子萌发有增效效应。本试验结果与之有所不同, 可能与Na2CO3和NaHCO3设定浓度以及盐生草的耐盐碱性不同有关。NaCl, Na2SO4, Na2CO3, NaHCO3在具有相同的Na+浓度的条件下, NaHCO3和Na2CO3溶液呈碱性, pH值较高。当4种盐处理在Na+相同的情况下, 100.00 mmol· L-1NaCl, 100.00 mmol· L-1NaHCO3, 50.00 mmol· L-1Na2CO3, 50.00 mmol· L-1Na2SO4时的发芽率53.00%, 13.00%, 11.00%, 80.50%, 说明4种盐处理对盐生草种子发芽的毒害作用为Na2CO3> NaHCO3> NaCl> Na2SO4。李锦锋等[22]用钠盐胁迫处理白茎盐生草种子, 得到NaCl对其萌发及生长的抑制作用强于Na2SO4。Lin等[25]用中性盐和碱性盐模拟土壤盐碱化条件, 对羊草(Leymus chinensis)幼苗进行胁迫, 得出碱性盐对羊草幼苗的危害更加严重。
对处理7 d的盐生草幼苗的株高、干重、鲜重以及根系活力进行测定得出, 随着4种钠盐溶液浓度的升高, 盐生草幼苗的株高、鲜重、干重以及根系活力总体呈现下降的趋势。黄高鉴等[26]研究了钠盐胁迫对柳枝稷(Panicum virgatum)生物量的影响, 表明盐胁迫能够显著降低其生物量(P< 0.05), 对柳枝稷生长起到明显的抑制作用。本研究中, 随着4种盐浓度的增加, 各钠盐处理下盐生草幼苗株高均呈梯度下降, 鲜重、干重均表现为持续降低的趋势, 且与对照相比差异均显著(P< 0.05), 说明盐处理对盐生草幼苗生长有明显抑制作用, 熊雪等[27]研究发现紫花苜蓿(Medicago sativa)受到盐胁迫后发生渗透使植株生长受到抑制, 生物量显著降低。本研究观察7 d后幼苗的根系活力, 得出随着Na2CO3、NaHCO3、NaCl、Na2SO4浓度的升高, 盐生草幼苗的根系活力均呈现下降的趋势。徐宁等[28]研究了NaCl胁迫对高粱(Sorghum bicolor)种子萌发和幼苗生长特性的影响, 得到盐胁迫下幼苗根系活力随盐浓度的升高呈下降的趋势。本研究表明盐胁迫下离子毒害作用会降低幼苗根系活力。同时, 随着PEG-6000的浓度升高, 盐生草幼苗的株高、鲜重、干重以及根系活力, 总体呈现先上升后下降的变化趋势, 在4%时达到最大值, 但与对照相比差异不显著(P> 0.05)。在PEG-6000浓度为6%~20%时, 盐生草株高、鲜重、干重以及根系活力显著下降。这与杨智等[29]研究得出干旱胁迫能使垂穗披碱草(Elymus nutans)的生物量和根系活力显著降低(P< 0.05)的试验结论相一致。表明干旱和盐胁迫都会抑制植物的萌发及幼苗的生长。Na2SO4处理下, 对盐生草幼苗的生长抑制作用最小, Na2CO3处理下, 对盐生草幼苗的生长抑制作用最大。
主成分分析是将原来各项指标重新组合成一组新的彼此独立的几个综合指标, 用少数的综合指标来反映原来多指标的信息[30]。李丰先等[31]运用此方法得出发芽率和干重可作为萌发期高粱耐碱性的主要评价指标。杨帆等[32]得出根长、芽鲜重、发芽率可作为萌发期高粱耐盐性的主要评价指标。蔺军[33]得出相对发芽指数、发芽率可作为萌发期燕麦(Avena sativa)耐盐性的主要评价指标。本研究通过综合聚类分析得出:盐生草耐Na2CO3、NaHCO3、NaCl、Na2SO4的临界浓度为25.00, 50.00, 100.00, 62.50 mmol· L-1, 耐PEG-6000的临界浓度为6%。以4种钠盐胁迫及PEG-6000胁迫的临界浓度的各项测定指标进行主成分分析得出, Na2SO4和NaHCO3的发芽指标贡献率较大, NaCl的干重指标贡献率较大, Na2CO3的根系活力指标贡献率较大, PEG-6000的鲜重指标贡献率较大。因此生物量和发芽指标可作为评价盐生草萌发期耐盐及耐干旱的主要评价指标。
综上所述, 随着PEG-6000及4种钠盐浓度的升高, 盐生草种子萌发和幼苗生长指标呈现不同程度的变化趋势, 6% PEG-6000胁迫下鲜重为主要鉴定指标。在NaHCO3、Na2SO4的胁迫浓度分别为50.00、62.50 mmol· L-1时萌发指标可作为评价盐生草萌发期耐盐胁迫的主要鉴定指标; Na2CO3的胁迫浓度为25.00 mmol· L-1时根系活力可作为评价盐生草萌发期耐盐胁迫的主要鉴定指标; NaCl胁迫浓度为100.00 mmol· L-1时干重为主要鉴定指标。本研究表明在6% PEG-6000环境下以及50.00 mmol· L-1 NaHCO3、62.50 mmol· L-1 Na2SO4、25.00 mmol· L-1 Na2CO3、100.00 mmol· L-1 NaCl下, 盐生草均可正常萌发生长。本研究初步揭示了盐生草萌发期对干旱胁迫以及盐胁迫的耐性程度, 为以后干旱、盐碱地种植盐生草进行生态修复提供了一定的参考依据。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|