作者简介:马源(1989-),男,甘肃嘉峪关人,在读博士。E-mail: mayuan608@163.com
了解根际土壤养分碳、氮和磷的转化和循环利用是解决草地农业生态系统可持续利用性和提高草地生产力的根本问题。草地根际过程能够反映土壤碳、氮和磷等养分的周转速率,影响植物、土壤微生物对养分的竞争和捕获,维持根际微环境中各组分的养分平衡,同时与作物相比,草地土壤中养分元素碳、氮和磷的耦合性更强。因此,根际微生态系统结构与功能在维持养分转化和循环等方面具有重要作用。大量文献报道,调控根际微环境改变的关键因素是植物与土壤进行物质交换和信息传递的关键物质-根际分泌物,同时根际分泌物也是介导根际微生物和根际酶活性的关键物质。当草地环境发生改变时,该区域的根际分泌物、根际酶活性和根际土壤的微生物的组成和多样性也将发生根本性改变,从而导致该区域土壤养分的供应量和有效性发生改变,最终影响草地生产力和养分的有效利用效率。因此,深入探究草地根际过程对养分循环的调控机理,对于揭示草地植物与微生物间养分物质的分配利用和养分收益方面具有重要指导意义。综述了根际分泌物、根际酶和根际微生物参与养分循环的机制和互作机理,总结草地根际过程参与养分循环的机制,并对草学领域未来在根际微域的研究进行了一定的展望。
Understanding of the transformations and recycling processes of carbon, nitrogen and phosphorus in the soil rhizosphere is fundamental to solving the problems currently limiting the sustainable utilization of grassland agricultural ecosystems and improving grassland productivity. Rhizosphere processes in grassland can reflect the soil carbon, nitrogen and phosphorus nutrient turnover rates, affect the competition for and capture of nutrients by plants and soil microorganisms, and also determine the nutrient balance of each component in the rhizosphere microenvironment. Compared with crop systems, the coupling between carbon, nitrogen and phosphorus in grassland is stronger. Therefore, the structure and function of rhizosphere micro-ecosystems play an important role in maintaining nutrient transformation and circulation. Many literature reports indicate that the critical factor that regulates the rhizosphere microenvironment is the key substance of the plant and soil for material exchange and information transmission. The root exudates and rhizosphere exudates are also the key substances that mediate rhizosphere microorganisms and enzyme activities. When the grassland environment changes, the rhizosphere exudates, rhizosphere enzyme activities, and the composition and diversity of rhizosphere soil microorganisms will also change fundamentally, which will cause a change of supply and availability of soil nutrients, and in turn will affect grassland productivity and utilization efficiency of nutrients. So, further research on the regulation mechanism of nutrient cycling in grassland rhizosphere process is very important for revealing the distribution and utilization of nutrients and nutrient exchanges between grassland plants and microorganisms. This article reviews the mechanisms and interactions involving rhizosphere exudates, rhizosphere enzymes, and rhizosphere microorganisms involved in nutrient cycling, summarizes the mechanisms of grassland rhizosphere processes contributing to nutrient cycling and provides a perspective for consideration when formulating future research on rhizosphere microdomains in grassland ecosystems.
草地生态系统是陆地生态系统的重要组成部分, 尤其在土壤养分循环、转化和调控等方面具有重要作用[1]。高寒草甸作为我国面积最大, 分布最广的典型高寒生态系统, 在保护生态环境方面具有重要意义。但由于人类不合理的开垦和利用, 以及草原放牧的不合理, 导致高寒草甸区退化严重。据农业部最新发布的统计结果显示, 我国草地近九成出现了不同程度的退化, 主要退化区位于被称为地球上重要生态环境屏障的高寒地区。高寒地区的草地退化主要表现为草地沙化、形成黑土滩或草地盐碱[2]。一般认为, 草地退化的实质是草地生态系统中能量流动和物质交换失衡导致的[1]。草原不合理的开垦和过度利用是导致草原生态负效应(植被和土壤结构受到破坏, 生产力不断降低, 土壤养分的损耗程度增大)发生的关键[2, 3, 4]。随着高科技手段的使用、众多科研工作者对草地退化研究的不断深入, 认识到草地退化的原因不仅仅是破坏植被和土壤, 同时也是土壤碳的沉积、氮的有效性和可溶性磷的释放等养分物质转化功能的丧失[5, 6, 7]。
草地生态系统包含地上和地下两个相对独立的部分, 它们之间通过强烈的互作性调控草地系统的能量流动和物质转换[1]。而高寒草甸区土壤养分含量较低, 植物根际对土壤养分的截留效应比其他地区更为显著[8]。因此, 根际过程对土壤养分循环和养分的有效性, 对生态关键区域的稳定性至关重要。为解释清楚这个过程, 1904年德国微生物学家Hiltner首次提出了根际这一系统性概念, 根际研究经过一个多世纪的发展, 我国根际专家张福锁把根际概念进行总结和完善, 他对根际的定义是植物、土壤和微生物相互作用的重要界面是养分和有害物质从土壤进入植物体参与食物链物质循环的重要门户和通道, 也是植物和土壤环境之间物质和能量交换的结点[9, 10]。因此, 根际作为植物-土壤-微生物间相互作用的特殊微域, 不同于原位土体, 该部位物质交换十分频繁, 是各种养分物质循环的活跃区域, 同样也是植物生长发育过程中养分吸收和代谢过程的重要场所[9]。在经过一个多世纪对根际的探索和发现, 根际的研究则更具系统性。根际过程不仅是单方向的, 更是一个多维度、庞大的、植物-土壤-微生物间相互影响, 相互制约的系统, 即根际是植物与土壤两个生态系统间相互交叉的系统[10]。我国对根际的研究相比国外而言起步比较晚, 始于80年代初以刘芷宇等为代表的学者。当时根际的大多数研究主要集中在林业和农业等方面, 例如, 农作物间养分的高效利用与调控[11]、植物根际微生物对土壤重金属污染的修复[12], 以及植物根际分泌物对养分转化的影响[13]等方面均有较大突破。我国草业科学在根际研究方面起步晚, 同时草地农业生态系统又有别于森林和农田生态系统。目前对草地退化、干旱荒漠区等通过根际过程转化养分等方面的研究更少。基于上述背景, 本研究综述草地退化过程中植物根际微域(植物-土壤-微生物)互作效应, 即从根际分泌物、根际酶和根际微生物这3个方面探讨草地土壤养分碳氮磷循环的根际生物学过程, 从而为深入探讨恢复退化草地寻求有效研究机理, 为将来在研究草地根际过程方面提供一定的参考依据, 并对今后草地合理利用和防止草地进一步退化提供借鉴作用和科学指导。
根际作为植物-土壤-微生物互作的界面, 是物质循环和能量流动的关键部位, 处于生态系统的核心区域, 探究草地生态系统的根际活动对草地养分循环和转化具有重要作用[14]。目前, 对草地根际过程的相关研究非常少, 其原因主要有以下几点:一、草地根际的研究时间短、技术和手段相比农业和林业方面还有一定距离; 二、草地根际中根系特有的性质是限制深入研究的主要因素, 与研究单一植物种类和明确的农业和林业领域相比, 草业方面所研究的根际更为复杂, 这是因为草地生态系统地下部分根系交织且相互缠绕, 同时地上部分植物种类繁多、结构复杂, 从而导致研究的难度提升; 三、草地生态系统中地下部分活根和死根难以区分的特性也是草地根际研究的难点; 四、草地植物地下部分的根际过程是多种植物间相互作用的结果, 如果对其进行单一的研究将会导致最终研究结果的准确性受到一定程度影响。草地根际过程在研究时还有其他难点。首先, 草地根际研究的大部分是从地下部分的整体性上进行探讨和分析, 但这样将会导致更加精细的根际过程不能被很好地解释。其次, 草地为了适应外界极端环境的变化, 例如高海拔、干旱、阴湿和寒冷等, 使地下部分的根系储存了大量的初级生产能, 从而使地下生物量高于地上生物量, 使地下部分的研究变得更为复杂。再次, 由于人为干扰和放牧等活动, 使草地植物的根系周转过程加速, 从而使部分根系延迟矿化。最后, 草地生态系统中土壤养分的空间和时间异质性, 导致草地根际养分变化在根际这一微环境很难表现出来。综合上述问题, 草地生态系统中植物与土壤、土壤与微生物以及植物与微生物之间的互作性非常复杂, 从而导致草地植物的根际研究具有相当的难度, 但现今随着高通量测序技术等分子技术的不断更新和根际生物化学原位显色法和X射线微区域分析法等可视化技术的不断发展, 研究土壤这一“ 黑箱” 的技术不断进步, 从而提高人们对土壤根际的认知, 为探究草地根际过程提供有力的技术支撑。
根际分泌是植物与土壤环境交流和改变土壤环境的机制, 是在特定环境下, 植物根系通过不同部位将所分泌的物质释放到根际环境的总称[15]。在根毛区和根冠部位根际分泌物的渗出率非常高, 其中植物通过光合所固定的物质有30%通过分泌的方式进入根际[16]。同时, 植物根际分泌物的定性和定量组成由植物品种、种类、植物发育阶段和各种环境因素决定, 包括土壤类型、pH、温度和微生物等。因此, 根际分泌物的数量和质量不仅与植物种类和植株的生长年限有关, 而且与外部环境有密切联系。根际分泌物主要为水、离子、各种酶、粘液以及各种代谢物组成, 以低分子量和高分子量有机化合物的形式释放, 包括糖, 有机酸, 酚类, 氨基酸, 类黄酮, 脂肪酸, 萜类化合物, 生物碱, 生长调节剂, 酶和其他次级代谢产物[9]。所有这些化合物的释放都将会引起根际中物理、化学以及微生物特性的改变, 对适应外部环境的变化、改变微生物群落结构、调节植物对养分利用、螯合养分元素和金属元素等都具有重要作用, 是植物调控根际微生态功能不可缺失的关键节点。
根际分泌物是介导植物-土壤-微生物间互作的核心因子, 同时也是调控根际微环境养分平衡、吸收利用和运转的重要媒介[17]。前期学者从不同植物[番茄(Lycopersicon esculentum)、油菜(Brassica napus)、玉米(Zea mays)、紫花苜蓿(Medicago sativa)、油松(Pinus tabuliformis)等]角度进行研究和验证、总结和归纳了根际分泌物的种类和潜在功能作用。主要包括:1)信号功能。根际分泌物在维持植物与微生物物种间具有重要作用, 能够调控根际微生物种群和数量, 从而调节植物与微生物之间的根际对话。例如, 土壤中丛枝菌根真菌(arbuscular mycorrhizal fungi, AMF)是维持植物健康生长的重要真菌, 但其生长主要靠根际内充当信号分子的分泌物独脚金内酯来介导[18]。植物根系所分泌的黄酮类化合物是参与植物和根瘤菌(Rhizobium)之间信号传导的关键化合物, 它们引发了植物根系的氮固定[19]。2)养分库。植物通过光合作用将大约30%左右的物质通过根际分泌物释放到根际微环境中, 植物根系通过向土壤分泌大量有机物, 产生根际碳沉积现象, 为根际微生物提供主要的碳源和能源物质, 因此根际分泌物能够作为根际土壤的养分库, 为植物提供可被直接吸收的养分。例如, 根际微生物中粘球菌属(Myxococcus)用过同化作用, 实现植物根系与根际土壤间的碳、氮循环[20]。根际碳沉积可以通过相关根际微生物加速土壤有机质的矿化, 从而使根际过程产生正效应, 促进根际土壤养分的可利用性[21]。3)防御保护功能。植物可以通过根部释放的分泌物直接或间接的参与微生物抵抗各种因素的胁迫和干扰, 同时微生物这些的选择由根分泌物中存在的各种有机酸来驱动。例如, 番茄所分泌的物质中, 大多数以有机酸的形式存在, 而这些有机酸能够提高假单胞菌(Pseudomons adaceae)的活性, 使其抵抗根际某些病原微生物, 从而提高植物的抗病能力[22]。当土壤被某些重金属物质污染后, 植物根系通过分泌大量的物质将土壤中的金属物质通过络合、螯合以及沉淀作用, 降低金属物质的有效性, 减少植物对金属物质的吸收, 从而减轻重金属对植物造成的伤害[23]。4)调控土壤化学特性。土壤环境的差异会改变根际分泌物的种类和数量, 分泌物的组成物质大多是有机酸, 因此, 可以影响土壤pH值发生变化。同时, 根际分泌物同样会使土壤团聚体的分布、稳定性、亲水性发生改变。例如, 土壤中有效磷含量很少时, 植物将会分泌一定种类和数量能够活化土壤磷的有机酸, 从而提高根际土壤有效磷含量[24]。
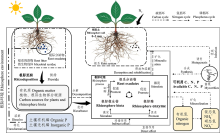
根际分泌物在参与养分循环过程中主要有以下几种方式(图1)。第一、通过根际分泌物介导根际微生物刺激土壤有机质的分解, 从而加速氮素循环。氮是草地生态系统中植物生长的主要限制元素, 而草地土壤中大多数限制性元素多数被土壤有机质锁定, 植物需要通过根际过程分解和解聚有机质, 这一过程主要是植物根系所释放的分泌物通过螯合特性或者刺激微生物的活性来提高植物对养分的可利用性。同时, 植物根系周围CO2浓度高低能够调节根际土壤微生物群落的结构和功能, 达到调控植物对土壤养分的吸收和利用, 这是根际启动效应刺激土壤有机质分解和加速氮循环的重要机制。例如解释草地生态系统中CO2浓度的高低对植物氮获取的研究[25]。第二、植物通过根际碳沉积过程, 加速对土壤有机质矿化来提高养分的循环。植物通过根系释放分泌物形成碳沉积, 之后通过根际微生物提高土壤有机质的矿化进程, 影响根际土壤中养分元素的溶解和吸附, 最终完成根际过程中的碳氮循环, 增加植物对养分的吸收。例如, 高寒草甸地区高强度的放牧策略降低土壤养分碳和氮的转化, 适度放牧提高了土壤养分碳和氮的有效性[26]。第三、根际分泌物通过根际化学作用活化土壤中难溶性的养分元素, 从而调控根际的有效养分。土壤中全磷的含量较多, 但可被植物吸收的有效磷含量很少, 植物根际分泌物通过介导酸碱反应(pH)、氧化还原反应(redox reactions, Eh)和配合反应驱动有机酸阴离子的释放和H+的释放, 引起根际氧化还原电位和pH值的改变, 从而将土壤中难溶性的磷活化为可被利用的磷, 使土壤的磷有效性发生变化, 推动根际中磷素的循环[27, 28]。因此, 根际化学过程改变根际养分的有效性, 而根际养分的变化会反馈调节根系的分泌能力, 进而影响对根际养分的吸收能力。例如, 草原一般位于高海拔和寒冷的地区, 同时草原土壤中氧化还原反应(Eh)的变化主要与根际分泌物有直接关系, 草原植物根系通过释放一定类型的分泌物降低根际微生物的活性, 使根际周围的氧化还原电位下降, 从而提高某些养分的有效性[29]。由此可见, 草原植物的根际分泌物对养分循环具有重要作用。
根际酶是由动植物残体、根际微生物及不同生物分泌释放于根际微环境中的具有催化能力的活性物质, 是土壤中活性最高的有机部分, 是根际过程的主要参与者, 受到植物根际分泌物、土壤环境因子和根际微生物群落等因素的共同支配, 是土壤对植物代谢需求和有效养分的直接表达, 也是土壤环境质量监控的重要指标[30]。在根际微环境中, 植物根系和根际微生物所产生的酶能够改变根际中养分的可用性, 例如C、N、P、S等养分物质的水解, 以及根际酶活性的高低可被解释为土壤根际微生物多样性的丰富和贫瘠[31]。
植物根际微环境中酶主要由两大类组成:一种是由细胞胞质溶胶结合细胞碎片, 为土壤中微生物提供碳、氮等营养物质的胞内酶; 另一种是由植物根系或者根际微生物分泌到根周围环境中, 存在于根际土壤溶液和植物根系表面的胞外酶, 带有特定目的[30]。例如, 参与碳、氮、磷等养分循环转化的水解酶, 保护植物正常生长的氧化还原酶, 参与植物木质素、酚类和腐殖酸等降解的水解酶和氧化还原酶。酶的类型根据其催化反应可分为水解酶、氧化还原酶、裂合酶和转移酶。在草地生态系统中根际酶有两种, 一种是水解酶类, 例如, 参与碳循环的水解酶(内切纤维素酶、纤维二糖水解酶和β -葡萄糖苷酶)、参与氮循环的水解酶(脲酶、蛋白酶、β -1, 4-乙酰-葡糖胺糖苷酶、亮氨酸氨基肽酶)以及参与磷循环的水解酶磷酸酶等; 一种是氧化还原酶类, 例如, 脱氢酶、过氧化物酶、过氧化氢酶和多酚氧化酶等。根际酶中参与养分转化的类型, 其结构和结合的特定化学形式不同, 例如, 根际酶中参与碳循环的主要形式是脂肪族、多糖和芳香族[32]; 参与氮循环的主要形式是酰胺(可以使肽键或非肽键)[33]; 参与磷循环的主要形式是单酯或双酯[34]。同时, 在草地根际微生态的研究中发现, 根际酶的产生方式有以下几个途径:1)植物根部产生的蛋白质通过分泌物向外排出的酶; 2)植物根际微环境中植物-土壤通过根际化学过程产生和积累的酶; 3)根际过程中根际微生物代谢产生的酶[35, 36]。由于根际酶的功能具有多样性和复杂性, 因此, 需要做更深入的研究。
近些年根际土壤酶是研究的热点问题。由于根际胞外酶在介导土壤养分有机质分解和转化方面具有潜在作用, 从而具有影响生物地球化学循环的重要功能(图1)。据研究发现, 根际胞外酶几乎具有靶向地球上所有复杂的聚合物的功能, 包括蛋白质、碳水化合物、氨基糖聚合物、有机酸盐类物质和木质素等[30]。同时, 根际胞外酶的合成受环境底物的可用性、根际微生物群落和微生物生长要求等因素影响[33]。根际酶是土壤中有机物质分解的关键限速步骤, 它的产生能够影响根际微生态中养分的循环和矿化, 调控土壤有机质的分解和土壤理化性质等, 从而对土壤养分和健康起到重要作用。这是根际酶参与调控土壤养分循环重要的机制。
在草地生态系统中, 研究发现C、N和P等参与养分循环的根际酶能够提供对微生物群落、土壤营养物资源的反应和不同养分元素的权重率[30]。例如, Cenini[37]在研究格陵兰草地生态系统中发现, 草地管理的变化显著影响根际胞外酶的活性, 这反过来影响土壤中C、N和P的含量。Makoi等[38]发现, 草地的不同管理方式(围封、放牧、刈割等)对根际分泌物释放的胞外酶非常重要, 能够催化复杂的有机化合物并分解成可溶性底物, 从而介导土壤中的碳和养分循环以及有机质分解和周转。马源等[4]在对高寒草甸退化和放牧下土壤养分的研究中发现, 草地退化程度加剧和放牧压力过大均会导致草地植物根系周围参与C、N和P等养分循环的胞外酶活性显著降低, 影响草地土壤中养分的有效性。Dornbush[39]研究发现, 禾草种类和凋落物的相互作用显著影响土壤β -葡萄糖苷酶, N-乙酰-β 氨基葡萄糖苷酶活性和酸性磷酸酶活性。Rao等[40]在菌根定殖植物的根际土壤中发现植物根部的磷酸酶和植物的磷营养之间存在严格的相关性。因此, 只有了解草地植物的根际过程中根际酶的运行机理和功能, 才能对维护草地健康、恢复退化草地以及保护生态环境提供有力的依据。
根际土壤中栖息着包括放线菌、真菌、细菌、原生动物、藻类等多种微生物, 他们之间形成了一套复杂的交互网络, 参与根际微环境中的能量转化和营养物质的循环过程[41, 42], 这些根际微生物通过驱动土壤中碳、氮、磷等养分循环, 对植物的健康、营养和生产力具有重要作用, 因此又被称为植物的第二套基因组[43]。由于根际微生物是植物生产力和健康的决定因素, 因此根际微生物是地球生物化学循环的核心参与者和主要驱动者。根际微生物生长代谢过程中的养分和能量物质主要受到植物根部释放的光合产物和分泌物影响, 并且与植物种类、数量、生长周期和健康状况有直接关系[44]。例如, 植物光合产物甲醇和异戊二烯, 以及由植物根际分泌物释放形成的根际沉积等, 均是根际微生物碳和能量的潜在来源[45]。
在根际微环境中包含多种微生物形式, 特别是真菌和细菌这两个类群。大量研究表明, 真菌和细菌微生物群体参与重要的根际过程, 这主要是由于根际微生物种类繁多和功能多样。而根际微生物的种类和功能的多样主要受到以下几个方面因素的影响。一、通过植物根系分泌的多种抗微生物化合物(酚类, 萜类和生物碱、糖基化皂苷和活性氧物质), 调控土壤中微生物种群的结构。例如, 黄瓜(Cucumis sativus)产生自毒素对香豆酸, 当其释放到根际时, 改变了细菌群落并增加了病原真菌的数量[46]。燕麦(Avena spp.)和禾本科植物通过根系释放广泛抗真菌的三萜皂苷和抗卵菌, 从而保护植物免受根际病原体的侵害[47]。因此, 植物根部释放的抗微生物剂, 取决于它们的作用机制, 被认为是根际微生物组结构的关键决定因素。二、根际微生物可以通过产生或降解激素或操纵信号级来调节或抑制植物免疫系统, 维持植物健康生长。例如, 通过水杨酸信号激活植物产生系统获得性抗性和茉莉酸甲酯激活植物产生诱导的系统性抗性, 从而在根际产生芽孢杆菌, 淀粉芽孢杆菌和赖氨酸芽孢杆菌等微生物的富集效应[48], 以及促进养分循环和幼苗生长的植物根际促生菌(plant growth promoting rhizobacteria, PGPR)和真菌, 例如, 固氮细菌被认为是PGPR重要的组成成员, 能够将大气中的氮气固定成可被植物所吸收的
根际微生物具体指生活在植物根际周围, 并被植物根际分泌物所影响的一群微生物。在草地生态系统中, 作为重要分解者的微生物, 具有调节土壤养分转化、循环和供应的能力。处于根际微环境中的根际微生物在养分循环和植物生长中具有同样的作用(图1)。研究指出, 根际微生物对土壤养分碳、氮、磷及其他养分元素的活化起到驱动和调控的作用[52]。根际微生物通过特定的分子或信号调节关键的养分循环过程, 主要包括共生固氮过程、非共生固氮过程、增加土壤中磷酸盐和其他养分物质的过程。例如, 根际微生物利用有机物质和土壤化学能, 通过分解过程将不被吸收的养分物质分解为可被利用的营养元素, 并且对土壤有机质进行深加工, 形成更小的颗粒, 从而提高土壤的养分积累[53]。即根际微生物能够通过转化有机质、分解有机氮和溶解有机磷及调控其他化学元素的活化特性, 来驱动土壤养分物质的循环, 提高土壤养分有效性, 为植物的正常生长提供保障。
草地生态系统中, 根际微生物对转化土壤中碳、氮、磷等其他元素具有重要作用。土壤中的碳是微生物群落结构和功能的重要决定因素, 而根际微生物的分解代谢均匀度可以作为土壤有机碳库中(总有机碳、微生物生物量碳和潜在的矿化碳等)微生物多样性的量度[54]。例如, 草地退化和过度放牧对微生物的代谢均匀度具有显著相关性, 这是由于退化和过度放牧会导致植被发生演替、土壤有机碳库的消耗和根系所分泌的物质减少等, 从而导致土壤微生物多样性和微生物群落多样性的下降[55]。反过来思考, 草地根际微生物的降低将会影响土壤有机质的分解速度, 限制了根际微生物对碳的供应。氮素是植物生长的常量元素, 也是大多数草原生态系统中植物生长和生产力的主要限制因素。根际氮素的富集和亏缺对植物生产力和微生物群落产生实质影响。Suding等[56]通过在草原进行施氮试验发现, 土壤中的氮素得到富集并使植物生产力得到提升, 但是通过微生物宏基因组测序和植物地上生物量的调查发现, 这是以微生物群落的丰富度和多样性为代价实现的。Clark等[57]同样指出, 即使相对较低的慢性氮富集水平也会对草原等不同环境的保护构成威胁。这就说明草原施氮在一定程度下能够促进草地土壤的养分贮存和提高生产力, 但这一过程并不能对根际微生物的促进有积极作用。磷素作为限制植物生长的关键元素, 在土壤中含量很多, 但大多数是以不溶状态存在于土壤中, 并且土壤中超过95%的磷素以植酸(肌醇六磷酸盐)的形式存在, 生物利用很差[58]。研究指出, 土壤中AMF和根际细菌可以分泌有机物醋酸盐, 琥珀酸盐, 柠檬酸盐和葡萄糖酸盐等酸类物质, 通过降低根际pH值, 增加磷酸盐矿物质的溶解度, 提高植物对磷素的吸收利用效率[59]。因此, 磷素也可作为根际微生物组的调节因子而存在。Beauregard等[60]通过利用磷脂脂肪酸和变性梯度凝胶电泳技术(denaturing gradient gel electrophoresis, DGGE)等微生物多样性的研究方法, 分析了8年施磷对苜蓿单作土壤微生物多样性的影响发现, P素的应用可改变根际土壤中真菌和细菌群落的结构, 但并未影响物种的丰富度。周恒[61]通过采用分子生物网络模型对不同海拔高寒草原土壤微生物的研究发现, 细菌中的变形菌、酸杆菌、拟杆菌在养分C、N和P的调控具有重要影响。Coolon等[62]通过高通量测序技术研究草原燃烧等人为活动对土壤养分转化的影响发现, 土壤中N和P的富集改变土壤细菌的多样性和丰富度, 该研究对草地的维护和管理具有重要意义, 进一步强调了N和P能够作为草地生态系统中重要的营养调控因子。
根际过程是植物根系、根际微生物以及根际土壤的特征和活动以协调的方式相互作用所发生的复杂过程, 主要由根际分泌物驱动, 同时受到外部非生物因子和生物因子的调控, 也被称为根际效应[63]。植物主要通过根际过程改变土壤的生物地球化学参数(包括营养物质的浓度、土壤污染物、络合或螯合化合物浓度、pH值的变化、氧化还原电位、O2浓度和CO2的局部压力等), 调控根系的生物学功能(如吸收, 呼吸和渗出), 以及介导根际微生物的活动, 从而达到调控植物根系对根际土壤养分物质的吸收和利用[64]。有研究指出, 根际过程有加速和抑制根际土壤养分转化的能力, 从而表现出正效应和负效应, 例如正根际效应能够提高根际土壤有机质4倍左右的矿化能力, 负效应会减少根际有机质一半以上的矿化[65]。同时, 根据Neumann等[66]研究指出, 植物对养分的吸收与植物自身对养分的利用有直接关系, 并且这一过程多发生在植物根际环境中, 相比非根际土壤, 根际土壤中养分的转化和调控更为激烈和敏感, 并且根际过程所截留和转化的营养物质才是可被植物有效利用的实际养分, 例如根际土壤中可被植物吸收的碳、氮和磷等元素。
植物参与的营养元素转化和循环过程不是从单独某一方面进行的, 而是通过植物根系的活动所释放的分泌物、根际微生物调节和根际酶活性调控等综合作用的结果。因此在探究草地根际养分转化方面要从整体出发, 进行综合考量, 才会更加深入的探究根际过程对草原养分的转化和调控的意义。当前, 根际过程中植物根系-根际微生物-根际土壤相互作用对草地根际养分的调控的认识主要受农作物和林木的研究等启发, 如油松[67]和沙棘(Hippophae rhamnoides)[68]等植物根系对根际微环境的扰动, 提高植物根际土壤特性和对养分的有效利用; 玉米[69]、鹰嘴豆(Cicer arietinum)[70]和番茄[71]等作物根系分泌大量有机阴离子, 产生根际酸化现象, 从而调控根际土壤pH值达到转化土壤养分有效吸收的目的; 植物根际微生物能够同化和利用根际分泌物所分泌的碳源, 从而通过根际过程完成土壤养分循环的关键步骤[7]。尽管当前根际过程对土壤养分的调控与转化取得了相当重要的进展, 但是在草地生态系统中根际过程在土壤养分(碳、氮和磷等)转化中的作用机理及其对草地的生态功能依然缺乏足够的了解。因此, 在现在和将来的一段时间内, 深入探究草地根际过程在养分调控和转化等方面的作用, 是关注的核心和重点。
植物为了获得土壤中难以被利用的养分元素, 主要通过根际过程调控根际微生物区系、酶活性, 以及根际分泌物等代谢活动, 从而达到溶解, 矿化以及转化土壤中难溶养分的作用, 因此在根际调控土壤养分转化过程中, 得到以下相关结论:1)植物种类和相关的微生物群落是参与转化养分的主要决定因素; 2)合理的草地管理方式对生物地球化学循环有一定促进作用, 包括根际过程中养分吸收和释放; 3)草地发生退化时能够影响植物根际释放有机物, 从而改变根际环境影响根际微生物利用和转化土壤中的C、N、P循环过程; 4)对于低投入的草原生态系统, 根际过程在氮的循环和调控方面具有重要作用; 5)草原生态系统中根际酶是土壤有机物质分解的重要参与者, 能够影响根际养分循环和矿化, 对草地健康起到重要作用。因此, 在草地生态系统中根际对话在调控草原土壤养分循环、草地养分物质的分配利用, 以及草地养分收益等方面具有重要指导意义。
但当前, 在草地生态系统中对养分循环和转化的根际微生态机制研究仍然缺乏, 导致根际过程与养分调控的关系尚不明确。因此, 在今后的研究中应该侧重于以下几个方面:1)对不同草地类型根际过程的原位区域进行研究。根际过程是普遍存在的现象, 尤其是草原地区, 其复杂的根系结构和外部环境是限制研究草地根际过程的一大障碍, 特别在养分循环和转化方面, 但由于受研究方法限制, 大多数研究只能在实验室中完成。需要加强草原野外观测点试验的探索, 进一步从草原物种水平、群落水平和草地生态系统上揭示草地根际过程的机理。2)探究草地根际过程中碳及氮、磷等养分平衡, 以及植物与微生物间养分收益, 明确根际过程的生态意义。通过探究根际过程揭示植物与微生物间养分物质的获取和分配利用, 从而量化根际过程的生态功能。3)探究全球变化对根际过程的影响。通过探究草地生态系统中温度、海拔和干旱等环境因子对根际过程的响应, 从而明确环境改变对根际过程中养分循环和转化的影响。4)草地根际环境中根际分泌物和根际酶在养分调控和转化方面的动力学问题, 及根际微生物的多样性问题, 可通过功能基因探针, 纳米传感器, 宏基因组学, 蛋白质组学和代谢组学等先进手段进一步探究。目前, 人们对草地根际过程中养分循环和调控的研究相对较浅, 进一步探究其作用机理, 是今后深入探索根际微生态过程的关键。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|
| [66] |
|
| [67] |
|
| [68] |
|
| [69] |
|
| [70] |
|
| [71] |
|