作者简介:赵娟娟(1995-),女,河北沧州人,在读硕士。E-mail: 2980234925@qq.com;张伟涛(1980-),男,河北石家庄人,高级兽医师,本科。E-mail: 403981914@qq.com。
**共同第一作者
本试验旨在研究冬季不同饮水温度对育肥羊生产性能、血液理化指标和养分表观消化率的影响,并通过瘤胃组织的显微观察研究不同饮水温度下瘤胃结构的变化,筛选冬季适宜的育肥羊饮水温度。选择135只体重相近的健康育肥后期羊,随机分成3组:2 ℃水温组、8 ℃水温组和20 ℃水温组,每组设3个重复,每个重复15只羊。试验期为28 d。结果表明:1)与2 ℃水温组比较,饮用8和20 ℃水可使羊的日饮水量显著增加( P<0.05);虽然不同水温组羊的日采食量和日增重均未表现出显著性差异( P>0.05),但饮用20 ℃温水相比2 ℃水显著提高了羊的饲料利用率( P<0.05)。2)从血清理化指标看,血清葡萄糖(GLU)含量各组间差异达到极显著水平( P<0.01),与2 ℃水温组比较,饮用8和20 ℃水显著提高了血清GLU含量,分别比2 ℃组增加了1.39和1.14倍,且20 ℃水显著降低了血清胆固醇含量( P<0.05),血清尿素氮、总蛋白和血清3种内分泌激素(三碘甲状腺原氨酸、甲状腺素和生长激素)含量各组间均未表现出显著性差异( P>0.05)。3)从瘤胃的显微结构可看出,与2和8 ℃水温组比较,饮用20 ℃水显著提高了羊瘤胃乳头长度、宽度及其表面积( P<0.05),且20 ℃水显著降低了瘤胃肌层厚度( P<0.05),提高了黏膜下层厚度( P<0.05),但各组间瘤胃黏膜上皮厚度未表现出显著性差异( P>0.05)。4)随着饮水温度增加,粗脂肪(EE)、中性洗涤纤维(NDF)和磷(P)的表观消化率显著增加( P<0.05),尤其是P和NDF,其他养分表观消化率差异不显著( P>0.05)。可见,育肥羊冬季饮用温水有助于提高其饲料利用率,改善瘤胃功能,并促进营养物质的消化和吸收。
**These authors contributed equally to this work.
The objective of this study was to evaluate the effects drinking water temperature on production performance, apparent digestibility of nutrients and blood biochemical parameters in fattening sheep in winter, and rumen structure was also observed using a microscope. Information on the ideal temperature of drinking water for fattening sheep might well lead to improved production efficiencies through mechanisms such as alleviation of cold stress. A flock of 135 healthy fattening sheep with similar weight were randomly assigned into three groups, with drinking water supplied at 2, 8 and 20 ℃ for the respective groups. Each treatment contained three pens (15 sheep·pen-1). The experiment duration was 28 days. It was found that: 1) Compared with the 2 ℃ group, the 8 and 20 ℃ groups had increased daily water consumption ( P<0.05). Although there was no statistical difference ( P>0.05) in daily feed intake and daily gain between any of the groups, the feed conversion efficiency in the 20 ℃ group was higher than that in 2 ℃ group ( P<0.05). 2) There was a difference ( P<0.01) between groups in the serum glucose (GLU) contents. The GLU content in 8 and 20 ℃ groups was 1.39 and 1.14 times higher, respectively, than that in the 2 ℃ group, and the 20 ℃ group had decreased the serum cholesterol ( P<0.05). The serum urea nitrogen, total protein and serum hormone (triiodothyronine, thyroxine and growth hormone) contents did not differ between groups ( P>0.05). 3) The length, width, and surface area of rumen papilla in the 20 ℃ group were increased ( P<0.05) compared with the 2 and 8 ℃ groups. The group drinking water at 20 ℃ had reduced rumen muscle layer thickness ( P<0.05) and increased submucosal thickness ( P<0.05). However, there was no difference ( P>0.05) in thickness of mucosal epithelium among groups. 4) With increase in drinking water temperature, the apparent digestibility of crude fat, neutral detergent fiber (NDF) and phosphorus (P) increased ( P<0.05), especially P and NDF, while the digestibility of other nutrients did not differ between treatment groups ( P>0.05). The results showed that drinking warm water improved the feed conversion efficiency of fattening sheep. In addition, drinking warm water may improve rumen function and promote the digestion and absorption of nutrients.
冬季气候的寒冷是影响羊健康和生产性能的制约因素, 这已经引起国内外学者的重视, 相关研究多集中于环境温湿度的调控[1, 2]。寒冷气候条件下, 饮用低温冷水也是影响羊健康和生长的重要因素, 但往往被人们所忽视。饮用冷水容易刺激胃肠道, 使肠道的绒毛高度降低, 隐窝深度升高, 从而使肠道形态发育受损, 出现机体免疫力下降、腹泻等症状, 导致饮水摄入量和生长性能降低[3]。近几年有关家畜冬季恒温饮水的研究越来越多, 但多集中于仔猪[3]、奶牛[4, 5]和肉牛[6]的研究。由于羊的集约化养殖起步较晚, 关于羊饮水方面的研究并不多见[7, 8]。据研究[9, 10]报道, 冬季饮用温水可提高断奶仔猪的日增重和饲料利用率, 同时降低仔猪腹泻率。相比单胃家畜, 反刍家畜的消化系统较为复杂, 瘤胃对于整个消化系统意义重大, 而饮水温度直接影响瘤胃内容物的温度, 这可能对瘤胃发酵产生重要影响。一般情况下, 反刍动物瘤胃内容物的正常温度为38~41 ℃。赵广永等[11]采用人工瘤胃模拟饮水温度的研究认为, 反刍家畜饮用40~45 ℃的温水可改善瘤胃的发酵性能, 提高饲料利用率。虽然已有关于饮用温水显著提高肉牛产肉性能[6]和奶牛泌乳性能[4, 5]的文献报道, 但也有研究认为, 冬季饮水温度并非越高效果越好, 这取决于动物品种、年龄、饲养管理以及当地气候等因素。据报道, 奶牛饮用8.5 ℃水比饮用1.5 ℃水产奶量提高8.7%, 但饮用24 ℃温水时产奶量却低于17 ℃温水[12]。范凌霞[13]关于奶山羊的研究认为, 饮用22 ℃温水时产奶性能好于16和28 ℃温水。本试验根据实际生产需求和文献报道, 选择3种饮水温度(自然条件下水槽的水温2 ℃、地下水温8 ℃和高温水20 ℃), 研究不同饮水温度对育肥绵羊生产性能、养分表观消化率和血液理化指标的影响, 并通过显微切片的制作观察不同饮水温度下瘤胃结构的变化, 以期为规模化羊场的健康、高效、安全养殖提供依据。
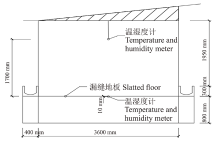
选择河北省石家庄晋州具代表性的规模化育肥羊场, 羊舍建筑形式为敞棚舍, 檐高3.05 m, 跨度3.6 m, 该舍地面为高床水泥漏缝地板, 漏缝地板距地面高度0.8 m。该舍建筑的剖面结构如图1所示。
本试验于2019年1月6日-2月11日在河北省石家庄市某规模化育肥羊场进行。选择品种(小尾寒羊× 内蒙古细毛羊)、日龄[(170± 10) d]、体重[(47.7± 1.5) kg]一致的健康育肥后期羊135只, 采用单因素随机设计, 随机分成3组, 每组3个重复, 每个重复(栏)15只, 每只羊占栏面积1.0 m2。各组羊的饮水温度分别设置为2(低温)、8(中温)和20 ℃(高温)。3种水温设定的依据为:2 ℃为存放于室外水槽内的水温; 8 ℃相当于地下水的温度; 20 ℃是根据文献报道选择对家畜产生显著影响的水温[4, 14, 15, 16]。8和20 ℃水均采用恒温自动上水设备(JSQ24-A, 广东)供给, 该设备配有温度感应器以保持试验所需的饮水温度, 每栏上方设置精确水表。
试验预饲期7 d, 正式期28 d, 全程采用温湿度记录仪(KTH-350-1, 法国)连续检测舍内漏缝地板附近(据漏缝地板1 cm处)和舍内(漏缝地板上1.7 m垂直空间处)的环境温度和相对湿度, 每0.5 h自动记录一次, 温度记录仪悬挂的位置如图1所示。
整个试验期各组羊的日粮和饲养管理完全一致, 日粮组成及营养成分如表1所示。全混合日粮(total mixed ration, TMR)每天饲喂2次, 投料时间为8:00 和16:00, 自由采食, 投喂量根据前一天采食量进行调整, 确保料槽内剩余约10%的饲料; 自由饮水, 每天8:00之前准确读取水表, 记录各栏羊的饮水量。育肥羊出栏后漏缝地板下的粪便以人工清粪方式一次性清除。
| 表1 基础日粮组成及营养水平 Table 1 Composition and nutrients level of the basal diet (dry matter basis) |
饲料和粪样:试验第26~28天连续3 d收集饲料样品和粪样。将精、粗料混合均匀后采用四分法收集饲料样品。粪便收集采用点收粪法, 每栏随机收集5只羊刚刚排出的新鲜粪便, 每只羊收集300 g, 分装两份, 一份加10%盐酸(每100 g粪样+10 mL 10%盐酸)以备测CP含量; 另一份不加酸以备测干物质(dry matter, DM)、EE、粗灰分(crude ash, Ash)、Ca、P、NDF和ADF等养分含量, 上述样品均于-20 ℃保存。
样品检测时, 将所有的粪样和料样置于65 ℃恒温箱烘48 h, 回潮24 h, 粉碎, 100 g粉碎样品过2 mm筛后, 放入封口袋常温保存, 用于检测NDF和ADF含量, 剩余粉碎样品过0.45 mm筛后以备测DM、CP、EE、Ash、Ca和P等养分含量。
血清样品:试验第28天早晨空腹采血, 每组选取6只羊(每栏2只), 前腔静脉采血10 mL, 3000 r· min-1离心15 min, 取上层血清于1.5 mL离心管中, -20 ℃保存待测血液理化指标。
瘤胃组织样品:试验第28天早晨每个试验组选取4只羊进行屠宰, 屠宰后迅速在羊的瘤胃腹囊中间部分取样品, 样品尺寸为2 cm长× 2 cm宽× 2 cm厚, 然后将各组织块周围的食糜用生理盐水冲洗干净, 放入4%多聚甲醛溶液浸泡, 保存于4 ℃冰箱以备瘤胃组织切片的制作。
1.5.1 环境温湿度检测 实验结束后将温湿度记录仪的数据导出, 计算试验期每天各时刻的平均环境温度和相对湿度, 绘制每天舍内和漏缝地板附近的环境温度和湿度的时刻连续变化曲线。
1.5.2 羊生长性能测定 试验初和试验末对各栏羊进行空腹称重, 并记录每天各栏羊的饲喂量、剩余料量和饮水量, 计算试验期羊的平均日增重(average daily gain, ADG)、平均日采食量(average daily feed intake, ADFI)、料重比(ratio of feed to gain, F/G)和平均日饮水量(average daily water consumption, ADW)。
ADG=(每栏羊试验末重-每栏羊试验初重)/试验天数/每栏羊数
ADFI=(每栏羊给料总量-每栏羊剩料总量)/试验天数/每栏羊数
F/G=ADFI/ADG
ADW=每栏羊饮水总量/试验天数/每栏羊数
1.5.3 养分表观消化率测定 各养分表观消化率测定采用内源指示剂方法, 采用酸不溶灰分(acid-insoluble ash, AIA)作为指示剂, 将样品总灰分经盐酸处理后, 过滤、灰化、称量, 测定料样和粪样的AIA含量以及饲料和粪样的各养分含量, 计算各养分的表观消化率, 计算公式如下:
某养分表观消化率=100%-(饲料AIA含量/粪AIA含量)× (粪中该养分含量/饲料中该养分含量)× 100%
饲料和粪样的DM、CP、EE、Ca、P、NDF和ADF参照《饲料分析及饲料质量检测技术》[17]中的方法进行测定。料样和粪样的DM含量测定采用烘干恒重法; CP含量测定应用半自动凯氏定氮仪(Kjeltec 8400, FOSS, 丹麦)采用凯氏定氮法; EE含量测定采用索氏提取法; Ca含量测定采用高锰酸钾法; P含量测定采用钼黄分光光度法; NDF和ADF含量应用半自动纤维仪(ANK-OM A2000i, ANKOM, 美国)采用范氏法测定。
1.5.4 血清理化指标测定 三碘甲状腺原氨酸(triiodothyronine, T3)、甲状腺素(thyroxine, T4)和生长激素(growth hormone, GH)的检测采用BFM-96型多管放射免疫计数器(安徽合肥)进行; 葡萄糖(glucose, GLU)、尿素氮(blood urea nitrogen, BUN)、总蛋白(total protein, TP)和胆固醇(total cholesterol, TC)等指标采用GF-D200型半自动生化分析仪(山东)进行测定。
1.5.5 瘤胃组织切片制作及显微观察 瘤胃组织切片制作采用HE染色法。将固定的样品组织块按照常规组织学方法, 经水洗、70%、85%、95%、100%的乙醇逐级脱水, 然后二甲苯透明、软蜡浸蜡、硬蜡浸蜡、硬蜡包埋等处理后, 在室温下切成4~6 μ m厚的切片, 然后于55 ℃温箱中烘片过夜。染色时先经二甲苯脱蜡10 min, 再用二甲苯酒精溶液脱蜡3 min, 然后于各梯度乙醇(100%、95%、90%、85%、80%、70%)中依次浸泡5 min。脱蜡后的组织块放于苏木精溶液中染色15 min, 冲洗6 min后, 放于0.5%盐酸酒精溶液中快速分化30 s, 再放于0.5%的氨水复蓝30 s, 经梯度乙醇(70%、85%、95%)依次洗脱3 min后, 置于0.5%伊红酒精液染色5 min, 再依次浸入95%乙醇(1 min)、100%乙醇(3 min)、100%乙醇(3 min), 经二甲苯两次透明各7 min, 最后采用中性树胶封片, 自然风干或烘箱烘干, 光学显微镜(4× 10倍)下观察拍照, 并通过Image J 软件对瘤胃乳头、肌层和黏膜下层进行测量。
试验数据先用Excel进行初步处理, 然后采用SPSS 19.0软件对各项试验数据进行单因素方差分析, 差异显著性采用Duncan氏法进行组间多重比较, 以P< 0.05为差异显著, P< 0.01为差异极显著, 数据均以平均值± 标准误(SE)表示。
育肥羊舍的漏缝地板附近和舍内温湿度变化如图2所示。漏缝地板附近(漏缝地板下方1 cm)和舍内(漏缝地板上方1.7 m)的温度范围分别为-5.8~-0.3 ℃(平均-3.3 ℃)和-4.7~2.1 ℃(平均-1.4 ℃), 舍内上下温差范围为1.1~3.1 ℃, 白天舍内上下温差较大, 最高可达2.1 ℃。从舍内上下的相对湿度可看出, 漏缝地板附近和舍内平均湿度分别为51.7%和63.2%, 舍内上下湿差范围为1.5%~22.5%, 白天7:00-21:00湿差较大。
饮水温度对育肥羊的生长性能影响结果如表2所示。从饮水量来看, 8和20 ℃组羊的ADW显著高于2 ℃组(P=0.023; P=0.043), 两组羊的ADW分别比2 ℃组多0.51和0.43 L。虽然不同饮水温度组ADG和ADFI无显著性差异(P> 0.05), 但20 ℃组的ADG表现出高于2和8 ℃组的趋势, 分别比2和8 ℃组高18.15和13.53 g, 而且20 ℃组的F/G显著低于2 ℃组(P=0.039)。
| 表2 饮水温度对育肥羊生产性能的影响 Table 2 Effect of drinking water temperature on production performance of fattening sheep |
饮水温度对育肥羊血清各项理化指标的影响结果如表3所示。血清中T3、T4和GH含量各组间差异不显著(P> 0.05), 但8和20 ℃组的含量略高于2 ℃组。GLU含量各组间达极显著性差异(P=0.002; P=0.015), 8和20 ℃组的GLU含量分别是2 ℃组的1.39和1.14倍。从表3也可看出, TC和BUN与其他理化指标表现的趋势不同, 其随着饮水温度升高呈现降低趋势, 20 ℃组的TC含量显著低于2 ℃组(P=0.012)。
| 表3 饮水温度对育肥羊血清理化指标的影响 Table 3 Effect of drinking water temperature on serum biochemical parameters of fattening sheep |
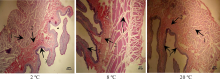
瘤胃组织的显微结构如图3和图4所示。由表4可知, 20 ℃组羊的瘤胃乳头长度(P=0.006; P=0.028)、宽度(P=0.009; P=0.021)和表面积(P=0.033; P=0.045)均显著高于2和8 ℃组, 但2和8 ℃组间上述3个指标均未达到显著性水平(P> 0.05)。20 ℃组的瘤胃肌层厚度显著低于2和8 ℃组(P=0.018; P=0.029), 而瘤胃黏膜下层却显著高于2 ℃组(P=0.011), 各组间黏膜上皮厚度差异不显著(P=0.386)。
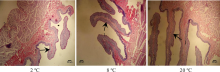 | 图3 不同饮水温度下育肥羊瘤胃乳头结构的显微变化 1.瘤胃乳头 Rumen papilla.Fig.3 Microscopic changes of rumen papilla structure of fattened sheep at different drinking water temperatures (4× 10 times) |
| 表4 饮水温度对育肥羊瘤胃组织结构的影响 Table 4 Effects of drinking water temperature on rumen tissue structure of fattening sheep |
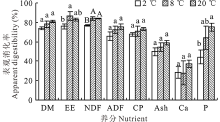
饮水温度对育肥羊养分表观消化率的影响结果如图5所示。从所测的8项养分表观消化率结果可以看出, P、NDF和EE的表观消化率各组间差异均达显著水平(P=0.027; P=0.004; P=0.042), 尤其是P和NDF, 8和20 ℃组的P表观消化率较2 ℃组分别提高了44.7%和69.5%, 而NDF表观消化率8和20 ℃组较2 ℃组均提高了9.0%。其他养分的表观消化率各组间差异不显著(P> 0.05), 但随着饮水温度的升高, 各项养分消化率呈现提高趋势。
冬季低温环境往往造成家畜的冷应激反应, 引起家畜生产性能和健康程度的下降[18]。本研究中育肥羊舍为高床漏缝地板的敞篷舍, 漏缝地板是羊躺卧和生活的地方, 漏缝地板温度的高低直接影响羊的生长和健康, 而漏缝地板附近的环境平均温度仅为-3.3 ℃, 甚至最低达到-5.8 ℃(早上7:00), 舍内上部空间的平均温度也仅有-1.4 ℃, 这种低温的养殖环境势必会对羊的育肥性能产生不良影响。已有研究证明, 冬季提高饮水温度可以缓解低温对家畜的不利影响, 提高其生产和繁殖性能。Nienaber等[19]关于断奶仔猪饮用温水的试验认为, 5 ℃环境温度条件下给仔猪饮用30 ℃温水, 仔猪增重显著提高。李泽强等[3]近期研究也表明, 仔猪饮用30 ℃温水其ADG和F/G均高于13 ℃温水, 且腹泻发生率大大降低。本研究中育肥羊饮用温水虽然没有显著性提高ADG和ADFI, 但显著改善了饲料利用率, 降低了料重比, 尤其是20 ℃饮用温水, 与2 ℃比较, 料重比降低了7.3%, 这与赵广永等[11]和Young[18]的研究结果基本一致。赵广永等[11]通过体外法研究12~50 ℃饮水温度对瘤胃发酵的影响发现, 随着饮水温度升高, 瘤胃发酵效率显著提高, 明显改善了饲料利用效率。
另外, 本研究中饮用8~20 ℃温水显著提高了羊的饮水量, 这与李亮等[8]的研究结果基本一致, 该研究认为, 饮雪水(-13.9 ℃)的羊仅饮维持生命的水量, 饮用井水(1.6 ℃)的羊饮水量消耗了代谢热能, 而饮温水(14.1 ℃)的羊饮水量最多, 消耗代谢热能最少, 而且饮用温水羊的体重下降率、羔羊成活率及产毛量均有所提高。Huuskonen等[5]关于犊牛饮水的研究也表明, 犊牛断奶前将饮水温度从6~8 ℃提高到16~18 ℃时, 犊牛的饮水量明显增加。
血液生理生化指标在某种程度上反映动物机体代谢及生理机能状况。正常代谢条件下, 机体中糖、脂肪、蛋白质处于平衡状态。当家畜受到冷刺激或长期处于寒冷环境中, 家畜需提高产热量以维持体热平衡。通常情况下, GLU可供给机体能量, 当GLU的供能速度无法满足机体需求时会动员体内的蛋白质和脂肪进行分解, 导致血液中TP含量的变化, BUN和TC作为蛋白质和脂肪的代谢产物也会发生相应变化[20]。本研究中育肥羊饮用不同温度水时各项血清理化指标发生了不同程度的变化, 饮水温度为 8和20 ℃时血清GLU和TP含量均高于2 ℃, 说明饮水温度的增加减少了家畜因抵御寒冷而造成的能量损失, 可为家畜的生长提供更多的营养和能量, TP含量的增加从某种程度上说明了饮用温水可改善机体的营养状况, 增强免疫力[20, 21], 有利于羊的健康和生长。本研究也指出, 随着饮水温度的升高, BUN和TC含量呈现下降趋势, BUN和TC分别作为蛋白质和脂肪分解代谢的产物, 其含量高低反映了蛋白和脂肪的分解和利用效率。梁鸿雁等[22]研究发现, 冷应激条件下, 糖和脂肪代谢率下降, 促使蛋白质和氨基酸分解代谢而产生大量尿素, 导致血清BUN含量增加。可见, 育肥羊饮用温水可以促进机体对营养物质的吸收和利用, 缓解低温对羊的不利影响。
T3和T4作为物质和能量代谢的主要内分泌调节激素, 对促进机体的生长发育和组织分化起着重要作用, 并参与神经系统和免疫系统的调节, 其含量增加可以促进糖原异生和肝糖原的合成, 增加体热的产生, 以提高机体对寒冷环境的适应[21]。GH主要促进骨骼、肌肉和器官的生长, 对于畜禽的生长发育起着关键性作用。本研究结果表明, 饮用8~20 ℃的温水可促进育肥羊血清中T3、T4和GH的分泌, 说明饮用温水可以加强羊对寒冷环境的抵抗程度, 有助于羊的生长和健康, 这和本研究其他结果相吻合。
瘤胃是反刍动物重要的消化器官, 瘤胃壁密集的乳头可增加瘤胃壁与内容物的接触面积, 促进营养物质的消化和吸收[23]。瘤胃乳头的长度、宽度、表面积、肌层厚度和上皮厚度是评价反刍动物瘤胃发育程度的重要指标[24]。家畜的饲料和饮水是影响瘤胃发育的直接因素, 近几年饲料刺激瘤胃乳头发育的研究较多[25, 26, 27], 而关于饮水温度影响瘤胃结构的研究较少。Rozsa等[28]和El Ouazzani等[29]的研究表明, 动物胃肠道中存在温度受体, 因此, 胃肠道对温度较为敏感, 饮水温度直接影响胃肠道的发育和功能。本研究结果表明, 育肥羊饮用20 ℃温水显著增加了瘤胃乳头的长度、宽度和表面积, 这表明20 ℃温水改善了瘤胃的形态结构, 有利于羊对营养物质的消化和吸收, 这与本研究中饮用20 ℃水有助于提高羊生长性能和消化性能的结果相一致。瘤胃肌层和黏膜上皮也是影响反刍家畜消化吸收的重要组织结构, 其厚度的变化直接影响家畜的机械和生物学消化过程。本研究中饮用2 ℃冷水的育肥羊瘤胃肌层厚度和黏膜上皮厚度均高于20 ℃温水, 可能是因为瘤胃肌层受冷水的刺激, 强烈收缩, 使瘤胃肌层加厚, 这也是羊对冷环境的一种代偿性反应。
本研究中关于饮用温水影响育肥羊消化性能的结果表明, 20 ℃温水对各种养分的表观消化率均有不同程度的提高, 尤其是NDF和P表观消化率的提高更为显著, 这与20 ℃温水条件下瘤胃乳头长度、宽度和表面积的增加以及瘤胃肌层加厚均有密切关系, 也与本研究中20 ℃饮水提高羊饲料利用率的结果相吻合, 这些均利于羊生产性能的提高。饮用温水改善家畜消化性能的研究在仔猪上也有相关报道[3, 9, 10]。李泽强等[3]的研究表明, 断奶仔猪饮用30 ℃温水有助于缓解冷应激程度, 使胃更加舒张, 减缓胃的排空, 有利于养分在胃肠道中有充足的时间被消化吸收, 从而改善仔猪对CP、EE和Ash的表观消化率。
1)饮用8~20 ℃水提高了育肥羊的饲料利用率, 尤其是20 ℃温水, 显著提高了羊的饲料利用率。
2)饮用8~20 ℃水改善了育肥羊的血液理化性能, 提高了血清GLU含量, 降低了血清胆固醇含量。
3)饮用温水可改变瘤胃的显微组织结构, 增加瘤胃的消化吸收功能。20 ℃温水显著增加了瘤胃乳头长度、宽度及其表面积, 并增加了瘤胃黏膜下层厚度。
4)随着饮水温度增加, EE、NDF和P的表观消化率显著增加, 尤其是P和NDF。
综上所述, 育肥羊冬季饮用温水有助于缓解低温对羊的不利影响, 提高羊的饲料利用率, 改善瘤胃功能, 促进营养物质的消化和吸收。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|