作者简介:段辛乐(1985-),男,河南南阳人,讲师,博士。E-mail: xinleduan@fafu.edu.cn
为探究苜蓿生产过程中使用的杀菌剂对其传粉昆虫意大利蜜蜂(意蜂)的安全性,利用田间推荐使用浓度的菌核净、咪鲜胺和异菌脲处理意大利蜜蜂,分别测定蜜蜂体内3种保护酶:超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和3种解毒酶:羧酸酯酶(CarE)、谷胱甘肽S-转移酶(GSTs)和细胞色素P450(P450)的活性。结果表明,不同浓度的3种杀菌剂均可诱导意蜂SOD和POD活性,其中咪鲜胺1500倍液(0.17 mg·L-1)处理的蜜蜂体内SOD和POD活性最高,分别为对照的1.82和5.40倍。3种杀菌剂对CAT、CarE和GSTs活性表现为低浓度诱导,高浓度抑制,对P450活性表现为抑制作用(咪鲜胺)或者诱导作用(菌核净和异菌脲)。随着处理时间的延长,3种杀菌剂1000倍液(0.40、0.25和0.50 mg·L-1)对意蜂体内3种保护酶的活性总体表现为诱导作用;而对3种解毒酶的影响各异,菌核净对3种解毒酶活性均为先激活后抑制;异菌脲对CarE和GSTs活性表现为先抑制后激活,对P450为诱导作用;咪鲜胺对CarE和GSTs表现为先激活后抑制,对P450表现为随时间逐渐降低的抑制作用。该结果表明意蜂可以通过调节体内保护酶和解毒酶活性,降低杀菌剂的负面影响,但对蜜蜂正常生理和代谢产生了影响。因此在生产中应当谨慎施用杀菌剂,保护蜜蜂安全授粉。
This research aimed to clarify the effects of fungicides applied in Medicago sativa production on the safety of an important pollinating insect, the honeybee ( Apis mellifera), One-day-old adult honeybees were fed a diet containing dimetachlone, prochloraz, iprodione, at a range of concentrations (diluted with water 1:500, 1:1000, 1:1500, 1:2000 and 1:2500) or no fungicide (Control). Subsequently, the activities of three protective enzymes, superoxide dismutase (SOD), guaiacol peroxidase (POD), catalase (CAT), and three detoxifying enzymes, carboxylesterase (CarE), glutathione S-transferase (GST), cytochrome P450 (P450) in the honeybees were measured. It was found that different concentrations of all the three fungicides could induce increased activities of SOD and POD in the honeybees. In particular, treatment with prochloraz solution at the 1:1500 dilution (0.17 mg·L-1) induced a 1.82-fold SOD activity and a 5.40-fold POD activity compared to the Control treatment. All three fungicides showed low concentration induction and high concentration inhibition of CAT, CarE and GST activities, and showed inhibition (prochloraz) or induction (dimetachlone and iprodione) of P450 activity. With extended treatment time, the 1:1000 dilution of all three fungicides (0.40, 0.25 and 0.50 mg·L-1 of dimetachlone, prochloraz, and iprodione, respectively) showed an overall induction effect on the activities of the three protective enzymes in Italian bees, but a variable effect on the activities of detoxifying enzymes. Specifically, dimetachlone initially increased the activities of the three protective enzymes and then inhibited activity after 6 h; iprodione induced P450 activity at all times, but inhibited the activities of CarE and GST in the first 12 h, then induced their activity thereafter; prochloraz elicited a gradual decrease in P450 activity with time, but initially induced then later inhibited the activities of CarE and GST. The results indicate that Italian bees can reduce the negative effects of fungicides by regulating the activities of protective and detoxifying enzymes in their bodies, but the fungicides have an impact on the normal physiology and metabolism of bees, even so. Therefore, care should be taken when applying fungicides to protect bees and ensure their safety while pollinating agricultural crops.
苜蓿(Medicago sativa)营养丰富、适口性好、易消化, 被称为“ 牧草之王” , 是世界农牧业发展中重要的豆科牧草, 也是我国主要的二级蜜源植物[1, 2]。作为典型的虫媒花植物, 苜蓿自花授粉率很低, 通常多依靠蜜蜂及野生蜂等传粉昆虫授粉[3]。意大利蜜蜂(Apis mellifera, 意蜂)人工饲养技术成熟且蜂群数量大, 因此是苜蓿制种及大规模生产的理想授粉蜂种; 其能为在不同土壤类型、种植模式下的苜蓿授粉, 且能显著提高其种子的产量、发芽势和发芽率[3, 4, 5, 6]。病害是苜蓿生产的重要限制因素, 不仅影响苜蓿的产量, 还可降低其饲用价值[7]。化学防治在苜蓿病害的防治过程中起到重要作用, 如多菌灵、菌核净、咪鲜胺和异菌脲等多种杀菌剂被广泛应用于苜蓿褐斑病、霜霉病、白粉病、根腐病等病害的防治[8, 9, 10, 11, 12, 13]。
在农业生产中, 杀菌剂通常施用于开花植物的花期, 此时植物对蜜蜂有较强的吸引力, 因此是蜜蜂等授粉昆虫最常接触的一类农药[14]。与杀虫剂相比, 多数杀菌剂对蜜蜂为低毒, 相对安全[11]。因此在种植业和养蜂业内一致的看法是在植物花期要严禁使用杀虫剂, 对杀菌剂的使用则没有严格要求[13]。但部分杀菌剂与新烟碱类杀虫剂或其他农药结合后, 具有协同增效作用[14], 如氟菌唑、丙环唑使啶虫脒和噻虫啉对意蜂的毒性分别增加244、105倍和1141、559倍[15]。杀菌剂亦可直接影响昆虫的生理和行为[16, 17]。如亚致死剂量的腈菌唑、丙环唑和咪鲜胺能显著降低中华蜜蜂(Apis cerana cerana, 中蜂)单位时间内呼吸率, 且明显降低其飞行力[18]。三唑类杀菌剂能间接导致意蜂线粒体代谢等相关基因的表达水平降低, 导致其飞行和采集能力下降[19]。此外, 部分内吸性杀菌剂被植物吸收后还可引起蜂花粉和花蜜的污染, 导致成蜂和幼虫的慢性中毒, 影响其正常生长发育, 同时残留在蜂箱中的杀菌剂与蜂群病毒之间具有显著相关性, 可引起大量蜜蜂的死亡并导致蜂群崩溃[14, 15, 16, 17, 18, 19]。
作为昆虫体内重要的酶系, 羧酸酯酶(carboxylesterase, CarE)、谷胱甘肽S-转移酶(glutathione S-transferase, GSTs)、细胞色素(cytochrome P450, P450)3种解毒酶和超氧化物歧化酶(superoxide dismutase, SOD)、过氧化物酶(peroxidase, POD)、过氧化氢酶(catalase, CAT)3种保护酶在昆虫适应外界逆境胁迫的过程中起到重要作用[20]。昆虫体内的解毒酶系能够分解代谢农药、植物次生代谢产物等外源毒物, 维持昆虫正常生理生化活动; 保护酶系能有效地清除细胞内的自由基, 使其维持在较低水平, 提高昆虫抵御外界不良条件的能力, 从而减少不良逆境胁迫所造成的危害[20, 21, 22, 23, 24, 25, 26, 27]。苑馨方[28]研究发现咪鲜胺处理能显著提高溪流摇蚊(Chironomus riparius)幼虫SOD、POD和CAT的活性。同样解毒酶通过分解代谢外源有毒物质, 提高昆虫的抗逆能力[20]。张宁[29]通过测定肟菌酯和戊菌唑对斑痣悬茧蜂(Meteorus pulchricornis)解毒酶活性的影响, 发现两种杀菌剂均可抑制CarE的活性, 对GSTs则表现诱导作用。戊唑醇和己唑醇能抑制花翅摇蚊(Chironomus kiinensis)幼虫CAT活性, 而环唑醇则能诱导其活性[30]。王雅珺[18]用亚致死剂量的腈菌唑处理中蜂保育蜂后, 其P450活性显著增强, 而GSTs活性显著下降。王康等[20]发现亚致死浓度多菌灵处理意蜂后, 虽不会导致成蜂急性死亡, 但可诱导其解毒酶P450和CarE活性显著增强, 推测这可能会对蜂群的健康和稳定造成威胁。
蜜蜂授粉是促进苜蓿增产提质的重要措施[1, 2, 6, 13]。由于病虫害防治而大量使用化学农药, 不仅影响作物授粉工作的顺利进行, 甚至破坏农田生态平衡[31]。众多研究认为如果授粉昆虫持续减少, 必定会引发农作物授粉危机, 进而影响全球的作物产量以及生态环境[11, 12, 13, 14, 15, 16, 17, 18, 19, 32]。本研究拟通过测定苜蓿花期常用杀菌剂菌核净、咪鲜胺和异菌脲的田间推荐剂量对意大利蜜蜂解毒酶和保护酶的潜在影响, 从生化水平阐明3种杀菌剂对意大利蜜蜂毒理作用, 评估3种杀菌剂对意大利蜜蜂生理的毒性风险, 为更好地保护蜜蜂为农作物授粉安全和我国农药使用安全性评价提供理论指导。
本试验所需的意大利蜜蜂于2019年5月采自福建农林大学蜂学学院教学蜂场, 共15群, 每个蜂群蜜蜂健康且群势相当。
40%菌核净可湿性粉剂购自浙江斯佩斯植保有限公司; 25%咪鲜胺水乳剂购自江苏辉丰生物农业股份有限公司; 50%异菌脲悬浮剂购自苏州富美实植物保护剂有限公司; 超氧化物歧化酶(SOD)试剂盒、过氧化物酶(POD)试剂盒、过氧化氢酶(CAT)试剂盒、羧酸酯酶(CarE)试剂盒、谷胱甘肽S-转移酶(GSTs)试剂盒均购自苏州科铭生物技术有限公司; 昆虫细胞色素P450(P450)酶联免疫检测试剂盒购自南京建成生物工程研究所; 多功能酶标仪(Infinite 200 PRO, Tecan Co., Ltd., Swiss)。
为模拟杀菌剂田间推荐浓度对意大利蜜蜂的影响, 本研究中采用杀菌剂的田间推荐浓度处理蜜蜂:从试验蜂群中挑选出即将新羽化蜜蜂出房的巢脾置于室内恒温恒湿培养箱[温度(32± 2) ℃, 湿度(50± 2)%, 黑暗条件]中饲养过夜, 12 h后收集新羽化出房的幼蜂置于相同条件的培养箱内饥饿处理2 h。用50%(质量浓度)蔗糖水溶液将菌核净、咪鲜胺和异菌脲稀释500、1000、1500、2000和2500倍。参照王雅珺等[13]用摄入法饲喂刚出房的意大利蜜蜂。对照处理仅饲喂50%的蔗糖溶液, 每个处理3个重复, 每个重复处理30只幼蜂。分别将菌核净、咪鲜胺和异菌脲稀释500、1000、1500、2000和2500倍液, 采用上述方法分别饲喂意大利蜜蜂, 24 h后将存活的意大利蜜蜂置于冰面, 使其麻痹。取出各处理样本中肠, 用玻璃棒赶出中肠内容物, 在15%的氯化钾溶液中漂洗干净后立即用液氮速冻, 放入-80 ℃冰箱保存, 用于P450的酶液制备, 截取整个腹部用于CAT、SOD、POD、CarE和GSTs的酶液制备[33]。
用菌核净、咪鲜胺和异菌脲的1000倍液, 采用上述方法饲喂意大利蜜蜂, 分别在饲喂2、6、12、24和48 h后, 收集各处理存活的意大利蜜蜂, 并将其置于冰面使其麻痹。取出各处理样本中肠, 用玻璃棒赶出中肠内容物, 在15%的氯化钾溶液中漂洗干净后立即用液氮速冻, 放入-80 ℃冰箱保存, 用于P450的酶液制备, 截取整个腹部用于CAT、SOD、POD、CarE和GSTs的酶液制备[33]。
参照靳三省[33]和于彩虹等[34]的方法, 略有改进:在蜜蜂中肠中加入预冷的pH 7.5, 1 mol· L-1 的磷酸缓冲液[含50 mmol· L-1二硫苏糖醇(dithiothreitol, DTT), 50 mmol· L-1苯甲基磺酰氟(phenyl methyl sulfonyl fluoride, PMSF), 1 mmol· L-1乙二胺四乙酸(ethylene diamine tetraacetic acid, EDTA), 10%甘油]冰浴匀浆。4 ℃, 10800 r· min-1离心10 min, 取上清液作为P450测定的粗酶液。取蜜蜂腹部加入预冷的磷酸缓冲液(测CarE时, 磷酸缓冲液为0.04 mol· L-1, pH 7.0, 测GSTs时, pH 6.5, 测POD、SOD和CAT时, pH 7.6), 4 ℃, 10800 r· min-1离心20 min。取上清液作为测定CarE、GSTs、POD、SOD和CAT的粗酶液。按照各保护酶和解毒酶试剂盒说明书中的步骤测定各试验处理组和对照组意蜂样本的酶活, 每处理重复3次。超氧化物歧化酶(SOD)测定方法如下:取96孔板, 将待测酶液与试剂盒中试剂充分混匀后, 室温静置30 min后, 酶标仪测定560 nm下的吸光值。过氧化物酶(POD)和过氧化氢酶(CAT)测定方法如下:取96孔UV板, 将待测酶液与试剂盒中试剂充分混匀后, 分别测定470和240 nm下初始吸光值和1 min后的吸光值。羧酸酯酶(CarE)测定方法如下:取96孔UV板, 将待测酶液与试剂盒中试剂迅速混匀后, 于450 nm测定吸光度变化, 记录10和190 s吸光值。谷胱甘肽S-转移酶(GSTs)测定方法如下:取96孔板, 将待测酶液与试剂盒中试剂迅速混匀后, 于340 nm测定吸光度变化, 记录10和310 s吸光值。细胞色素P450(CYP450)测定方法如下:将粗酶液加入预先包被酶抗体的酶标孔后, 依次加识别抗原和亲和素辣根过氧化物酶(horse radish peroxidase, HRP), 经温育后洗涤。用四甲基联苯胺(tetramethyl benzidine, TMB)染色后成蓝色, 经酸处理后最终形成黄色。测定其在450 nm下的吸光度值。依据各酶活测定说明书中酶活计算公式, 计算各试验处理组和对照组的保护酶和解毒酶的活性。
采用 Microsoft Excel 2013 统计处理试验数据, 其中细胞色素P450数据采用Elisacalc软件拟合标准曲线及数据处理。整理后的数据使用SPSS 22.0中的ANOVA中的 LSD多重比较进行分析, 全部数据均为平均值± 标准误, 以P< 0.05 作为差异显著性标准。
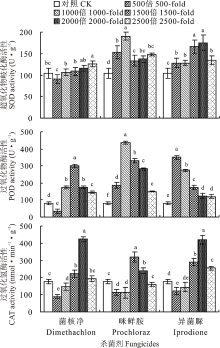
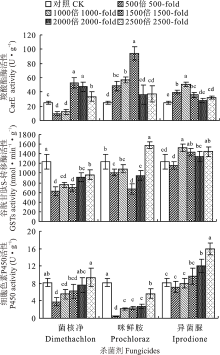
由图1可知, 除菌核净500倍液处理外, 3种杀菌剂的不同浓度对意大利蜜蜂SOD和POD活性均有一定的诱导作用, 其中咪鲜胺1000倍液处理的SOD和POD活性最高, 分别为对照的1.82和5.40倍(P< 0.05)。3种杀菌剂对意大利蜜蜂的CAT活性表现出高浓度抑制, 低浓度诱导。3种杀菌剂的500和1000倍液处理均能抑制意大利蜜蜂的CAT活性, 其中3种杀菌剂500倍液处理的CAT活性仅为对照处理的0.51、0.64和0.69倍。菌核净2000倍液、咪鲜胺1500倍液和异菌脲2000倍液处理的CAT活性显著高于对照处理(P< 0.05), 分别为对照处理的2.39、1.81和2.38倍。
由图2可知, 与对照处理相比, 菌核净的500和1000倍液处理能显著抑制意大利蜜蜂羧酸酯酶的活性(P< 0.05), 而其他杀菌剂的不同浓度处理能够激活羧酸酯酶的活性, 其中咪鲜胺1500倍液处理的羧酸酯酶活性为对照处理的6.76倍。不同浓度的菌核净处理均能显著抑制意大利蜜蜂GSTs的活性(P< 0.05), 咪鲜胺2500倍液处理能显著诱导GSTs活性, 为对照处理的1.27倍。异菌脲500倍液处理能抑制GSTs活性, 而其他浓度处理则能激活GSTs活性。菌核净和异菌脲高浓度(500和1000倍液)处理对P450均表现出抑制作用, 而低浓度对P450具有一定的诱导作用, 两种杀菌剂的2500倍液处理的P450活性分别为对照处理的1.15和1.94倍。咪鲜胺对P450的抑制作用随处理浓度的升高而显著增强(P< 0.05)。
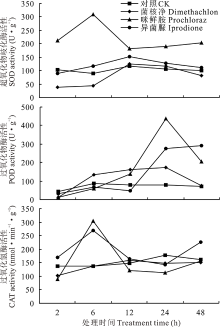
由图3可知, 咪鲜胺能诱导意大利蜜蜂SOD的活性, 在6 h时达到最高值, 为对照处理的3.42倍。菌核净和异菌脲处理后SOD活性呈先上升后下降的趋势, 且均在12 h达到最高值。在前2 h, 各处理的POD活性均低于对照, 但随着时间的增加, 各处理POD活性均有所上升且高于对照。其中, 咪鲜胺对POD的诱导作用强于异菌脲和菌核净处理, 3个处理24 h时POD活性分别为对照处理的5.44、3.44和2.16倍。各杀菌剂处理的CAT活性表现出先上升后下降的趋势, 咪鲜胺和异菌脲处理的CAT活性在第6 h时最高, 分别为对照的2.21和1.96倍。
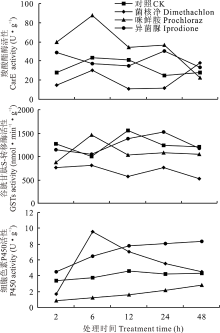
由图4可知, 咪鲜胺处理能够诱导CarE的活性, 在6 h时达到最大值, 为对照处理的2.01倍。菌核净能抑制CarE和GSTs的活性, 但在第48 h时处理组的CarE活性高于对照。异菌脲处理的CarE和GSTs活性呈现先下降后升高的趋势。咪鲜胺处理的GSTs活性呈现先上升, 在第6 h时最强, 随着处理时间延长逐渐下降的趋势。咪鲜胺处理组P450活性在各时间段内均低于对照处理, 表明咪鲜胺对意蜂P450活性为抑制作用; 而菌核净和异菌脲处理则对P450具有诱导作用, 两个处理组的P450活性从6 h开始均高于对照, 但随后活性逐渐下降。
蜜蜂是自然界最重要的授粉昆虫, 全球80%的经济作物依赖蜜蜂授粉, 其对维持生态平衡和促进生物遗传多样性具有重要的经济和生态价值[35]。蜜蜂授粉亦能提高苜蓿的产量和质量, 但多种因素严重影响蜜蜂的生存, 如气候变化、遗传、由于种植模式改变而引起的营养变化、寄生虫和病毒疾病等[11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 36]。其中, 因农药中毒导致蜜蜂死亡、蜂群数量骤减的现象遍及许多国家, 已成为全球普遍关注的环境污染与生物安全问题[37]。
当昆虫受到环境、寄主植物和农药等外源逆境胁迫时, 其体内的保护酶和解毒酶会迅速做出应激反应, 从而维持其正常的生理机能[20, 24, 30, 38]。保护酶能使昆虫体内维持较低的自由基水平, 防止昆虫受到自由基的伤害[24]。王康等[20]研究发现亚致死剂量的多菌灵胁迫对蜜蜂体内SOD的生成起到激活作用, 使得处理组SOD的活力升高。本研究发现3种杀菌剂的田间推荐浓度处理均能显著诱导意大利蜜蜂SOD活性的结果一致, 表明杀菌剂处理能导致蜜蜂体内自由基的积累, 诱导机体的防御机制开启, 提高SOD活性或增加SOD的量, 催化超氧化物生成H2O2和O2, 避免细胞受损。Corona等[39]研究认为蜜蜂体内的SOD活性与蜜蜂寿命正相关, 即酶活性越高, 蜜蜂寿命越长; 同时, 3种杀菌剂低浓度处理亦能诱导POD和CAT的活性, 这两种保护酶能将SOD催化生成的H2O2分解为H2O和O2[25], 保护昆虫免受过氧化物的影响。但3种杀菌剂的500和1000倍液处理抑制意大利蜜蜂CAT的活性, 这可能由于杀菌剂高浓度处理使得活性氧(reactive oxygen species, ROS)产生导致其活性下降或者诱导了其他防御途径[25]。同时, 3种保护酶在时间上存在协调的动态变化关系。杀菌剂处理2~12 h, SOD和CAT的活性迅速增强后逐渐下降, 而POD的活性虽然增长较慢, 但在第24 h时酶活力达到最大值。这主要是由于SOD催化自由基导致细胞内有高浓度H2O2, CAT将高浓度H2O2分解, 而低浓度H2O2则是由POD负责分解, 从而保证机体的生理功能[26]。
作为重要的解毒酶CarE、GSTs和P450, 三者能通过水解、氧化、轭合等反应将昆虫的内源和外源有毒物质分解代谢, 维持昆虫生理平衡[17, 32, 40]。本研究中3种杀菌剂低浓度处理能诱导意蜂CarE的活性, 这与王康等[20]报道的低剂量多菌灵可诱导意蜂CarE活性的影响结果一致。这可能是由于CarE在解毒代谢过程中不需要额外能量, 所以昆虫可通过提高CarE的活性来适应逆境[26]。菌核净和咪鲜胺处理能抑制GSTs和P450的活性, 而异菌脲低浓度处理可激活GSTs和P450的活性, 但其高浓度处理则表现为抑制作用, 这表明不同杀菌剂对意蜂的影响机理可能存在不同, 导致意蜂体内解毒酶在不同时间内起不同的解毒代谢作用。在解毒代谢过程中, CarE和P450主要是在初级代谢起作用, 而GSTs主要在次级代谢中起主要作用, 本研究中杀菌剂处理后3种解毒酶亦存在动态平衡。与对照相比, 异菌脲1000倍液处理的CarE活性为先降后升的趋势, 但其P450和GSTs活性呈逐渐增强的趋势。虽然杀菌剂是通过影响细胞的物质合成、结构、功能、信号传导等基本机制来影响病原菌, 但其还影响昆虫的生长发育、免疫代谢和行为[18, 21, 41]。咪鲜胺可通过抑制麦角甾醇的合成, 而影响菌体细胞膜的功能, 但本研究发现在不同处理浓度或时间上, 咪鲜胺均能显著抑制意蜂P450的活性导致蜜蜂机体损伤。Iwasa等[15]报道咪鲜胺与啶虫脒、噻虫嗪混合使用时, 能显著提高两种杀虫剂的急性毒性, 还可增加蜜蜂感染病原物的风险, 最终导致蜂群崩溃[36, 42]。
目前人们主要关注杀虫剂, 尤其是新烟碱类杀虫剂对蜜蜂的直接和间接影响, 而忽略了杀菌剂对蜜蜂的生理和行为的影响[13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 32, 33, 36, 37, 39, 40, 41, 42]。农药对蜜蜂的急性毒性是评估农药对蜜蜂风险的重要依据, 赵帅等[12]通过测定300个农药制剂对蜜蜂的急性毒性, 发现与杀虫剂相比, 杀菌剂对蜜蜂的毒性较低。这仅是从蜜蜂的死亡率来考虑, 但本研究发现菌核净、咪鲜胺和异菌脲田间推荐浓度对意蜂的生理造成负面影响, 导致其个体的抗逆能力下降。王康等[20]研究发现多菌灵胁迫可显著降低意蜂幼虫蜕皮激素低毒, 提高保幼激素低毒, 导致蜜蜂化蛹延迟。因此在农业生产过程中, 应当全面考虑到杀菌剂对蜜蜂生理和行为的影响, 尽量避免杀菌剂与杀虫剂混合喷施或在较短时间间隔内施用, 保护蜜蜂及其他授粉昆虫为农作物授粉的安全。
苜蓿花期施用咪鲜胺、异菌脲和菌核净田间推荐浓度可对意大利蜜蜂的生理产生负面影响, 对意蜂具有潜在风险性。3种杀菌剂的田间推荐浓度对意蜂的保护酶SOD、POD、CAT和解毒酶CarE、GSTs活性表现为高浓度抑制, 低浓度诱导; 但与对照相比, 咪鲜胺能显著抑制意蜂P450活性。在不同时间段内, 各杀菌剂处理的保护酶和解毒酶处于一种协调变化状态, 进而协同降低杀菌剂对蜜蜂的不良影响。在生产实践中应全面考虑花期施用杀菌剂对蜜蜂等授粉昆虫影响, 将蜜蜂授粉与绿色防控技术相结合, 更好地保护意蜂等授粉昆虫为农作物的授粉安全。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|