作者简介:衣琨(1996-),女,黑龙江大兴安岭人,在读硕士。E-mail: yikun9612@163.com
为了研究植物生长调节剂赤霉素(GA3)和6-苄氨基腺嘌呤(6-BA)对高加索三叶草根蘖芽生长发育及内源激素含量的影响,在不同浓度的GA3(0对照、300、600、900 和1200 mg·L-1)和6-BA(0对照、25、50、100和200 mg·L-1),对其根蘖芽生长后的植株高度、叶片数、叶绿素含量和内源激素含量(地上部分和地下部分)进行测定与分析。结果表明:与对照相比,所有GA3处理均显著增加了株高( P<0.05)。尤其在600 mg·L-1 GA3处理下,平均株高为21.33 cm(高于对照处理4.12倍)。GA3还促进了叶绿素a的合成,最显著效果是在600 mg·L-1 GA3处理下,叶绿素a的浓度为0.92 mg·g-1(高于对照76.92%) ( P<0.05)。GA3对叶绿素b含量无显著影响( P>0.05)。在6-BA所有处理浓度下,株高约为对照处理2.6倍,并且对于叶片数,6-BA处理比GA3处理更敏感,在200 mg·L-1时最多,高于对照2.99倍。 6-BA显著促进了叶绿素a和b的积累( P<0.05)。内源激素含量在整个处理浓度下均显示出对外源激素应用的剂量反应。对于地上植物部分,600 mg·L-1的外源GA3引起内源玉米素(ZT),GA3和生长素(IAA)分别增加约23.84%,55.71%和137.99%,而脱落酸(ABA)减少约44.09%。与对照相比,外源200 mg·L-1 6-BA使内源ZT,GA3和IAA含量分别提高了约293.23%,49.71%和49.84%,而ABA降低了约52.48%。对于地下植物部分,内源激素变化与地上部分植物的响应大致相似,明显不同在于外源同样浓度GA3(600 mg·L-1)和6-BA(200 mg·L-1)处理引起的ABA降低要少(分别为15.15%和28.26%)。总之,600 mg·L-1 GA3和200 mg·L-1 6-BA是促高加索生长发育的最佳浓度。
This study explored the effects of gibberellin (GA3) and 6-benzylaminoadenine (6-BA) plant growth regulator on the growth and endogenous hormone content of rhizome of Caucasian clover. Plant height, leaf number, chlorophyll and endogenous hormone contents (in above and below ground parts of Caucasian clover) were characterized under different concentrations of GA3 (0 control, 300, 600, 900, and 1200 mg·L-1) and 6-BA (0 control, 25, 50, 100 and 200 mg·L-1). All GA3 treatments dramatically increased plant height compared to the control ( P<0.05). Under the 600 mg·L-1 GA3 treatment, mean plant height was 21.33 cm (4.12 times higher than the control treatment). Similar responses were seen at the other GA3 concentrations(300, 900 and 1200 mg·L-1). GA3 also promoted the synthesis of chlorophyll a; the most significant treatment effect was a concentration of 0.92 mg·g-1 (76.92% higher than the control treatment) found in the 600 mg·L-1 GA3 treatment ( P<0.05). GA3 had no significant effect on chlorophyll b content ( P>0.05). Under 6-BA treatment, plant height was approximately 2.6 times that of the control treatment at all concentrations tested, and leaf number was more responsive than in the GA3 treatments, being the highest (2.99 times higher than the control) at 200 mg·L-1 concentration. 6-BA significantly promoted the accumulation of chlorophyll a and b ( P<0.05). In general, endogenous hormone levels showed a dose response to exogenous hormone application across the concentrations tested. For the aboveground plant parts, exogenous GA3 at 600 mg·L-1 elicited increases in zeatin (ZT), GA3 and auxin (IAA) of approximately 23.84%, 55.71% and 137.99%, respectively, and a decrease in abscisic acid (ABA) of approximately 44.09%; while exogenous 6-BA at 200 mg·L-1 increased endogenous ZT, GA3 and IAA levels by approximately 293.23%, 49.71% and 49.83%, respectively, and decreased ABA by approximately 52.48%, compared to control treatments. For the below ground plant parts, endogenous hormone responses were broadly similar to those in above ground parts, except that the ABA decrease from exogenous GA3 (600 mg·L-1) and 6-BA (200 mg·L-1) application was much less (15.15% and 28.26%, respectively). In summary, 600 mg·L-1 GA3 and 200 mg·L-1 6-BA are optimal concentrations for promotion of the growth and development of Caucasian clover.
高加索三叶草(Trifolium ambiguum)为多年生根蘖型豆科植物, 优良的放牧型牧草, 无论是单播还是混播, 均具有较高的产量和饲用价值[1, 2]。高加索三叶草种子发芽率较低, 幼苗生长前期缓慢, 利用种子建植较慢[3], 在实际生产中, 多采用根蘖芽移栽的无性繁殖方法[4]。其可通过发达的地下根蘖进行克隆繁殖, 具有良好的抗旱、抗寒、耐刈割及耐放牧等特性[5, 6]。植物生长调节剂能调节植物的生长和发育, 调控细胞的增殖和分化[7, 8]。不同植物生长调节剂在调节开花时间、叶的形成, 以及在果实的发育中发挥着不同的作用[9]。赤霉素(gibberellin, GA3)可以打破种子休眠, 促进萌发, 在植物生长期间可促进植株高度[10, 11]。研究表明, 在GA3处理下, Memecik橄榄(Canarium album)品种花芽形成期间和所有植物器官(叶, 节和果实)中都增加了脱落酸(abscisic acid, ABA), GA3, 吲哚-3-乙酸(indole-3-acetic acid, IAA)和玉米素(zeatin, ZT)的含量[12]。细胞分裂素6-苄氨基腺嘌呤(6-benzylaminopurine, 6-BA)可增加植物的枝条数, 促进芽的增殖分化, 适宜浓度6-BA可以提高植物的抗逆性[13, 14]。外源6-BA和氮素配合可以提高小麦(Triticum aestivum)内源ZT含量, 降低内源ABA并提高叶绿素a、b含量, 增强叶片光合性能[15]。
前期研究表明, 吲哚丁酸(indole-3-butyric-acid, IBA)和萘乙酸(1-naphthylacetic-acid, NAA)处理高加索三叶草种子可提高发芽率[5], 但施用GA3和6-BA对根蘖芽生长和内源激素含量影响的研究报道较少, 本研究通过对高加索三叶草根蘖芽施用GA3和6-BA两种植物生长调节剂, 观测根蘖芽发育后植株生长情况、叶绿素含量和内源激素含量, 选择促进高加索三叶草根蘖芽生长发育的外源激素种类和浓度, 为高加索三叶草的快速扩繁提供理论基础, 同时对扩大其人工草地栽培面积具有实践意义。
2018年6月5日, 从东北农业大学校内试验田选取健康生长的第二年高加索三叶草地下根蘖芽, 留取地上无叶片部分1~2 cm, 地下根蘖部分4~5 cm。用不同浓度的GA3和6-BA(均购于Sigma公司)进行浸泡(表1), 浸泡时间3 min, 不处理作为对照组, 每组3次重复。将处理好的根蘖芽种植于装有蛭石的花盆中(底径10 cm× 高度15 cm)。 用改良霍格兰营养液浇灌, 放入培养箱中, 光照12 h, 温度(26± 2) ℃; 黑暗12 h, 温度(21± 2) ℃。移栽后第3天再次喷洒对应浓度的激素, 每盆喷洒5 mL, 生长第15天取样进行叶绿素含量和内源激素含量测定。
| 表1 GA3和6-BA处理浓度 Table 1 Treatment concentrations of GA3 and 6-BA |
1.2.1 观测植株生长情况 记录植株初始高度和观测结束时植株高度, 计算植株高度和叶片数量;
植株高度=观测结束时植株高度-初始高度[15]
叶片数量=观测结束时的叶片数量
观测期结束后, 将植株从花盆中取出, 用蒸馏水冲洗干净, 分别剪取高加索三叶草的地上部分(茎和叶)和地下部分(根部), 储存于-80 ℃冰箱中。
1.2.2 叶绿素含量测定 每种处理随机取0.1 g叶片, 3组重复。采用80%丙酮和95%乙醇1∶ 1混合研磨法提取叶绿素, 用紫外光分光光度计在波长663和645 nm下比色[16]。根据Lamber-Beer定律, 叶绿素a、叶绿素b计算方式如下:
叶绿素a含量(mg· g-1)=(12.71A663-2.59A564)V/W× 1000
叶绿素b含量(mg· g-1)=(22.88A645-4.67A663)V/W× 1000
叶绿素总含量(mg· g-1)=叶绿素a含量+叶绿素b含量
式中:A645, A663分别为相应波长下的光密度值, V为提取液的体积, W为叶片质量。
1.2.3 内源激素测定 采用高效液相色谱法(high performance liquid chromatography, HPLC)对高加索三叶草地上和地下部分进行内源激素IAA、GA3、ZT和ABA含量的测定(表2)[17]。
| 表2 色谱条件 Table 2 Chromatographic conditions |
定量方法为外标标准曲线法。标品配置:用流动相将IAA、GA3、ZT和ABA配成1、0.8、0.2、0.05、0.0125 ng· mL-1系列浓度。
分别取植株地上和地下部分1 g置于10 mL 80%预冷甲醇中, 4 ℃冰箱中避光过夜。浸提12 h后加入0.2 g 交联聚乙烯基吡咯烷酮(crosslinked polyvinylpyrrolidone, PVPP)振荡摇晃10 min, 样品4 ℃下离心(5000 r· min-1)15 min, 加入5 mL甲醇再次离心, 重复2次合并上清液, 将上清液用氮气吹干仪进行吹干, 加入pH=3的乙酸乙酯缓冲液萃取3次, 用氮气吹干, 加入1 mL甲醇溶解并过滤0.45 μ m滤膜, 滤液为待测样品。
采用Excel 2016和SPSS 19.0进行统计分析, 采用ANOAN进行单因素方差分析, Duncan’ s法检验其差异显著性(P< 0.05)。
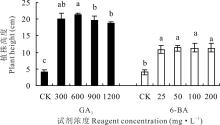
GA3和6-BA处理下的高加索三叶草植株高度均显著高于对照(P< 0.05)。观测结束时, 600 mg· L-1 GA3促进植株生长效果最好, 植株高度显著高于(P< 0.05)其他浓度GA3处理下的植株高度, 为21.33 cm, 与对照相比增加4.12倍。100、200 mg· L-1 6-BA处理下的植株高度均显著高于对照1.68倍(P< 0.05), 为11.17 cm, 不同浓度的6-BA对植株高度无显著影响(P> 0.05)(图1)。
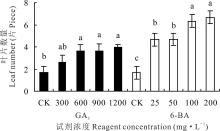
600、900和1200 mg· L-1 GA3处理下, 高加索三叶草根蘖芽生长出的叶片数量均显著高于对照(P< 0.05), 其中1200 mg· L-1 GA3处理下生长出4个叶片, 300 mg· L-1 GA3处理下的叶片数与对照相比, 差异不显著(P> 0.05)。6-BA处理下, 高加索三叶草的叶片数量均显著高于对照(P< 0.05), 200 mg· L-1 6-BA处理下生长叶片数为6.67个, 与对照相比增长2.99倍(图2)。对比两种生长调节剂, 200 mg· L-1 6-BA处理后, 产生的叶片数量最多, 对高加索三叶草根蘖芽生长的促进效果最为明显。
300、600、900 mg· L-1 GA3处理下, 植株叶片中叶绿素a含量都显著高于对照(P< 0.05), 其中600 mg· L-1 GA3处理下叶绿素a含量可达到0.92 mg· g-1, 高于对照76.92%。1200 mg· L-1 GA3处理下叶片叶绿素a与对照相比无显著差异(P> 0.05)。4种浓度的GA3对叶绿素b含量无显著影响(P> 0.05)。GA3处理下植物叶片的叶绿素总量与叶绿素a含量变化一致。叶绿素a和b含量都随着6-BA浓度的增加而增加, 100、200 mg· L-1 6-BA显著促进(P< 0.05)叶绿素a和b含量的增加, 50、100、200 mg· L-1 6-BA显著促进叶绿素总量的增加(P< 0.05)。200 mg· L-1 6-BA 处理下的叶绿素a含量显著高于对照1.13倍(P< 0.05), 叶绿素b含量显著高于对照1.56倍(P< 0.05), 6-BA促进高加索三叶草叶绿素含量的积累更为明显(表3)。
| 表3 不同浓度GA3和6-BA对高加索三叶草叶片的叶绿素含量影响 Table 3 Effects of different concentrations of GA3 and 6-BA on the chlorophyll content of Caucasian clover leaves |
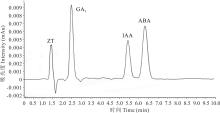
2.4.1 ZT、GA3、IAA和ABA标准样品分离图样 高浓度混合标准样品在高效液相色谱仪进行扫描可以得到图样(图3), 在本试验处理条件下, ZT保留的时间约为1.3 min, GA3保留时间为2.5 min, IAA保留时间为5.5 min, ABA保留时间约为6.5 min。4种样品分离程度较好, 互不影响, 说明此测量方法可取。
2.4.2 不同浓度GA3和6-BA对高加索三叶草地上部分内源激素含量的影响 对于高加索三叶草地上部分, 600、900和1200 mg· L-1 GA3处理使内源ZT含量显著增加(P< 0.05), 900 mg· L-1 GA3处理下, 植株地上部分内源ZT含量可达到185.59 μ g· g-1。不同浓度6-BA处理, 植株内源ZT含量显著增加(P< 0.05), 200 mg· L-1 6-BA处理下, 植株内源ZT含量高达481.99 μ g· g-1, 与对照相比显著增加2.93倍(P< 0.05)(图4A)。
 | 图4 不同浓度GA3和6-BA对高加索三叶草地上部分内源激素含量的影响Fig.4 Effects of different concentrations of GA3 and 6-BA on aboveground endogenous hormones content of Caucasian clover |
内源GA3的含量随GA3处理浓度的升高而显著增加(P< 0.05), 1200 mg· L-1 GA3处理下的地上部分内源GA3含量与对照相比, 增加了73.47%。6-BA处理下, 内源GA3含量与对照相比显著增加(P< 0.05), 尤其是50 mg· L-1 6-BA处理下, 显著高于对照55.44%(P< 0.05)(图4B)。
GA3处理后的植株地上部分内源IAA含量随GA3浓度的升高显著增加(P< 0.05), 1200 mg· L-1 GA3处理过的植株, 内源IAA含量达106.11 μ g· g-1, 与对照相比, 增加了2.34倍。与对照相比, 25 mg· L-1 6-BA处理下, 内源IAA含量无显著增加(P> 0.05), 50、100、200 mg· L-1 6-BA处理的植株内源IAA含量显著高于对照(P< 0.05)(图4C)。
在GA3处理下, 内源ABA含量与对照相比显著降低(P< 0.05), 尤其是600、1200 mg· L-1 GA3处理下的比300、900 mg· L-1 GA3处理下显著降低(P< 0.05), 600 mg· L-1 GA3处理下的植株内源ABA含量最低, 为22.67 μ g· g-1。6-BA处理会使内源ABA含量显著降低(P< 0.05), 尤其是200 mg· L-1处理后的高加索三叶草根蘖芽, 内源ABA含量最低, 为19.27 μ g· g-1(图4D)。
2.4.3 不同浓度GA3和6-BA对高加索三叶草地下部分内源激素含量的影响 对于高加索三叶草地下部分, 300 mg· L-1 GA3对植株内源ZT含量无显著影响(P> 0.05), 600、900、1200 mg· L-1 GA3 处理下的植株, 内源ZT含量与对照相比显著增加(P< 0.05)。6-BA显著促进(P< 0.05)植株内源ZT含量, 200 mg· L-1 6-BA处理过的植株, 内源ZT含量达到最大值516.00 μ g· g-1, 高于对照1.06倍(图5A)。
 | 图5 不同浓度GA3和6-BA对高加索三叶草地下部分内源激素含量的影响Fig.5 Effects of different concentrations of GA3 and 6-BA on underground endogenous hormones content of Caucasian clover |
不同浓度GA3处理下, 内源GA3与对照相比会显著增加(P< 0.05), 1200 mg· L-1 GA3处理下达到最大值869.18 μ g· g-1, 显著高于(P< 0.05)对照2.17倍。与对照相比, 50 mg· L-1 6-BA处理过的植株GA3含量无显著变化(P< 0.05), 其他3种浓度处理下的植株内源GA3含量显著增加(P< 0.05), 其中100 mg· L-1 6-BA处理下的植株达到最大值640.06 μ g· g-1, 高于对照1.34倍(图5B)。
GA3显著促进(P< 0.05)地下部分IAA的含量, 600、1200 mg· L-1 GA3处理过的植株, 内源IAA含量显著高于(P< 0.05) 300、900 mg· L-1 GA3处理, 600 mg· L-1 GA3处理下的植株IAA含量达到249.70 μ g· g-1。25 mg· L-1 6-BA对内源IAA含量无显著影响(P< 0.05), 其他3种浓度处理下的内源IAA含量显著增加(P< 0.05), 200 mg· L-1 6-BA 处理下, 植株内源IAA含量达到最高, 为171.56 μ g· g-1(图5C)。
对于内源ABA含量, 300、900、1200 mg· L-1 GA3处理下植株内源ABA含量无显著变化(P< 0.05), 600 mg· L-1 GA3处理的植株内源ABA显著降低了15.15%(P< 0.05)。25、50、100 mg· L-1 6-BA对高加索三叶草地下部分ABA含量无显著影响(P> 0.05), 200 mg· L-1处理下与其他浓度6-BA处理过的植株及对照相比, 内源ABA含量显著降低(P< 0.05), 为25.99 μ g· g-1(图5D)。
植株高度是决定植物株型的主要因素之一, 主要由茎的伸长决定, 与植物的抗倒伏能力和产量以及能源植物的生物量有密切关系。GA3和6-BA均可以促进高加索三叶草植株的生长, 尤其是GA3, 属于双萜类植物激素, 对茎的伸长和植株高度的增加有重要的调控功能[18]。在本试验中高浓度GA3(900和1200 mg· L-1)处理下的高加索三叶草的植株高度显著低于600 mg· L-1处理过的植株(P< 0.05), 说明过高浓度GA3对植物生长促进作用并不是最佳。促进高加索三叶草高度生长的调控机制可能与水稻(Oryza sativa)茎秆伸长调控机制一致, 促进细胞分裂, 使细胞壁松弛, 从而促进植株生长[19]。100和200 mg· L-1 6-BA处理下, 植株高度相同, 且200 mg· L-1的6-BA可以显著促进高加索三叶草叶片数量, 说明高浓度6-BA(200 mg· L-1)不会使高加索三叶草根蘖芽徒长。李云海等[20]在研究不同浓度6-BA对非洲菊(Gerbera jamesonii)丛芽诱导培养的影响时发现, 0.9 mg· L-1 6-BA浓度培养基的培养作用下, 非洲菊苗丛芽数的增殖最多, 且促进苗丛叶片数的适度增加, 同时又抑制苗丛植株徒长, 保持优良性状。
叶绿素是参与植物光合作用的关键色素, 通过吸收利用光能, 在光合作用过程中起着重要的作用。叶绿素的高低一定程度上代表植物的抗逆性强弱[21]。在高加索三叶草根蘖芽中, 低浓度GA3(600 mg· L-1)处理过的根蘖芽叶绿素a含量最高, 而高浓度GA3(1200mg· L-1)处理下叶绿素a含量无明显增加, 这一结果与邱振鲁等[22]研究6-BA和萘乙酸(1-naphthylacetic acid, NAA)对风信子(Hyacinthus orientalis)花期叶绿素影响的结果大致相同, 低浓度GA3(50和100 mg· L-1)对风信子叶绿素a含量的影响更为明显, 而高浓度下叶绿素含量出现了上下波动, 可能由于叶绿素b较稳定, GA3对叶绿素b没有促进作用。6-BA可促进叶绿素a和b的合成或抑制分解, 不同浓度的6-BA对高加索三叶草叶绿素a、叶绿素b和叶绿素总含量(a+b)促进效果大致相同。此实验的结果与邱振鲁[22]和张国斌等[23]的研究结果一致, 可能与6-BA通过调节叶绿体蛋白基因的表达, 促进叶绿素前体δ -氨基乙酰丙酸的合成有关。另外, 6-BA也可以通过提高超氧物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)及过氧化物酶(peroxidase, POX)延缓叶片衰老[24, 25]。因此, 加入适宜浓度200 mg· L-1 6-BA可以促进高加索三叶草叶片产生叶绿素, 增强高加索三叶草光合作用, 为植物生长提供能量。
植物体内不同激素相互作用, 通过复杂的信号转导路径控制植物生长发育并且应对外界环境胁迫, 从而保证植物正常生长[26]。植物生长调节剂GA3处理后, 高加索三叶草地上部分与地下部分的内源ZT、GA3、和IAA含量都会增加, ABA含量降低, 这一结果与GA3处理兰州百合(LiLium davidii)鳞茎和郁金香(Tulipa gesneriana)中内源激素变化结果一致[27, 28]。研究表明CH3的转录起始位点之前有一个重要的生长素响应序列TGTCTC[30], 随着GA3浓度增加, 内源IAA含量升高, 可能与外源GA3可以使与内源IAA生物合成相关基因CH3表达量上升有关[29], 在研究GA3对胡萝卜(Daucus carota)生长发育的影响时发现, GA3抑制了根系生长, 但促进胡萝卜的枝条生长, 并且会影响胡萝卜ABA、GA3和细胞分裂素(cytokinin, CTK)的相关调控基因的转录水平[31], 下一步可针对GA3如何调控高加索三叶草根蘖芽部发育进行研究。
6-BA作为细胞分裂素可以提高植物的抗逆性, 增加高加索三叶草地上部分ZT、GA3、和IAA的含量, 降低ABA的含量, 这一结果与郑莎莎等[32]研究外源激素对棉花(Anemone vitifolia)主茎叶生理特性影响的结果相同。但对于植株地下部分, 会增加内源GA3和IAA的含量, 但无明显的变化规律, 仅高浓度的200 mg· L-1 6-BA会对内源ABA含量产生显著影响(P< 0.05), 可能是高加索三叶草地下部分对植物生长调节剂6-BA敏感性较低。最新研究表明, 6-BA处理木本植物麻风树(Jatropha curcas)腋芽后, GA3生物合成基因JcGA20oxs和JcGA3ox1的表达会显著增加[33], 这可能是6-BA使内源GA3增加的重要原因之一。200 mg· L-1 6-BA处理后高加索三叶草地下部分ZT含量达到最大, 这可能是此处理下生长叶片数量最多的原因之一, 通过内源ZT提高促进细胞分裂, 使叶片数增加。
600 mg· L-1 GA3处理15 d后的高加索三叶草根蘖芽, 植株高度达到21.33 cm, 叶绿素a的含量显著增加, 地上部分内源IAA含量显著高于对照(P< 0.05)。200 mg· L-1 6-BA处理后高加索三叶草根蘖芽, 叶片数量6.67个, 促进叶绿素a和b的效果较为明显, 无论地上部分还是地下部分, 内源ZT的含量最多, 分别为481.99和516.00 μ g· g-1, ABA含量最少, 为19.27和25.99 μ g· g-1。此试验结果综合表明, 植物生长调节剂600 mg· L-1 GA3和200 mg· L-1 6-BA是促进高加索三叶草根蘖芽生长发育的最佳浓度。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|