作者简介:李淑洁(1980-),女,甘肃临夏人,副研究员,在读博士。E-mail: sjli2005@gsagr.ac.cn
兰州百合(2 n=2 x=24)是重要的“药食同源”植物,进行其种质创新和基因组大小分析对于丰富其种质资源和生物学信息具有重要意义。以兰州百合的种子和试管小鳞茎为试验材料,通过秋水仙素浸泡诱导染色体加倍,经流式细胞仪倍性检测获得的同源四倍体植株分别有10和4株,四倍体诱导率分别为21.11%和33.27%。为了估算兰州百合基因组大小,以小麦品种“中国春”为内标,通过流式细胞仪测算兰州百合二倍体和四倍体植株中的DNA含量,得出兰州百合基因组为64.9 Gbp,是“中国春”核基因组的4倍。
Lanzhou lily ( Lilium davidii var. unicolor, 2 n=2 x=24) is a well-known plant that is used both as food and for medicinal purposes. It is of great significance to breed elite germplasm and estimate its genome size. Autotetraploid induction in Lanzhou lily was accomplished in this study by soaking in different concentrations of colchicine, using seeds and tube-bulbs as the explants. Numbers of autotetraploids identified by flow cytometry assay among the plants derived from colchicine treated seeds and tube-bulbs were 10 and 4, respectively. The tetraploid induction rates were 21.11% for seeds and 33.27% for tube-bulbs. In order to estimate the genome size of Lanzhou lily, Triticum aestivum “Chinese spring” was used as an internal standard. The DNA content of both diploid and tetraploid Lanzhou lily plants was tested by flow cytometry. The genome size of Lanzhou lily was found to be 64.9 Gbp, four times greater than that of T. aestivum “Chinese spring”.
兰州百合(Lilium davidii var. unicolor)是百合科(Liliaceae)百合属(Lilium)野生川百合(L. davidii)的变种, 是我国四大百合品系中唯一可食用的品系。因其兼具一定的药用价值, 被国家卫生部确定为“ 药食同源” 植物, 是甘肃省重要的地理标志产品之一。虽然兰州百合在主产区已有400余年的种植历史, 但受种植品种种群退化的制约, 百合产业面临日趋严重的“ 产量下降和品质下降” 的双重瓶颈。要打破发展瓶颈, 应从产业链的源头着手, 利用现代化的生物工程技术进行兰州百合品种的创新性育种。多倍体育种是培育园艺作物新品种的一个重要途径, 多项研究表明, 同源多倍体较二倍体具有器官增大、次生代谢物浓度增高和环境适应性增强的特性[1, 2, 3, 4, 5, 6]。生产上种植的兰州百合为二倍体(2n=2x=24), 主要收获器官为鳞茎(变态茎), 以无性繁殖方式进行种苗和种球繁育。因此, 人工诱导兰州百合染色体加倍, 有望获得具有高产等优良性状的多倍体材料, 并通过无性繁殖快速应用于大田生产。
多倍体育种已成功应用于花卉百合, 但在以兰州百合为代表的食用百合中的研究较少, 目前兰州百合多倍体诱导常用的外植体有胚性愈伤组织[7]、试管小鳞茎[8]、无菌苗[9]和鳞片[9, 10, 11]4种类型, 以种子为外植体进行的染色体加倍目前尚未见报道。本研究以兰州百合种子和试管小鳞茎为试验材料, 采用秋水仙素诱导染色体加倍, 通过优化体系, 获得兰州百合同源四倍体(以下简称四倍体)植株, 为创制兰州百合新种质奠定基础。
基因组大小(genome size, GS)是指征物种遗传信息的重要指标, 它反映了物种全部的、特定的遗传信息。流式细胞仪和简化基因组测序都可以快速、准确的预估物种基因组大小, 但流式细胞仪预测基因组大小操作更简单、费用更低, 尤其在百合等基因组巨大的植物基因组预测中, 费用低廉的优势更为突出。目前, 百合科/属植物基因组大小已有个别报道[12, 13], 但关于兰州百合基因组大小的研究尚无报道。因此, 本研究以已知基因组大小的小麦(Triticum aestivum)品种“ 中国春” 为内标, 采用流式细胞仪对兰州百合基因组大小进行估算, 这项工作的开展可丰富兰州百合生物学特征资料, 为其基因组测序提供必要的数据参考。
兰州百合种子于2017年7月在兰州市七里河区西果园镇百合试验田采集, 兰州百合脱毒无菌苗为甘肃省农业科学院生物技术研究所实验室保存, 试验于2018年1-12月在甘肃省农业科学院生物技术研究所实验室开展。
1.2.1 外植体准备 采用以下程序进行种子除菌处理:流水冲洗20 min, 70%(v/v)乙醇浸泡1 min, 2% (v/v)NaClO溶液浸泡20 min, 无菌水清洗3次, 无菌滤纸吸干水分。将无菌种子接种到1/2 MS培养基上进行暗培养(23~25 ℃), 待胚萌发时备用。
无菌苗在1/2 MS附加0.25 mg· L-1 3-吲哚丁酸(3-indolebutyric acid, IBA)和 45 g· L-1(w/v)蔗糖的固体培养基上进行膨大生根培养, 以膨大的试管小鳞茎作为外植体。根据小鳞茎的直径大小分为大(直径d≈ 1 cm)、中(0.3 cm< d< 0.5 cm)、小(d< 0.3 cm)3个等级备用。
1.2.2 秋水仙素加倍处理 将刚萌发的种子分别在0.025%、0.050%和0.100% (w/v)3种浓度的秋水仙素溶液中浸泡24 h。处理结束后用无菌水洗3次, 无菌滤纸吸干后在1/2 MS培养基上培养成苗。分别将大、中、小3个等级的无菌小鳞茎在0.100% (w/v)的秋水仙素溶液中浸泡24 h。处理结束后用无菌水洗3次, 无菌滤纸吸干后在不定芽诱导培养基进行25 ℃/20 ℃、16 h/8 h光/暗培养。不定芽诱导培养基配方为MS培养基附加1.0 mg· L-1 6-苄基嘌呤(6-benzyladenine, 6-BA) 和 0.1 mg· L-1萘乙酸(1-naphthaleneacetic acid, NAA)。
以上两种外植体的每个处理各设3次重复, 以蒸馏水为对照。种子四倍体诱导率=四倍体植株数/处理种子数× 100%; 试管小鳞茎变异率=变异的小鳞茎数/处理小鳞茎数× 100%; 试管小鳞茎再生率=再生苗数/变异的小鳞茎数× 100%; 试管小鳞茎四倍体诱导率=四倍体植株数/处理小鳞茎数× 100%。
将1.2.2获得的无菌苗进行流式细胞仪(flow cytometry, FCM; 德国Partec CyFlow Space)倍性检测, 具体步骤参照许蕾等[14]的方法。
采用流式细胞仪进行基因组大小检测, 以普通小麦“ 中国春” 为内标(2C=30.9 pg, GC%=43.7%)[15], 二倍体和四倍体兰州百合各3株作为供试材料, 采用以下方法分别制备二倍体兰州百合细胞核悬液、四倍体兰州百合细胞核悬液、小麦与二倍体兰州百合重量比为1: 1的混合细胞核悬液以及小麦与四倍体兰州百合重量比为1: 1混合细胞核悬液。具体试验方法:1)取新鲜叶片0.5 cm2(1.0 cm× 0.5 cm)置于45 mm 培养皿中, 用刀片将叶片切碎, 吸取Partec CyStain UV Precise P 裂解液400 μ L于叶片周围, 静置10 s提取细胞核; 2)将培养皿中的液体用30 μ m滤网过滤至样品管中, 向样品管中加入Partec CyStain UV Precise P 染液1600 μ L, 染色10 s, 上机测试。每个样品检测至少收集1× 104个细胞, 用Partec CyFlow Space流式细胞仪随机软件Flomax进行数据收集和整理, 变异系数控制在5%以内。
由于处于DNA合成前期(G0/G1期)的细胞还未进行有丝分裂前的DNA合成, 染色体数目未加倍, 因此流式细胞仪以G0/G1期的荧光强度值分析样品DNA含量。测试样品2C DNA含量按以下公式计算:2C=内标样本2C× (待测样本细胞G0/G1期峰的荧光强度值)/(内标样本细胞G0/G1期峰的荧光强度值); 根据Dolezel等[16]用流式细胞仪测定样品C值时, 1 pg DNA=978 Mbp推算, 测试样本基因组大小=978 Mbp× 测试样品1C DNA含量(pg)。
采用SPSS 12.0进行数据统计分析, 以最小显著差异法(LSD 0.05)进行数据显著性分析。
经秋水仙素加倍处理7 d后各处理表型变异无明显差别, 较对照均表现出:下胚轴和子叶膨大变粗、颜色变深且有玻璃化(图1a箭头所指); 部分幼苗的茎基部膨大为一圆端点, 根为褐色, 无伸长生长或生长非常缓慢(图1b箭头所指)。处理组幼苗生长受秋水仙素的抑制, 处理浓度越高生长越慢, 各处理生长速度远低于对照。取各处理1/2的再生株进行倍性检测。
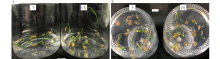 | 图1 兰州百合种子秋水仙素处理后幼苗产生的变异 T为加倍处理组, CK为对照Fig.1 Variation of plantlets derived from cochicine treated seeds of Lanzhou lily T indicated cochicine treated group, CK indicated control. |
刚萌发的种子对0.025%~0.100%秋水仙素具有较强的耐受性, 各处理存活率均为90%以上(表1), 但四倍体诱导率呈现不同的变化趋势:随着秋水仙素浓度从0.025%升高至0.050%, 四倍体诱导率从7.78%升高至17.78%, 二者呈显著性差异; 当秋水仙素浓度从0.050%升高至0.100%时, 四倍体诱导率从17.78%升高至21.11%, 二者在统计学上无显著差异。因此, 以种子为外植体进行染色体加倍时, 考虑到对幼苗生长的影响, 宜用0.050%秋水仙素进行加倍处理。
| 表1 秋水仙素浓度对兰州百合种子四倍体诱导的影响 Table 1 Effects of colchicine concentration on tetraploids induction rate from seeds of Lanzhou lily |
秋水仙素处理7 d后试管小鳞茎的外层鳞片褐化, 表现出秋水仙素伤害。个别小鳞茎中间生长点萌发, 长出宽厚肉质化的幼叶(图2a箭头所指), 个别小鳞茎外层鳞片基部萌发出不定芽或幼叶(图2b箭头所指), 将这些不定芽或叶片切割下来, 接种到不定芽诱导培养基进行培养。在培养过程中一部分叶片逐渐褐化死亡, 一部分分化出不定芽(图2c), 不定芽继续培养获得再生植株, 再生植株进行倍性检测。
大、中、小3个等级的小鳞茎经秋水仙素加倍处理后的变异率、再生苗率和四倍体诱导率存在显著差异, 其中大(d≈ 1cm)的试管小鳞茎作为外植体时变异率和四倍体诱导率最高(分别为40.0%和33.27%), 小(d< 0.3 cm)的试管小鳞茎变异率最低, 仅为8.33%, 其再生苗率和四倍体诱导率也显著低于另两种处理(表2)。因此, 以试管小鳞茎为外植体进行染色体加倍时, 宜选取d≈ 1 cm的试管小鳞茎进行加倍处理。
| 表2 试管小鳞茎为外植体的四倍体诱导 Table 2 Tetraploids induction from tube-bulb of Lanzhou lily |
荧光染料4', 6-二脒基-2-苯基吲哚(4', 6-diamidino-2-phenylindole, DAPI)与双链DNA结合而发出荧光, FCM检测到的荧光强度与细胞DNA含量成正比, 因此, 根据各样本荧光强度之间的比例关系判断倍性。如图3, 横坐标为荧光强度, 纵坐标代表细胞数量, 峰的高低反映了该荧光强度下细胞的数量。对照二倍体在荧光强度为200时细胞数量达到峰值(图3a); 图3b在荧光强度为400时细胞数量达到峰值, 表明其细胞内DNA含量是对照二倍体的2倍, 为四倍体; 图3c细胞数量出现两个峰, 峰值对应荧光强度分别为200和400, 表明其部分细胞内DNA含量是对照二倍体的2倍, 部分细胞内DNA含量与对照相同, 为四倍体和二倍体的嵌合体。
本研究采用了DAPI荧光染料对待测样本和内标小麦的基因组DNA进行了特异染色, 根据荧光强度的大小与所测植物基因组DNA含量成正比进行基因组大小估算。“ 中国春” 的2C DNA含量为30.9 pg, 根据小麦分别与二倍体、四倍体兰州百合重量比为1: 1的混合细胞核悬液的荧光强度计算出二倍体和四倍体兰州百合的2C含量分别为66.36和131.60 pg, 兰州百合基因组初步估算为64.9 Gbp, 是“ 中国春” 小麦15.8 Gbp的4倍(表3)。
| 表3 兰州百合核基因组DNA大小 Table 3 Genome size of Lanzhou lily |
研究发现, 兰州百合种子和试管小鳞茎都有较高的四倍体诱导率。两者相较, 试管小鳞茎四倍体诱导率明显高于种子, 且外植体可在实验室制备、无菌、取材方便、实验不受季节限制。而种子为外植体有以下特点:1)无不定芽诱导、再生等组织培养环节, 避免了组织培养相关因素对四倍体诱导率的影响, 周期短; 2)兰州百合自交不亲和, 异交结实率达40%[17], 因此以种子为外植体获得的四倍体群体具有很高的异质性, 有利于种质创新; 3)由于兰州百合种子的质量(有胚种子或发芽率)和数量受其生物学特性和生长环境等不可控因素影响, 所以种子作为外植体可能存在试验材料不能充足供应的问题。
多倍体诱导率是衡量加倍效率的重要指标。研究发现, 不同文献中采用的方法不尽相同, 主要有以下两种统计方法:一为获得的多倍体植株数占总获得植株(多倍体和二倍体植株)的比例, 即获得100个植株中多倍体植株数量; 二为多倍体植株数占总处理外植体数的比例, 即加倍处理100个外植体获得的多倍体植株数量。Tang等[18]、Xu等[19]、孙红梅等[20]在泡桐(Paulownia tomentosa)、杨树(Populus)和百合四倍体诱导率统计时采用方法一进行计算, 张锡庆等[21]、杨英杰等[22]、张俊芳等[23]在百合多倍体诱导体系中以方法二进行计算。本研究认为, 方法二以最初处理的外植体数为分母, 反映了诱导剂处理后外植体存活率、再生率等指标对多倍体诱导的影响, 能在更大程度上反映该物种或方法多倍体诱导的效率。所以本研究中四倍体诱导率采用方法二进行统计。
基因组大小(C值)是物种单倍体细胞核所含的DNA量, 与物种的倍性水平无关[24]。目前, 大量植物的基因组大小通过流式细胞仪被测定, 并且建立了专门的C值数据库(http://data.kew.org/cvalues/), 其中记录的唯一的百合科植物贝母(Fritillaria)的基因组大小约43.8 Gbp(C=44.8 pg)。百合属植物是百合科下的一种非常重要的多年生草本球茎植物, 该属植物基因组巨大, 不同种植物基因组大小差异也大。Du等[12]用流式细胞术测定了25个百合属植物的基因组大小, 所测植物中最小的基因组为钟花组(Sect. Lophophorum)的紫花百合(L. souliei), C=44.88 pg (约43.9 Gbp), 最大的基因组为根茎组(Sect. Pseudolirium)的格雷百合(L. grayi), C=167.58 pg (约163.9 Gbp)。兰州百合根据comber分类属于卷瓣组(Sect. Sinomartagon)[12], 本研究测算出兰州百合基因组为64.9 Gbp, 基因组大小居于紫花百合和格雷百合之间。本研究对兰州百合基因组大小的测定将为后续兰州百合分子生物学研究、起源和进化研究奠定基础。
以兰州百合的种子和试管小鳞茎作为外植体, 用秋水仙素诱导染色体加倍。经流式细胞仪倍性检测, 分别获得种子和试管小鳞茎来源的四倍体植株10和4株, 四倍体诱导率分别为21.11%和33.27%。以小麦品种“ 中国春” 为内标, 用流式细胞术首次进行了兰州百合基因组大小的测算, 初步估算出兰州百合基因组为64.9 Gbp, 是“ 中国春” 基因组的4倍。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|




