作者简介:宋家兴(1992-),男,山东郓城人,在读硕士。E-mail: 744308823@qq.com
新疆各地区无芒雀麦种质资源丰富,为选择理想倍性育种材料,本研究以18份无芒雀麦为供试材料,用醋酸洋红染色法统计奇台野生无芒雀麦BL-01根尖染色体数目为28条,依据染色体组基数是7,确定其为四倍体(2 n=4 x=28)。运用流式细胞仪以奇台BL-01材料叶片的相对核DNA含量峰值为参照,测定18份供试材料的G1期、S期和G2期及变异系数,计算出各材料的细胞周期值,旨在快速鉴定无芒雀麦不同群体的染色体倍性。研究结果表明,18份无芒雀麦种质材料中有四倍体和八倍体两种倍性,其中四倍体共12份、八倍体共6份,对品种乌苏1号流式细胞仪鉴定结果为八倍体。
There are abundant Bromus inermis germplasm resources in Xinjiang Province, China. In order to select breeding materials with compatible ploidy levels, 18 accessions of B. inermis were collected from different localities. The chromosome number was microscopically determined as 28, using acetic acid magenta staining of root tip samples in a wild B. inermis accession (BL-01) from Qitai. As the basic chromosome number of B. inermis is 7, BL-01 was determined to be tetraploid (2 n=4 x=28). In order to quickly identify the ploidy level of other populations of B. inermis, flow cytometry was employed, and the peak value of relative nuclear DNA content in the leaves of BL-01 was used as reference. The G1, S and G2 phases and variation coefficients of the 18 accessions were used to calculate the cell cycle values of each. It was found that there were 12 tetraploid and 6 octaploid accessions (one of the Octaploids being ‘Wusu No.1’) among the 18 accessions tested.
禾本科(Gramineae)雀麦属(Bromus)植物约有百余种, 为一年生或多年生草本, 该属植物适应性广, 抗逆性强, 具有重要的经济和生态价值[1]。无芒雀麦(Bromus inermis)属于禾本科雀麦属, 其野生类型广泛分布于我国的东北、华北、西北等地区[2, 3, 4]。无芒雀麦叶量大、适口性好, 营养丰富, 各种家畜均喜食, 可刈割晒制干草, 也可放牧利用。与紫花苜蓿(Medicago sativa)混播, 可以提供优质干草和放牧草地, 显著提高家畜的产量和质量[5]。其地下根茎发达, 易结成草皮, 也是一种很好的绿化和水土保持植物, 在生态建设、植被恢复等方面也具有重要作用[6]。染色体是生命遗传物质存在的特定形式, 数目和形态均可作为稳定的细胞学特征用于评估物种的遗传多样性, 也可以用来研究植物染色体形态结构和功能, 物种演化和分类等[7, 8, 9]。对染色体组型分析是植物染色体倍性鉴定的传统方法, 染色体制片时对植物取材时间、部位、染色处理等技术环节要求高, 表现出明显的局限性。
流式细胞术(flow cytometry, FCM)可以定量测定某一细胞中的DNA、RNA或某种特异蛋白的含量, 以及细胞群体中如上成分含量有差异的细胞数量[10, 11]。流式细胞术不受植物取材时间、部位和植株所处时期的限制, 制样简单, 灵敏度、分辨率及准确性较高, 数据可重复性好, 测试速度快, 并且DNA含量变异可在分布图上直观地表现出来, 特别适用于样品较多的倍性监测分析[12, 13, 14]。目前, 流式细胞仪快速检测植物倍性研究已经在芒属植物[15]、蒙古冰草(Agropyron mongolicum)[16]、鸭茅(Dactylis glomerata)[17, 18]和苜蓿[19]等植物上使用, 但对无芒雀麦流式细胞术测定还未有研究报道。根据无芒雀麦染色体数目, 天山北坡野生无芒雀麦包括四倍体(2n=4x=28)、六倍体(2n=6x=42)和八倍体(2n=8x=56), 其中自然界多为四倍体和六倍体, 对品种新雀1号(B. inermis Xinque No.1)染色体倍性鉴定为八倍体(2n=8x=56)[20, 21]。本研究以新疆不同地区的无芒雀麦群体为研究材料, 在已知倍性材料的基础上, 运用流式细胞仪测定不同种质无芒雀麦染色体倍性, 旨在为流式细胞仪快速鉴定雀麦属牧草样品倍性提供技术支持, 同时也为了解新疆不同地区无芒雀麦群体染色体倍性水平, 为育种提供基础。
供试无芒雀麦种质材料共计18份, 于2018年8-9月采自新疆各地(如表1), 材料BL-18为无芒雀麦育成品种乌苏1号(B. inermis Wusu No.1)。将试验材料在光照培养箱中发芽和育苗。各材料选取100粒种子, 在光照培养箱内(型号:PGX-600A-12HM)发芽条件为26 ℃/16 ℃(光照/黑暗, 8 h/16 h)进行纸上萌发培养。流式细胞仪检测材料用长× 宽为540 mm× 280 mm的32孔育苗穴盘中育苗, 每份材料播10孔, 待幼苗株高8~10 cm时, 用于流式细胞仪测定。
| 表1 无芒雀麦种质来源 Table 1 B. inermis germplasm source |
1.2.1 植物根尖压片 随机选取光照培养箱发芽种子10粒, 通过根尖压片醋酸洋红染色法[22]进行根尖染色体计数。取萌发种子根尖0.5 cm大小的材料, 在4 ℃冰箱放置24 h后, 转入卡诺固定液(甲醇∶ 冰醋酸=3∶ 1)固定24 h, 用蒸馏水冲洗3次后放入1 mol· L-1 HCl溶液中, 60 ℃水浴15 min后, 蒸馏水冲洗, 用醋酸洋红溶液染色15 min, 压片法制片, 奥林巴斯BX-41显微镜镜检、拍照。
1.2.2 流式细胞仪检测方法 材料在光照培养箱内用育苗穴盘育苗, 运用流式细胞仪进一步确定这10株染色体计数后的染色体倍性水平。具体的操作步骤参照CyStainR UV Precise P试剂盒使用方法, 取供试材料的新鲜嫩叶约0.5 cm2放入已加入1 mL细胞核提取液的培养皿中, 用保险刀片切碎, 避光静置5 min, 再加入2 mL染色液, 用50 μ m细胞过滤器过滤, 收集滤液, 倒去上清液, 通过CyFlowR space流式细胞仪对其进行检测。检测中, 用已确定染色体数目的BL-01为对照材料调整流式细胞仪的主峰位于100道附近, 结果图示当中, 100道和200道附近的峰显示相对细胞核DNA含量。然后以这个已经确定染色体倍性的单株为对照材料对其他供试材料进行流式细胞仪检测。每份材料随机选取10个单株进行流式细胞仪检测, 并记录细胞分裂各时期的检测值和变异系数, 所得数据用FloMaX软件进行分析。
基因组大小又称C值(C-value), 是指生物体的单倍体基因组所含的DNA总量[11, 23]。流式细胞仪检测结果依据柳青慕等[17]利用流式细胞仪快速检测鸭茅与多花黑麦草(Lolium multiflorum)染色体倍性的研究, 计算出每个供试样本的周期值(cycle value)。当计算周期值大于0.1, 则可认为这一植物样本是混倍体或内源多倍体(endoployploidy), 即该植物器官是由多种不同倍性水平的细胞构成[24, 25]。细胞周期计算公式如下:
Cycle value=
式中:N2C、N4C、N8C、…、NXC分别为核相对DNA含量2C、4C、8C、…、XC的细胞核数。
对无芒雀麦BL-01材料的根尖细胞染色体进行计数, 并依据无芒雀麦染色体基数为7, 结果显示, 无芒雀麦(BL-01)为四倍体, 即2n=4x=28(图1)。以根尖细胞压片法确定为四倍体的无芒雀麦材料(BL-01)为参照, 将其叶片流式细胞仪检测结果主峰校正在100道, 以此对照样品的相对核DNA含量分别为4C和8C检测值(图2)。此外, 无芒雀麦BL-01材料在200道附近有核相对DNA含量8C的细胞存在, 而对照材料供试样品的DNA复制周期值均小于0.1(表2), 表明不存在内源多倍体现象。
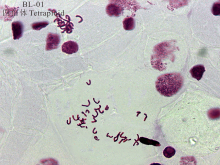 | 图1 BL-01无芒雀麦根尖染色体统计 放大倍数为20× 100。Fig.1 BL-01 B. inermis root tip chromosome statistics Magnification times 20× 100. |
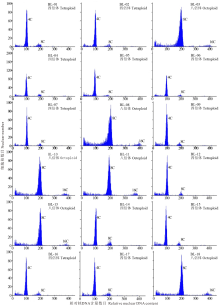 | 图2 无芒雀麦流式细胞仪检测值 4C、8C和16C分别代表相对核DNA含量数目。Fig.2 Flow cytometry values from B. inermis 4C、8C and 16C represent relative nuclear DNA content number. |
| 表2 供试样品的周期值 Table 2 Cycle values of tested materials |
以无芒雀麦材料BL-01(图2)为对照经流式细胞仪检测的17份无芒雀麦材料中, BL-02、BL-04、BL-05、BL-06、BL-07、BL-09、BL-12、BL-14、BL-15、BL-16和BL-17共11份材料的流式细胞仪检测结果都出现了位于100道附近的主峰和200道附近的侧峰(图2), 而材料BL-03、BL-08、BL-10、BL-11、BL-13和BL-18检测结果显示主峰位于200道和侧峰位于400道附近, 表明叶片中存在4C、8C和16C相对核DNA含量的3种细胞。17份无芒雀麦倍性检测结果中材料BL-09的周期值均大于0.1(表2), 而BL-03、BL-08、BL-14和BL-18材料各有1份材料周期值大于0.1, BL-07、BL-13和BL-16各有2份周期值大于0.1, BL-02和BL-10材料各有3份周期值大于0.1, BL-04和BL-06有4份材料周期值大于0.1, BL-11和BL-12检测周期值分别有8和6份大于0.1(表2), 表明它们的叶片细胞中存在内源多倍体现象。因为被检测样本位于主峰区段的检测细胞数远远大于侧峰区段, 材料BL-05、BL-15和BL-17流式细胞检测结果主峰和侧峰分别在100道和200道(图2), 供试样品周期检测值都低于0.1(表2), 没有检测出叶片细胞中内源多倍体现象, 细胞分裂时期G1期检测结果均不低于85%(表3), 可以确定BL-05、BL-15和BL-17材料为四倍体。BL-18材料为商品种乌苏1号, 从流式细胞检测结果得出主峰位于200道处、侧峰位于400道处(图2), 细胞分裂时期G1期检测值不低于90%(表3), 可以确定为八倍体。因此, 确定BL-02、BL-04、BL-05、BL-06、BL-07、BL-09、BL-12、BL-14、BL-15、BL-16和BL-17共11份材料均为四倍体, 材料BL-03、BL-08、BL-10、BL-11、BL-13和BL-18为八倍体。
| 表3 流式细胞仪检测细胞分裂间期及变异系数 Table 3 Coefficient of variation values and cell division interval of tested samples by flow cytometry |
分生细胞从一次分裂结束至下一次分裂结束完成一个细胞周期, 其包括分裂间期和有丝分裂两个过程, 细胞分裂间期是真核细胞进行有丝分裂或减数分裂的准备时期, 分为DNA复制前期(G1期)、DNA复制期(S期)和DNA复制完成到有丝分裂开始之前的G2期。18份无芒雀麦检测处于G1期的细胞, 最高是青河县材料BL-17为93.97%, 本材料收集于低缓丘陵的河道旁, 生境水分充足光照强; 最低是乌鲁木齐县的材料BL-09为83.51%, 本材料生境为低山草地树林带; 处于G2期的细胞均低于16%, 最大是BL-09为15.71%, 最小是BL-17为4.31%。流式细胞仪检测结果G1期变异系数最高为BL-03为6.83%, 最低是BL-06为3.40%; G2期变异系数最高是BL-03为5.45%, 最低是BL-05为2.69%。从变异系数分析, 倍性高的材料如BL-03、BL-08、BL-10、BL-11、BL-13和BL-18的G1、G2期的变异系数与材料BL-01、BL-02、BL-04等12份材料的G1、G2期的变异系数相比较, 结果为倍性高的材料变异系数相对较大。
流式细胞术是一种快速、简单的植物倍性检测方法, 不受材料部位和细胞所处时期的限制, 不影响植物正常发育生长, 也不需要过多的处理步骤就可以进行大批量的样本检测[26, 27, 28]。Georgive等[29]认为流式细胞仪检测的变异系数在9%以内, 其检测结果就比较可靠。本研究的检测结果变异系数只有BL-03材料G1期大于6%、G2期大于5%, 其余材料G1和G2期均小于5%, 说明利用流式细胞仪快速检测无芒雀麦叶片细胞中的染色体倍性是可行的。
通过流式细胞仪检测植物倍性研究表明, 同一植物物种中倍性高的材料变异系数大于倍性低的[28]。在本研究中, 无芒雀麦八倍体材料变异系数大于四倍体材料, 与Loureiro等[28]研究流式细胞仪快速检测鸭茅和多花黑麦草染色体倍性四倍体材料变异系数大于二倍体材料一致[17]。究其原因, 流式细胞仪检测植物染色体倍性的试验中常常会有细胞碎裂留下的杂质碎片, 杂质碎片过多会影响出峰效果, 而且高倍性植物材料的细胞体积较大、细胞内含物相对较多, 在细胞核提取的过程中混入的细胞碎片和杂质多于低倍性的植物材料, 从而导致检测结果变异系数大[13, 26]。
在本次流式检测结果分布图中发现DNA峰值的位置发生偏移, 故称为偏峰现象。偏峰现象是流式细胞仪检测过程中的一种常见现象, 一方面是样本经荧光染色后放置的时间过长就会导致偏峰现象的出现, 而这种现象可通过样本的重复检测和缩短荧光染色后放置的时间来消除[29, 30]; 另一方面是随着叶龄的增长, 细胞内含物比较多, 叶片比较老和硬化程度比较高, 不易快速切碎, 产生的杂质比较多, 这些因素导致峰值发生偏移[26, 31]。为消除或降低偏峰现象的发生, 本实验选择幼嫩叶片, 采用对照样品与待测样品同时间分开检测的方法, 在每检测10个样品后, 重新用对照样品调整参数及峰位。当被检测样品的峰位偏移过多, 经过多次重复检测及重新调整对照样品峰位也不能消除时, 则说明检测结果的差异来自被检测样品的倍性差异。
内源多倍体在自然界中分布广泛, 多数分布于种子植物, 是植物细胞进行核内复制时, 核内DNA不断合成而细胞不分裂所形成的, 这种现象常见在植物体细胞分化过程中[25, 32]。内源多倍体在植物进化中有重要的作用, 也是倍性育种、植物品质改良的重要途径[35]。在一个物种中内源多倍体倍性也反映了其生长发育过程对环境的适应能力[33]。内源多倍体现象在不同植物器官中发生的概率不同, 与植物的种类有关[34, 35]。根据无外界环境影响下, 同时间内同一器官中活化分裂期细胞的百分含量来定义细胞周期值, 利用流式细胞仪的检测结果计算相应的周期值可以在一定程度上衡量内源多倍体在植物器官中的发生概率[36, 37]。
本实验细胞周期值结果中(表2), 来自昭苏县的BL-11八倍体材料细胞周期值相对高于其他材料, 说明BL-11材料叶片中可能存在不同倍性的细胞, 即具有内源多倍体现象。从倍性鉴定结果与种质来源结合分析, 6份八倍体无芒雀麦材料, 其中BL-03、BL-08、BL-10、BL-11和BL-13生境基本为草甸植被, 与乌苏1号无芒雀麦材料倍性基本一致, 这有可能是20世纪末期新疆大面积草场补播的草种, 从植株外观和种子形态来看基本符合高倍性材料。然而材料BL-01、BL-02、BL-04、BL-05 等12份生境基本为田间地头和低缓丘陵草场, 通过流式细胞仪鉴定倍性基本为四倍体, 相比八倍体这些材料植株细瘦, 种子小且不饱满。根据种质采集海拔分析, 6份八倍体材料中最高海拔在2090 m, 最低海拔1180 m; 12份四倍体无芒雀麦材料最高海拔在2033 m, 最低海拔在890 m。
本研究以18份无芒雀麦为供试材料, 经流式细胞仪检测结果表明, 无芒雀麦种质材料BL-01、BL-02、BL-04、BL-05、BL-06、BL-07、BL-09、BL-12、BL-14、BL-15、BL-16和BL-17共12份为四倍体; BL-03、BL-08、BL-10、BL-11、BL-13和BL-18共6份为八倍体。本研究还需要对筛选的不同倍性的材料进行田间表型观测, 为无芒雀麦选育优良品种奠定基础。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|


