作者简介:李柯(1994-),女,湖北荆门人,在读硕士。E-mail: 2016804231@njau.edu.cn
采用盆栽控水试验,研究荆芥的生长、渗透调节和抗氧化能力在不同干旱程度[基质相对含水量分别为5%~10%(重度干旱)、45%~50%(中度干旱)和85%~90%(正常灌溉)]和不同干旱时间(15、30和45 d)下的响应。结果表明,随着干旱程度的加深,荆芥的生长受到抑制,生长速率、叶干重和叶绿素含量降低,比叶质量增大;叶中渗透调节物质的积累增加,可溶性糖、可溶性蛋白、脯氨酸和Na+含量增大;叶片抗氧化能力受到影响,其中超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性在胁迫15和30 d时逐渐增强,45 d时逐渐减弱,过氧化物酶(POD)活性则在胁迫30和45 d时逐渐增强,总酚和总黄酮的含量在胁迫15 d逐渐增大,分别在30和45 d时中度干旱下的积累量最高。随着干旱胁迫时间的延长,荆芥叶的渗透调节作用受到影响:可溶性糖、可溶性蛋白含量升高,脯氨酸、K+、Na+和Ca2+的含量降低,SOD和CAT活性先增强后减弱,POD活性持续增强,总酚和总黄酮的含量先增加后趋于不变。荆芥能对干旱胁迫做出适应性应答,对缺水环境具有一定的耐受性,这为荆芥的规范化栽培和用水管理提供了依据。
This research studied the changes (relative to unstressed plants) in the growth, osmotic adjustment and antioxidant system of Schizonepeta tenuifolia grown in pots under severe or moderate water deficit stress [substrate relative water content 5%-10% (severe stress), 45%-50% (moderate stress) or 85%-90% (no stress, CK)], imposed for a duration of 15, 30 or 45 days. The growth of S. tenuifolia showed increasing inhibition with increasing intensity of water deficit, with traits affected including the growth rate, leaf dry weight and total chlorophyll content, while leaf mass per area (LMA) increased under water deficit. Water deficit promoted the accumulation of osmotic adjustment substances in leaves, including soluble sugar, soluble protein, proline and Na+. Water deficit also generally increased the antioxidant capacity of leaves: The activities of superoxide dismutase (SOD) and catalase (CAT) were moderately increased at 15 and 30 days, but decreased at 45 days, relative to CK, while peroxidase (POD) activity was moderately increased at 30 and 45 days. The contents of total phenol and total flavonoids were moderately increased at 15 days, and reached their highest levels under moderate drought at 30 and 45 days. Increased duration of water deficit affected the osmotic adjustment in leaves: The soluble sugar and soluble protein contents increased; the proline, K+, Na+ and Ca2+ contents decreased; the activities of SOD and CAT increased initially and later decreased; POD activity continued to increase with time, and the accumulation of total phenols and total flavonoids increased initially and then remained unchanged. In summary, S. tenuifolia made adaptive responses to drought stress and showed tolerance to moderate drought. This study provides a theoretical basis for the standardized cultivation and water management of S. tenuifolia.
干旱是限制植物生长和农作物减产的主要因素。近年来, 由于降水量低或灌溉不足, 1/3的耕地面临着缺水的现状, 气候变化、人口增加以及农业生产量增大等原因也将会导致缺水压力的加剧[1]。植物遭遇缺水时, 体内的生理和生化过程如光合作用、蒸腾作用和次生代谢等都会受到一定影响, 致使植物不能完成正常生长发育过程, 严重时还会致其死亡[2]。当植物面临干旱时, 会通过生理调节来适应和抵抗不良环境, 其生理调节主要包括两方面, 一是通过渗透调节来增加细胞内的渗透调节物质, 降低细胞内水势, 调节细胞液浓度以维持细胞内外的渗透压平衡; 二是通过抗氧化酶系统的调节和抗氧化物质的积累来增强细胞的抗氧化活性, 从而快速清除因干旱产生的活性氧等有害物质[3]。
荆芥(Schizonepeta tenuifolia)为唇形科裂叶荆芥属植物, 以全草或花穗入药, 具有解表散风、透疹消疮的功效, 常用于治疗感冒、头痛、发热、过敏性皮炎、皮疹和炎症性疾病等[4], 是我国的大宗药材之一。荆芥中富含酚类和黄酮类物质, 是其抗炎、抗癌等作用的基础, 被广泛应用于中国、日本、韩国等国家[5]。目前, 关于荆芥的研究主要集中在药理药效方面[5, 6], 对于荆芥在干旱胁迫下的生理和生化变化却鲜有报道。在我国, 荆芥的临床应用主要来源于人工栽培, 其产区在我国的东北和华北地区, 这些地区现多面临灌溉用水紧张的问题[7], 而荆芥在水分亏缺环境下, 其生理和生化过程会受何影响, 其如何来适应缺水环境值得关注, 因此开展荆芥在干旱胁迫下的相关研究, 对荆芥的规范化栽培和用水管理具有重要意义。本研究采用盆栽控水试验, 研究荆芥的生长、渗透调节物质、抗氧化酶活性、总酚和总黄酮含量对不同干旱程度和干旱时间的响应, 分析荆芥对干旱胁迫的生理和生化响应特征, 为探讨干旱胁迫对荆芥生长、生理的影响以及荆芥的规范化栽培中的用水管理奠定理论基础。
供试植物种子经南京农业大学园艺学院王康才教授鉴定为唇形科荆芥的种子。
试验于2018年8月14日开始, 选取籽粒饱满、大小均匀的荆芥种子, 播种于装有营养土的穴盘中, 保持土壤湿润。待幼苗长至10 cm左右, 移至塑料盆中, 每盆装营养土∶ 蛭石∶ 珍珠岩以1∶ 2∶ 1(v∶ v∶ v)的比例混合基质(基质持水量为70%)共计1.00 kg。每盆移栽3株, 共计60盆。
移栽10 d后, 进行干旱胁迫处理。将60盆试验材料随机分为3组, 设置:重度干旱胁迫(heavy stress, HS)5%~10%、中度干旱胁迫(moderate stress, MS)45%~50%、正常灌溉(control, CK)85%~90% 3个相对含水量处理, 每周灌溉两次。每次灌溉时利用Mettler-Toledo(美国)水分速测仪测定盆栽基质的相对含水量, 5次测量取平均值后补足不足水分。整个试验于南京农业大学生命科学楼日光温室内进行, 温度15~25 ℃, 湿度30%~40%。试验分别于干旱胁迫处理后的15、30、45 d进行取样。
1.3.1 生长指标的测定 主要测定其增长速率、叶鲜干重、相对含水量和比叶质量。
1)增长速率的测定[8]: 随机选取5株荆芥, 分别测定其处理前后的株高, 按照公式计算增长速率:增长速率(cm· d-1)=(处理后株高-处理前株高)/处理天数。
2)叶鲜干重、相对含水量的测定[9]:将测量株高后的植株洗净, 剪下单株植株上所有叶片称重, 即为叶鲜重。随后将叶片置于50 ℃烘箱中烘干至恒重, 称重, 即为叶干重。采用烘干法测定叶片相对含水量, 每处理重复5次, 按照公式计算:叶片相对含水量=(叶鲜重-叶干重)/(叶吸水饱和后鲜重-叶干重)× 100%。
3)比叶质量的测定[10]:选取荆芥各处理下同一轮平整舒展且完整的叶片, 利用Image J软件(National Institutes of Health, 美国)测量叶片单面面积, 每个处理重复5次, 按照公式计算比叶质量(leaf mass per area, LMA):LMA(g· m-2)=单叶干重/叶片单面面积。
1.3.2 叶绿素含量的测定 随机选取荆芥植株同一轮叶片0.20 g, 加入95%乙醇于黑暗环境中冷浸提取叶绿素, 采用分光光度法测定叶绿素含量[9], 每处理重复5 次。
1.3.3 可溶性糖、脯氨酸和可溶性蛋白含量的测定 称取荆芥植株同一部位的叶片0.10 g, 分别采用蒽酮比色法、磺基水杨酸法和考马斯亮蓝 G-250 法测定可溶性糖、脯氨酸和可溶性蛋白含量[9], 每处理重复 3 次。
1.3.4 K+、Na+和Ca2+含量的测定 将新鲜的荆芥叶片置于50 ℃烘箱中烘干至恒重, 粉碎后过0.613 mm筛。准确称取样品粉末 0.20 g, 加入5 mL硝酸后于微波消解炉中消解30 min, 冷却后用去离子水定容至50 mL, 混匀后备用。利用 Optimal 2100DV 电感耦合等离子体发射光谱仪(PerKinElmer 公司, 美国)测定荆芥叶片中K+、Na+和Ca2+的含量[8], 测定条件:射频功率1300 W, 辅助气流量0.2 L· min-1, 等离子体气流量15 L· min-1, 积分时间90 s。每处理重复3次。
1.3.5 抗氧化酶活性的测定 随机选取各处理荆芥植株的叶片, 混匀后称取0.50 g。采用氮蓝四唑法测定超氧化物歧化酶(superoxide dismutase, SOD)活性; 采用愈创木酚法测定过氧化物酶(peroxidase, POD)活性; 采用紫外分光光度法测定过氧化氢酶(catalase, CAT)活性[9]。每处理重复3次。
1.3.6 总酚和总黄酮含量的测定 取不同处理下荆芥干燥叶片粉末0.50 g, 加入甲醇后超声提取30 min, 4 ℃下5500 r· min-1离心30 min后, 取上清液保存于4 ℃冰箱中备用。采用福林酚比色法测定总酚含量[11], 以没食子酸作为标准品, 计算标准曲线; 采用亚硝酸钠-硝酸铝比色法测定总黄酮含量[11], 以芦丁为对照品, 计算标准曲线。每处理重复3次。
利用 Excel 2016和SPSS 19. 0对数据进行处理及分析, 采用Duncan 法进行不同处理和不同时间的差异显著性比较。
荆芥的生长对干旱胁迫有不同的响应(表1), 植株形态出现了明显变化。据观测, 重度干旱(HS)下, 荆芥植株的茎直径和叶表面积减小, 叶片卷缩, 大量叶片边缘出现萎蔫发黄现象; 中度干旱(MS)下, 荆芥植株较正常灌溉下(CK)表观特征无明显差异。在同一胁迫时间下, 随着干旱程度的加深, 荆芥植株的增长速率、叶片鲜重、干重以及相对含水量均呈现逐渐降低的趋势。荆芥的增长速率随胁迫时间的延长而降低, 差异显著(P< 0.05), 以胁迫15 d CK最大, 为1.21 cm· d-1。荆芥的比叶质量(LMA)在干旱胁迫15 d时, HS下最大, CK下最小; 在胁迫持续至30和45 d时, 在MS下最大, CK下最小。
| 表1 干旱胁迫对荆芥增长速率、叶鲜重、叶干重、叶片相对含水量和比叶质量的影响 Table 1 Effects of drought stress on the increasing rate of plant height, leaf fresh weight, leaf dry weight, leaf relative water content and LMA of S. tenuifolia (mean± SD, n=5) |
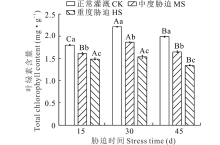
荆芥叶片中叶绿素的含量对干旱胁迫有不同的响应(图1)。在同一胁迫时间下, 荆芥叶片中的叶绿素含量随干旱程度的加深而逐渐降低, CK显著高于干旱处理组(P< 0.05); MS处理下的叶绿素含量分别为同阶段CK的89.59%、84.39%和82.78%; HS处理下的叶绿素含量分别为同阶段CK的82.69%、69.54%和67.55%。在CK和MS处理下, 荆芥叶片中的叶绿素含量均在胁迫30 d时最大, 胁迫15 d时最小, 在HS处理下, 叶绿素含量在胁迫30 d时最大, 胁迫45 d时最小。由此可见, 干旱胁迫不利于叶绿素的合成。
干旱胁迫对荆芥叶片中可溶性糖、可溶性蛋白和脯氨酸含量的积累具有促进作用(表2)。在同一胁迫时间下, 可溶性糖的含量在HS下最高, 并随土壤相对含水量的增加而降低, 各处理间差异显著(P< 0.05); 随着胁迫时间的延长, 可溶性糖的含量逐渐升高, 在干旱处理45 d时HS下达到最大值, 为78.10 μ g· g-1。可溶性蛋白含量在3个处理时间下均随干旱程度的加深而增大, HS下的可溶性蛋白含量分别为同一时间段CK的2.5、1.2和2.1倍。脯氨酸含量的变化趋势与可溶性糖、可溶性蛋白一致, 均随干旱程度的加深而升高, 在胁迫45 d时HS下达到最大值, 为256.60 μ g· g-1, 显著高于MS和CK。
| 表2 干旱胁迫对荆芥叶片中渗透调节物质含量的影响 Table 2 Effects of drought stress on the content of osmoregulation substances in the leaves of S. tenuifolia (mean± SD, n=3) (μ g· g-1) |
干旱胁迫对荆芥叶片中K+和Na+含量具有促进作用(表3)。在同一胁迫时间下, 荆芥叶片中的K+含量在干旱处理下显著大于CK, 在胁迫15 d时HS下最大, 为469.42 mg· g-1, 为同一阶段下MS的1.1倍、CK的1.3倍; 在胁迫30和45 d时, K+含量在MS下最大, HS下次之, CK下最低。Na+含量在3个胁迫时间下均随胁迫程度的加深而增加, 处理间差异显著(P< 0.05), 在胁迫15 d时HS下最大, 为29.34 mg· g-1。Ca2+含量在干旱胁迫15 d时的变化趋势与K+和Na+的含量变化一致, 随土壤相对含水量的降低而增加, 但随着胁迫时间的延长, 各处理间Ca2+含量变化无明显差异(P> 0.05)。在同一处理下, 随胁迫时间的延长, K+、Na+和Ca2+含量均呈现逐渐降低的趋势, 在15 d时最大, 45 d时最小。
| 表3 干旱胁迫对荆芥叶片中K+、Na+和Ca2+含量的影响 Table 3 Effects of drought stress on K+, Na+ and Ca2+content in the leaves of S. tenuifolia (mean± SD, n=3) (mg· g-1 ) |
干旱对荆芥叶片中抗氧化酶活性产生了不同的影响(表4)。SOD活性在干旱胁迫15和30 d时均随干旱程度的加深呈现上升趋势, HS下的值分别为CK的1.84和2.25倍, 在胁迫45 d时, 则呈现逐渐降低的趋势, HS和MS下的值较CK分别降低了28.50%和23.43%; CAT活性变化趋势与SOD相同。POD的活性在干旱胁迫15 d时变化不显著(P> 0.05), 随着胁迫时间的延长, POD活性变化呈现上升趋势, 在HS下活性最高, 较同时间段CK提高了226.03%和249.54%。
| 表4 干旱胁迫对荆芥叶片中抗氧化酶活性的影响 Table 4 Activities of SOD, POD and CAT influenced by drought stress in the leaves of S. tenuifolia (mean± SD, n=3) (U· g-1 DW) |
干旱胁迫对荆芥叶片中总酚、总黄酮的含量变化具有显著影响(图2)。在同一胁迫时间下, 干旱处理下荆芥叶片中的总酚含量显著高于CK(P< 0.05), 在胁迫15 d时, HS高于MS, 胁迫30和45 d时, MS高于HS。总黄酮含量的变化与总酚一致, MS下的总黄酮含量分别为同阶段CK的2.3、3.0和2.8倍, HS下的总黄酮含量分别为同阶段CK的3.0、2.6和2.9倍。由此可见, 不同程度的干旱胁迫能刺激荆芥叶中的次生代谢, 能产生更多的酚类与黄酮类成分以应对干旱胁迫。
干旱是植物遭受的最严重的非生物胁迫之一, 会对植物的生长、生理和代谢产生不利影响, 严重会致其死亡[12]。在本研究中, 土壤缺水影响了荆芥的生长, 明显降低了荆芥的生长速率和叶片中干物质的积累, 但提升了其比叶质量(LMA)。LMA是指叶片干质量与面积之间的比率, 是叶中多种结构特征的综合评价指标[13], 当植物遭受水分胁迫时, 叶片的上表皮组织、栅栏组织和海绵组织会显著增厚, 这导致叶片的厚度增加, 植物内部水分的传导距离增大, 降低了水分的散失, 提高了水分利用效率, 同时, 叶片中细胞的体积会减小、间隔变小、细胞壁增厚, 这些组织和细胞结构的改变是导致LMA增加的直接原因[10]。在干旱条件下, 荆芥叶片中的叶绿素含量有所降低, 这与Farooq等[14]的研究结果一致, 叶绿素含量的降低与LMA的增加会降低植物光能利用率, 降低光合产物的合成, 这也是造成干旱条件下荆芥生长缓慢、生物量积累减少的原因。
土壤缺水时, 植物为避免因细胞内水势过高造成失水, 需要通过产生大量的可溶性物质来降低细胞内水势, 进行渗透调节。植物体内的渗透调节物质主要由两部分构成:一是有机渗透调节物质, 如可溶性糖、可溶性蛋白质和脯氨酸等; 二是能从外界环境中进入到细胞内的无机离子[8]。作为溶质积累的渗透调节物质一方面可以增强植物保持水分的能力, 稳定体内的渗透压平衡, 另一方面还可以参与生化反应, 产生生物活性。当荆芥遭受干旱胁迫时, 叶片中的可溶性糖、可溶性蛋白质和脯氨酸的含量均有显著提升, 这表明干旱诱导了这3种物质的积累, 这与Gomes等[15]、Manivannan等[16]的研究结果一致。植物在缺水条件下, 可溶性糖的积累不仅能降低细胞水势, 还能与蛋白质形成氢键, 维持蛋白质的结构与功能, 保护细胞膜; 细胞质中大量积累的脯氨酸也能通过维持蛋白质结构的稳定性来保护蛋白质结构, 或作为自由基清除剂, 或通过谷氨酸合成NADPH和H+参与循环来帮助植物抵抗逆境[15]。
无机离子也是植物细胞内响应渗透调节的常见物质, 在植物应对干旱胁迫的过程中, 无机离子的积累往往比最初调节阶段的有机溶质的合成更为重要, 因为通过离子吸收的渗透调节能为植物节省更多的能量, 常见的无机离子有K+、Na+、Ca2+[3]。研究结果表明, 在干旱胁迫初期, 荆芥地上部分的K+和Na+在干旱胁迫下逐渐增大, 这是植物响应干旱的表现, 通过K+和Na+的吸收来提高细胞中溶质的含量, 以降低细胞渗透势, 从而达到增强植物细胞吸水能力的目的, 这与蒙古黄芪(Hedysarum mongolicum)[17]、沙枣(Elaeagnus argustifolia)[18]等植物在遭受干旱胁迫时的表现一致, K+除了能进行干旱下的渗透调节外, 还能参与植物体内的多种生理活动, 如蛋白质的合成、光合产物的形成及运输等, 是最有效的阳离子活化剂, Na+由胞外进入液泡的过程中可有效转移细胞内的有害物质, 可以避免对一些代谢酶造成破坏[3]。而随着胁迫时间的延长, K+仍在干旱下积累量增大, 但在中度干旱胁迫下的积累量大于重度干旱胁迫, 此时, Na+却在重度干旱胁迫下的积累量大于中度干旱胁迫, 通常情况下, 大多数植物会有“ 吸收K+排斥Na+” 的现象, 而Na+与K+具有相似的离子半径和水合能, 存在着明显的拮抗效应[8, 19], 干旱前期的渗透调节过程中K+的大量吸收也会抑制荆芥对Na+的吸收, 但当其处于严重且长期的干旱胁迫下, 植物体内的K+的含量已经趋近于最大值, 对Na+的需求才得以明显体现, Wang等[19]研究发现, 与细胞质中积累的渗透保护剂或有机溶质相比较, Na+更能减轻或减缓植物在高盐胁迫及水分亏缺时造成的损伤, 在保持水分平衡时, 作用甚至比K+更为明显。在干旱条件下, Ca2+可以通过连接细胞膜上的磷脂、磷酸盐及蛋白质羧基来维持细胞膜结构的完整性, 降低膜透性, 提高叶片的保水能力, 同时, Ca2+能传递干旱信号, 参与诱导脱落酸(abscisic acid, ABA)和脯氨酸的产生[20]。在干旱15 d时, 随着基质相对含水量的减少, 荆芥叶片中的Ca2+的积累逐渐增加, 随着胁迫时间的延长, 叶片中的Ca2+的积累量无明显变化, 这可能是由于荆芥的根系对水分的吸收速率降低, 使得矿质营养元素的吸收阻力增大, 植物体内各营养元素含量的变化产生了互作效应, 影响了Ca2+的吸收。
干旱除了对植物的生长发育和渗透调节过程产生重要影响外, 还会破坏植物中活性氧(reactive oxygen species, ROS)的产生和清除间的平衡, 导致过量的活性氧物质的积累, 致使植物遭受氧化损伤。植物为保护自身免受ROS的伤害, 会激活内源抗氧化防护系统, 来维持ROS的动态平衡, 从而减轻和缓解逆境伤害, 使植物适应干旱环境[21]。植物的抗氧化防护系统主要包括以抗氧化酶类为主的酶促系统和以抗氧化剂为主的非酶促系统。植物体内主要的抗氧化酶类物质有SOD、POD、CAT等。SOD是植物体内清除ROS的第一道防线, 通过清除超氧阴离子自由基(
非酶促系统包括酚类、黄酮类等抗氧化物质, 它们可以直接与ROS反应, 也可以作为酶的底物出现在清除机制中, 是植物抗氧化防御系统中重要的一部分[3]。酚类和黄酮类物质也是荆芥叶中重要的次生代谢产物, 具有重要的生物和药理活性[11]。干旱促进荆芥叶中总酚含量的积累, 酚类物质的积累能为植物遭遇逆境时提供保护作用, 这与马铃薯(Solanum tuberosum)[24]、鼠尾草(Salvia officinalis)[25]等植物在干旱条件下的变化趋势一致。在土壤缺水条件下, 植物体内总酚含量的增大, 有助于降低细胞内的水势, 阻止细胞内水分的流失, 防止细胞失水; 同时多酚易与糖类物质形成复合物, 有助于提高细胞弹性, 防止细胞因失水而造成机械损伤, 从而增强植物的抗旱性[26]。在干旱胁迫下, 荆芥中总黄酮的积累量增大, 这与Ma等[27]和Yuan等[28]的研究结果相似, 这说明在植物遭遇缺水时, 黄酮类化合物对其具有一定的保护作用, 这种保护作用主要是由于黄酮类化合物通常具有如羟基、双碳键、糖基化、酰化、甲基化等特殊结构, 能够有效对抗应激诱导的氧化损伤, 同时还可以通过阻止活性氧的生成和清除活性氧来完成抗氧化功能[29]。另外, 有学者认为, 黄酮类化合物的生物合成可以通过MYB转录因子来刺激细胞氧化还原稳态来完成, 此过程受不同细胞氧化还原电位的调控[11], 而MYB转录因子在遭遇干旱时, 也会表现出更强的活性, 这也可能是造成荆芥黄酮类物质积累的原因[30]。此外, 大量研究表明, 荆芥中的多酚和黄酮类物质如木犀草素、芹菜素等具有抗病毒、抗炎的药理作用[5, 6], 干旱导致荆芥中总酚和总黄酮的积累可能会对其药效产生一定影响, 这有待进一步研究。
干旱胁迫对荆芥的生理和生化过程具有显著影响。在干旱胁迫下, 荆芥的生长速率降低, 叶片的干物质量和叶绿素含量降低, 有机渗透调节物质(可溶性糖、可溶性蛋白和脯氨酸)的合成和K+、Na+的积累得到促进; 适时的干旱(15和30 d)能促进荆芥叶中抗氧化酶SOD和CAT活性的增强, 另一抗氧化酶POD活性在胁迫中后期(30和45 d)显著增强; 同时, 干旱能促进荆芥叶中总酚和总黄酮的积累, 在中度干旱胁迫下变化尤为明显。综上, 荆芥能通过渗透调节和抗氧化系统对干旱胁迫作出适应性响应, 对缺水环境具有一定的耐受性, 并且干旱胁迫能在一定程度下提升荆芥叶片中次生代谢产物总酚和总黄酮的含量。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|