作者简介:高子奇(1990-),内蒙古通辽人,在读博士。E-mail: 952003073@qq.com
花青素是植物体内重要的黄酮类次生代谢产物,其强大的抗氧化能力对植物抵抗由各种非生物胁迫带来的氧化损伤发挥着重要的作用。本研究基于转录组数据,从唐古特白刺cDNA中克隆得到一个类黄酮3-O-葡萄糖基转移酶基因,将其命名为 NtUFGT。该基因开放阅读框长度为1407 bp,编码468个氨基酸,预测该基因编码的蛋白质相对分子质量为51.37 kDa。多重序列比对分析结果显示,其编码蛋白属于UDP-glycosyltransferases蛋白家族。实时荧光定量PCR(qRT-PCR)分析了该基因在唐古特白刺中的表达模式,发现该基因的表达具有组织特异性,由高到低依次为花>果实>茎>叶>根;同时该基因能被聚乙二醇(PEG)和脱落酸(ABA)等非生物胁迫强烈诱导表达。构建该基因的真核表达载体 pPZP221:35 S: NtUFGT,使用花序浸染法转化拟南芥并筛选至T3代,RT-PCR验证表明, NtUFGT基因在转基因拟南芥3个株系中均明显表达。测定干旱胁迫条件下野生型(WT)和转基因拟南芥(OE株系)生长状况和抗逆相关生理生化指标,结果发现转基因拟南芥生长状况明显优于野生型,根长更长,鲜重和叶绿素含量更高,同时OE株系积累了更多的花青素和总黄酮。与表型一致,相较于WT,OE株系具有更高的抗氧化酶活性[超氧化物歧化酶(SOD);过氧化物酶(POD);过氧化氢酶(CAT)],积累了更多的还原性谷胱甘肽(GSH)和脯氨酸,同时其丙二醛(MDA)、过氧化氢(H2O2)含量显著低于WT;基因定量分析结果显示,OE株系拟南芥中抗逆相关基因 AtCAT1、 AtPOD1、 AtRD29 A及脯氨酸合成基因 AtP5 CS的表达量明显高于WT。以上结果说明, NtUFGT能有效提高转基因拟南芥中花青素和总黄酮含量,赋予植物更强的活性氧清除能力和渗透调节能力,从而增强了植物对干旱胁迫的耐受性。
Anthocyanidins are important secondary metabolites of flavonoids. Their significant antioxidant effects can assist plants to alleviate oxidative damage caused by various abiotic stressors. Based on transcriptome data, a flavonoid 3-O-glucosyltransferase gene was cloned from the cDNA of Nitraria tangutorum, and was named NtUFGT. The open reading frame of NtUFGT has 1407 bp, and encodes a protein with 468 amino acids. The relative molecular mass of the protein encoded by this gene is predicted to be 51.37 kDa. Multiple sequence alignment analysis showed that the NtUFGT protein belongs to the UDP-glycosyltransferase protein family. Quantitative real-time PCR (qRT-PCR) was carried out to analyze gene expression patterns. NtUFGT had tissue-specific expression patterns. From high to low expression: flower>fruit>stem>leaf>root. Also, it was rapidly up-regulated by polyethylene glycol and abscisic acid treatments. The plasmid of pPZP221:35 S: NtUFGT was constructed and introduced into a wild-type (WT) Arabidopsis thaliana by a floral-dip method. qRT-PCR was carried out to confirm that the NtUFGT gene was expressed in three T3 generations. The growth status and stress-resistant physiological and biochemical indexes of wild-type and transgenic A. thaliana (OE lines) under drought stress were measured. The OE lines showed a stronger phenotype with longer root length, heavier fresh weight and higher chlorophyll content than the WT. OE lines also accumulated more flavonoids and anthocyanin. Consistent with phenotype, OE lines had increased levels of antioxidant enzyme (superoxide dismutase, peroxidase, and catalase) activity, and accumulated more glutathione, proline and less malondialdehyde and H2O2. The results of qRT-PCR analysis showed that the expression levels of the stress-related genes ( AtCAT1, AtPOD1, AtRD29 A) and the proline synthesis gene AtP5 CS in OE lines were significantly higher than those in the WT. Our observations indicate that the NtUFGT can facilitate stronger active oxygen scavenging capacity and osmotic adjustment ability by effective promotion of the synthesis of anthocyanidins and flavonoids in transgenic Arabidopsis, thus enhancing the tolerance of plants to drought stress.
干旱作为主要的非生物胁迫之一, 严重限制了植物的生长发育, 对农作物的产量和质量造成极为不利的影响[1]。干旱胁迫通常会导致胞质中活性氧(reactive oxygen species, ROS)的过量积累, 影响许多细胞功能, 包括损伤核酸、氧化蛋白质和引起脂质过氧化[2]。植物中ROS清除机制主要包括酶促和非酶促两种, 酶促抗氧化剂主要包括超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)、过氧化物酶(peroxidase, POD)、抗坏血酸过氧化物酶(aseorbateperoxidase, APX)、单脱氢抗坏血酸还原酶(monodehydroascorbatereductase, MDHAR)和脱氢抗坏血酸还原酶(dehydroascorbatereductase, DHAR)等; 非酶促抗氧化剂主要包括抗坏血酸、谷胱甘肽(glutathione, GSH)、类胡萝卜素、生育酚和花青素等[3]。花青素是一类重要的黄酮类次生代谢产物, 在植物体内扮演着多种角色。它能赋予植物花、果实和其他植物组织不同的颜色, 同时还作为营养组织中起防御作用的小分子物质, 保护植物免受紫外线和高光照射引起的损伤[4]。作为目前受到广泛关注的一种活性氧清除剂, 花青素强大的抗氧化能力被认为甚至优于一些众所周知的抗氧化剂, 如抗坏血酸和生育酚, 它能通过环状结构上连接的羟基来中和活性氧自由基, 起到清除ROS的作用[5]。花青素在植物体内的合成途径已经被广泛研究, 主要由查尔酮合成酶(chalcone synthase, CHS)、查尔酮异构酶(chalconeisomerase, CHI)、黄烷酮3-羟化酶(flavanone-3-hydroxylase, F3H)、二氢黄酮醇4-还原酶(dihydroflavonol 4-reductase, DFR)、花色素合成酶(anthocyanase, ANS)和类黄酮-3-O-葡萄糖基转移酶(flavonoid-3-O-glucosyltransferase, UFGT)等酶催化合成, 并受MYB、bHLH和WD40等转录因子的调控[6]。研究发现, 调控花青素合成途径相关基因的表达会改变花青素的积累并影响植物的抗逆性。在烟草(Nicotiana benthamiana)中过表达Delila(bHLH转录因子基因)和Rosea1基因(MYB转录因子基因)能促进烟草花青素积累, 提升其ROS清除能力, 从而增强植物对干旱和盐胁迫的耐受性[7]。Hong等[8]也报道了紫甘薯(Ipomoea batatas)中DFR基因的沉默会导致花青素合成和积累下降、抗氧化活性降低和H2O2水平升高, 从而降低植物对冷和氧化胁迫的耐受性。
UFGT属于UDP-糖基转移酶家族(UGTs), 该家族蛋白能催化植物体内多个代谢过程的糖基转移反应。作为花青素合成途径中最后一个关键酶, UFGT催化UDP-葡萄糖的葡萄糖基转移至花青素3位羟基基团, 使其糖基化形成稳定的花色苷, 直接决定了所合成花色苷的种类和稳定性, 因此对于花青素的合成十分重要[9]。非生物胁迫诱导UFGT蛋白家族基因表达, 参与如激素[10, 11]、酚类[12]和黄酮类[13]等物质的糖基化修饰并调节植物抗逆性的研究已经有一些报道, 如在拟南芥(Arabidopsis thaliana)[14]、葡萄(Vitis vinifera)[15]、玉米(Zea mays)[16]、白菜(Brassica rapa)[17]等植物中研究了干旱胁迫对UFGT基因表达模式的影响; 在拟南芥中过表达AtUGT79B2和AtUGT79B3基因(属于UFGT基因家族), 促进了花青素的积累, 增强了植物对低温、干旱和盐胁迫的耐受性[14]。然而, 针对花青素合成途径UFGT基因参与非生物胁迫的分子机制的研究还不深入。
唐古特白刺(Nitraria tangutorum)是隶属于蒺藜科(Zygophyllceae)白刺属(Nitraria)的强旱生灌木, 是我国西北地区乡土植物, 具有极强的克隆生长能力, 能很好的适应荒漠地区的干旱、半干旱生长环境, 具有防风固沙、改良土壤等生态价值[18]。唐古特白刺富含大量营养物质, 特别是果实、种子、叶中含有较丰富的黄酮类物质、不饱和脂肪酸、氨基酸、多糖、维生素C、有机酸、矿物质及微量元素等多种营养成分和生理活性物质, 具有较高的药用和营养价值[19], 是西部荒漠草原区重要的饲用植物, 其果实已被开发成功能食品。本研究以唐古特白刺为试验材料, 基于转录组数据, 采用PCR技术克隆得到NtUFGT基因的开放阅读框, 对其进行序列及表达特性分析。构建植物真核表达载体pPZP221-NtUFGT, 使用农杆菌浸染法转化拟南芥, 筛选得到纯合体植株。通过对干旱胁迫下植物生理生化指标的测定和基因定量分析, 探讨该基因在提高植物耐受干旱胁迫过程中的分子机制, 为深入研究唐古特白刺在干旱胁迫下的抗逆机理提供理论依据。
唐古特白刺不同组织和种子于2018年7月采自内蒙古自治区乌海市千里山地区, 植物组织经液氮速冻后于-80 ℃保存, 种子于37 ℃烘干后低温沙藏保存。哥伦比亚野生型拟南芥(Col-0)种子和农杆菌菌种GV3101由内蒙古大学祁智教授惠赠。植物真核表达载体pPZP221由内蒙古大学哈斯阿古拉教授惠赠。
将唐古特白刺种子浸泡于98%浓硫酸80 min, 蒸馏水冲洗, 纱布搓洗至碳化黑壳褪净, NaClO溶液浸泡除菌10 min, 无菌水冲洗5次后用灭菌滤纸将残余水分吸干, 播种于固体MS培养基(M524 4.33 g· L-1, Sigma; MES 0.5 g· L-1, Sigma; 蔗糖26 g· L-1, Sigma; 琼脂粉 6.5 g· L-1, Sigma; pH=7.0)中。在24 ℃、湿度60%、16 h光照/8 h黑暗条件下培养30 d, 将幼苗移至Hoagland液体培养基中继续培养15 d。挑选上述长势相近的幼苗, 分别用20%聚乙二醇(polyethylene glycol, PEG)和10 μ mol· L-1脱落酸(abscisic acid, ABA)处理0、3、6、12、24、48 h, 每个处理分别使用10株幼苗, 每个处理重复3次。收集植物材料, 液氮速冻, -80℃保存。
唐古特白刺总RNA提取参照Promega Easy® Super Total RNA Extration Kit说明书进行; cDNA合成参照TransGenTransScript II All-in-One First-Strand cDNA Synthesis SuperMix for qPCR (One-Step gDNA Removal)说明书进行; 使用QIAGEN Rotor Gene Q Real-time PCR Platform系统进行基因定量分析, 相关基因引物序列见表1。反应总体系20 μ L, 包括TransStart Tip Green qPCRSuperMix (+Dye I) (Transgen) 10 μ L, 上、下游引物各0.5 μ L, cDNA 1 μ L, ddH2O 8 μ L。反应程序为94 ℃预变性30 s, 94 ℃变性5 s, 60 ℃退火15 s, 72 ℃延伸10 s, 45个循环, 溶解曲线从65~95 ℃, 重复3次。用2-Δ Δ Ct法计算基因相对表达水平。
| 表1 相关基因引物序列 Table 1 The primer sequences of related genes |
根据已有的唐古特白刺转录组数据和NCBI ORF Finder预测NtUFGT基因开放阅读框, 使用Primer premier 5.0设计两端带有Xba I和Sac I酶切位点的引物(表1), 反应体系为25 μ L:TransStartTaq DNA polymerase 0.5 μ L, 10× PCR Buffer 2.5 μ L, dNTP 2.5 μ L, cDNA模板1 μ L, 正、反向引物各1 μ L, ddH2O 16.5 μ L。反应程序:95 ℃ 10 min, 95 ℃ 30 s, 62 ℃ 30 s, 72 ℃ 90 s, 40个循环; 72 ℃ 10 min。PCR产物经琼脂糖凝胶电泳和胶回收后16 ℃TA连接至pMD-19T克隆载体, 采用冻融法转化大肠杆菌感受态。将大肠杆菌活化后涂于带有卡那霉素、IPTG和X-Gal的LB(胰蛋白胨 10 g· L-1, 源叶生物; 酵母提取物 5 g· L-1, 源叶生物; 氯化钠 10 g· L-1, Sigma; 琼脂粉 15 g· L-1, Sigma; pH=7.0)平皿上, 蓝白斑筛选后挑阳性克隆送测序。 选取测序正确的阳性克隆提取质粒, 通过双酶切和T4连接构建pPZP221-NtUFGT植物表达载体, 冻融法转化GV3101农杆菌感受态。将其涂布在含有50 mg· L-1壮观霉素(Spe)和50 mg· L-1利福平(Rif)的LB固体培养基上, 筛选阳性克隆。将筛选获得的农杆菌阳性克隆-80 ℃保存, 用于后续拟南芥侵染试验。
利用NCBI的ORF Finder(http://www.ncbi.nlm.nih.gov/gorf.html)预测开放阅读框(open reading frame, ORF)序列和氨基酸序列; 通过NCBI网站Blast功能和DNAMAN软件进行蛋白保守结构域分析; 使用Clustal X和MEGA 5.0软件Neighbor-Joining法进行多序列比对和构建系统进化树。
拟南芥的遗传转化和筛选方法参照索雅飞等[20]的方法。将携带重组质粒的GV3101农杆菌活化扩培12 h后, 4000 r· min-1离心10 min, 去上清留底部沉淀菌体, 加入5%的蔗糖溶液重悬, 将重悬液调整至OD600=0.8, 加入0.03% Silwet L-77。挑选生长状况良好的拟南芥, 剪去已结好的果荚, 用重悬液浸染拟南芥花序5 min, 覆膜, 暗培养24 h, 之后移至正常条件下培养。待角果成熟后, 采集种子, 加入变色硅胶置于37 ℃烘箱中干燥。将干燥好的T1代拟南芥种子用75%乙醇处理10 min, 无水乙醇处理20 min, 播种于含有50 mg· L-1庆大霉素的固体MS培养基上, 4 ℃春化3 d, 移至24 ℃, 16 h光照/8 h黑暗光周期, 4000 Lx光照强度, 70%湿度的光照培养箱中培养约2周后, 将生长出的拟南芥移至营养土(腐殖土∶ 蛭石=3∶ 1)中培养, 待果荚成熟后, 采集T2代种子。将T2种子继续播种, 选出呈3∶ 1性状分离培养皿上的阳性幼苗移至营养土中继续培养, 后获取T3代转基因拟南芥种子。重复上述步骤, 选出在筛选平皿中100 %成活的拟南芥幼苗, 移至营养土中培养, 获取转基因拟南芥纯合体植株。
使用半定量反转录PCR(reverse transcription PCR, RT-PCR)对筛选得到的拟南芥纯合体植株中NtUFGT基因的表达情况进行分析, 引物为NtUFGT-F-qPCR、NtUFGT-R-qPCR, 以拟南芥Atactin为内参基因(表1)。使用RNA提取试剂盒(Promega)提取转基因拟南芥纯合体植株RNA, 使用RT-PCR盒子(TAKARA)将1 μ g总量的RNA反转为cDNA, 反应体系为25 μ L:10Ex Taq buffer 2.5 μ L, 正、反引物各1 μ L, dNTPs 2 μ L, Takara Ex Taq HS DNA polymerase 1 μ L, cDNA 1 μ L, ddH2O 16.5 μ L; 反应程序:94 ℃ 30 s, 56 ℃ 30 s, 72 ℃ 1 min, 30个循环; 72 ℃ 10 min。
将野生型拟南芥和3个转基因型拟南芥株系播种于MS培养基中, 4 ℃春化3 d。对于根长测量的拟南芥, 3 d后移至含有200、300、400 mmol· L-1甘露醇的固体MS培养基上, 14 d后测量根长。对于用于其他指标测定的拟南芥, 当幼苗长出4片真叶时, 移栽到营养土中继续培养。对营养土中长至14 d长势一致的拟南芥分别进行停止浇水10和15 d处理。
对胁迫后的拟南芥进行拍照, 用千分之一天平测量幼苗重量、采用叶绿素仪(SPAD-502ChlorophyllMeterModel, 日本)测量叶绿素含量后收集植物材料, 液氮速冻, -80 ℃保存。过氧化物酶(POD)、过氧化氢酶(CAT)活性和丙二醛(MDA)、过氧化氢(H2O2)、脯氨酸(proline, Pro)、还原性谷胱甘肽(GSH)含量参照苏州科铭公司相关试剂盒说明书(微量法)进行测定。花青素含量测定参照Li等[21]的方法, 称取100 mg拟南芥植株, 液氮中研磨成粉末, 加入1 mL(含1% HCl, v/v)甲醇, 混匀, 4 ℃静置12 h, 8000 r· min-1离心10 min后吸取上清。使用酶标仪(SpectraMax i3, 美国)分别检测上清液在520和657 nm下的吸光值, Δ A=A530-A657, 重复3次。黄酮含量测定参照Sun等[22]的方法, 称取100 mg拟南芥植株, 液氮中研磨成粉末, 加入400 μ L 65%的甲醇, 80 ℃水浴1.5 h, 4000 r· min-1离心10 min, 取上清液加入到96孔板中, 加入10 μ L 5%NaNO2, 静置5 min, 加入10 μ L 10%AlCl3, 静置6 min, 加入30 μ L 4%NaOH, 静置15 min, 用酶标仪检测A510处的吸光值, 重复3次。
采用IBM SPSS Statistics 22.0和GraphPad Prism 6.0进行数据分析, 采用Duncan’ s多重比较和Student’ s t检验进行显著性差异分析。
2.1.1 NtUFGT基因的组织表达特性分析 使用实时荧光定量PCR分析NtUFGT基因在不同组织中的表达模式, 结果表明, NtUFGT在唐古特白刺各组织中均有不同程度表达(图1), 其中在花中表达量最高, 在根中表达量最低, 表达趋势为:花> 果实> 茎> 叶> 根。表明该基因在唐古特白刺花及果实发育过程中具有重要作用。
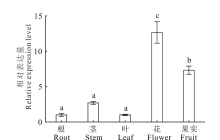 | 图1 NtUFGT组织表达特异性分析 不同字母表示差异显著(P< 0.05), 下同。Fig.1 Tissue specific expression analysis of NtUFGT (mean± SD, n=3) Different letters mean significant different (P< 0.05). The same below. |
2.1.2 PEG和ABA处理下NtUFGT基因表达特性分析 采用20% PEG、10 μ mol· L-1ABA处理唐古特白刺幼苗, 对NtUFGT基因的表达特性进行分析(图2)。结果表明: 两种处理均能诱导NtUFGT基因表达, 且都表现为先升高后下降的趋势, 其表达量分别在12和6 h达到最高, 之后开始下降。在两种胁迫处理48 h后, NtUFGT表达量依然高于0 h, 表明该基因可能在唐古特白刺应对以上两种胁迫中发挥了积极作用。
从本实验室已有的唐古特白刺转录组数据库中筛选得到NtUFGT基因序列, 利用PCR技术克隆得到一段长度为1407 bp的目的片段(图3), 经过TA克隆、蓝白斑筛选及菌液PCR验证后送测序公司测序, 测序结果与转录组数据库中NtUFGT基因序列一致, 可用于后续试验。
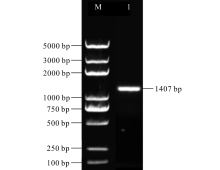 | 图3 NtUFGT基因ORF片段的PCR扩增Fig.3 The ORF amplification of NtUFGT gene M: Trans2K Plus DNA Marker; 1: NtUFGT片段扩增产物 The amplication product of NtUFGT fragment. |
NCBI保守结构域分析(conserved domains)显示, NtUFGT蛋白具有GT1_Gtf-like结构域, 属于UDPGT超家族(图4A)。对唐古特白刺NtUFGT氨基酸序列进行比对, 结果发现其与山竹子(Garcinia mangostana, ACM62748.1)、荔枝(Litchi chinensis, ALH45553.1)、桑树(Morus alba, AKM70873.1)和葡萄(BAB41024.1)的同源性较高, 均为58%。 利用Clustal X软件进行多重比对(图4B), 结果发现NtUFGT属于UDP-glycosyltransferases蛋白家族, 其氨基酸序列中包含典型的糖基转移酶家族的保守基序(plant secondary product glycosyltransferase, PSGE)。
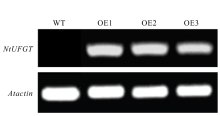
将2.2中获得的经过双酶切的目的片段与线性化处理后的pPZP221空载体进行T4连接, 获得pPZP221-NtUFGT重组质粒(图5)并使用冻融法转化GV3101农杆菌感受态。将含有重组质粒的农杆菌活化, 使用花序浸染法浸染拟南芥花序, 获得T0代种子, 将其播种于含有50 mg· L-1庆大霉素的MS固体培养基中筛选至T3代, 共获得3个转基因株系, OE1, OE2, OE3。分别提取3个转基因株系RNA, 以拟南芥Atactin为内参基因, 利用NtUFGT基因特异性引物进行RT-PCR。3个转基因株系拟南芥均可扩增出NtUFGT特异性片段(图6), 说明NtUFGT已成功导入拟南芥并在转录水平上稳定表达。
用不同浓度甘露醇(200, 300, 400 mmol· L-1)模拟干旱胁迫, 测量胁迫条件下野生型(wid type, WT)和转基因型拟南芥(OE1, OE2, OE3)的根长(图7)。结果发现:在正常条件下, WT和3个OE株系拟南芥根生长状态良好, 无明显差异。在施加了甘露醇之后, 不同株系的拟南芥主根长度均降低, 且降低幅度随着甘露醇浓度增加而增加, 但不同浓度甘露醇胁迫下, OE株系拟南芥的主根长度均显著长于WT。
 | 图7 甘露醇胁迫下WT和OE株系拟南芥根长检测Fig.7 Measurement of primary root length of NtUFGT transgenic and wild-type A. thaliana under mannitol treatment (mean± SD, n=3) * P< 0.05; * * P< 0.01.下同The same below. |
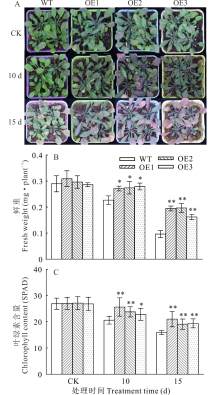
为了进一步探究NtUFGT基因对拟南芥耐旱性的影响, 分别对营养土中生长的WT和OE株系拟南芥进行干旱胁迫。正常浇水条件下, WT和OE株系长势没有明显差别。停止浇水10 d后, OE和WT株系拟南芥生长均受到抑制, 但OE株系长势明显优于WT, 其叶片由于积累更多的花青素而呈现紫色, 且随着干旱程度增加叶片紫色更加明显。测定各株系的鲜重和叶绿素含量, 发现干旱胁迫条件下OE株系的鲜重和叶绿素含量均显著高于WT(图8)。
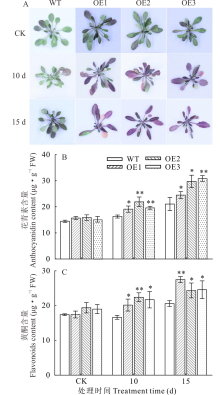
2.5.1 过表达NtUFGT促进了干旱胁迫下拟南芥花青素和黄酮积累 为了研究过表达NtUFGT是否对拟南芥中花青素和总黄酮含量产生影响, 分别检测了干旱胁迫(停止浇水10和15 d)下WT和OE株系拟南芥中花青素和总黄酮含量(图9)。结果表明, 相较于CK组, 干旱胁迫诱导了转基因拟南芥花青素和黄酮的积累, 随着干旱胁迫天数增加, 二者含量也随之增加。停止浇水15 d后, 3个OE株系拟南芥中花青素积累量比WT高36.67%, 总黄酮含量比WT高23.77%。表明在干旱胁迫下, NtUFGT基因能有效地促进转基因拟南芥中大量合成和积累花青素及黄酮。
2.5.2 NtUFGT提高了转基因拟南芥的抗氧化能力和渗透调节能力 为了探究过表达NtUFGT带来的次生代谢产物的超量积累对转基因拟南芥活性氧清除能力的影响, 测定了干旱胁迫前后植物的活性氧积累和氧化损伤程度。结果表明, 正常浇水条件下, WT和OE株系拟南芥H2O2和MDA含量无明显差异, 随着干旱天数的增加, 二者含量明显上升, 但OE株系中的含量显著低于WT, 且随着干旱程度的加剧, OE株系中H2O2和MDA含量的降低幅度更大, 停止浇水15 d后, OE株系中H2O2、MDA含量分别较WT株系低23.41%和14.46%(图10), 表明转基因拟南芥具有更强的活性氧清除能力。检测抗氧化系统中酶促抗氧化酶(POD、CAT)的活性和非酶促抗氧化剂GSH含量发现, 随着干旱胁迫程度加剧, 所有转基因株系中POD、CAT活性及GSH含量均显著上升(图10)。脯氨酸含量同样受干旱胁迫诱导显著上升, 停止浇水15 d后OE株系拟南芥脯氨酸含量达到196.35 μ g· g-1, 几乎为WT(105.66 μ g· g-1)的2倍(图10)。以上结果表明, 转NtUFGT基因拟南芥具有更强的抗氧化和渗透调节能力。对比停止浇水10和15 d的试验数据, 停止浇水15 d后WT和OE株系拟南芥抗逆性差异更为明显, 所以选取干旱15 d的拟南芥材料用于后续基因定量分析。
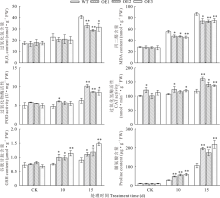 | 图10 干旱胁迫下拟南芥H2O2、MDA、Pro、GSH含量及POD、CAT活性Fig.10 H2O2, MDA, Pro, GSH contents and POD, CAT activity in A. thaliana under drought stress (mean± SD, n=3) |
2.5.3 NtUFGT促进了拟南芥抗逆相关基因的表达 利用qRT-PCR对WT和OE株系拟南芥抗逆相关基因进行定量分析, 结果发现, 干旱胁迫15 d, NtUFGT转基因拟南芥的抗氧化酶基因AtCAT1和AtPOD1、脯氨酸合成基因AtP5CS及抗逆相关基因AtRD29A的表达量均显著高于野生型(图11), 表明过表达NtUFGT基因提高了拟南芥抗氧化系统基因、渗透调节物质脯氨酸合成基因和抗逆相关基因的表达。
唐古特白刺作为我国西北荒漠地区重要的建群植物, 具有极强的抗干旱能力, 其体内含有丰富的花青素和黄酮类物质[23]。本研究克隆了唐古特白刺花青素合成途径的最后一个关键酶基因NtUFGT, 并成功转化拟南芥, 获得3个稳定遗传的NtUFGT转基因拟南芥株系。对野生型和转基因型拟南芥进行干旱胁迫分析发现, 相较于野生型, 转基因拟南芥根长、鲜重测量值和叶绿素含量更高, 表明转NtUFGT基因拟南芥具有更强的耐旱性, 这与之前在拟南芥[14]、玉米[16]、木姜子(Neolitsea sericea)[24]等植物中的研究相一致。
干旱胁迫会导致植物大量积累活性氧并造成氧化损伤[2]。在拟南芥[14]、烟草[7]、矮牵牛(Petunia hybrida)[25]中过表达花青素合成途径中调控或功能基因, 会造成花青素的大量积累同时增强植物的活性氧清除能力。研究表明, 花青素在植物抵抗干旱胁迫的过程中发挥着重要作用, 除了其自身直接参与活性氧的清除以外, 花青素还能全面提高植物抗氧化系统的活性, 降低植物的氧化损伤程度[26]。本研究发现, 转NtUFGT基因的拟南芥中, 花青素和总黄酮含量显著高于野生型。检测干旱胁迫下拟南芥抗氧化系统发现, 转基因型拟南芥中抗氧化酶相关基因AtCAT1、AtPOD1的表达量比野生型更高, 抗氧化酶(POD、CAT)活性和非酶抗氧化剂GSH含量均显著高于野生型, 同时转基因植物中H2O2和MDA含量显著减少, 表明NtUFGT基因促进了转基因拟南芥在干旱胁迫下花青素和总黄酮的持续积累, 而花青素的积累赋予了植物更高的活性氧清除能力。同时, 该基因通过提高转基因植物体内抗氧化酶基因的表达水平、抗氧化酶活性和抗氧化剂含量, 促进了植物体内整个抗氧化系统的活性氧清除效率, 从而有效地减轻由于干旱胁迫给植物带来的活性氧过量积累和氧化损伤。
脯氨酸作为水溶性最大的氨基酸, 被认为既是一种重要的细胞内渗透调节物质, 同时也能作为一种活性氧清除剂参与调节植物的氧化还原平衡[27]。有研究表明, 促进水稻(Oryza sativa)[28]、拟南芥[29]、小麦(Triticum aestivum)[30]等植物中花青素的积累, 可以增加逆境条件下脯氨酸的含量并增强植物的抗逆性。本研究发现, 干旱胁迫15 d时, 转基因型拟南芥中脯氨酸的含量几乎为野生型的2倍, 脯氨酸合成基因AtP5CS的表达量也显著高于野生型, 表明NtUFGT不仅能通过促进干旱胁迫下花青素和总黄酮积累来增强转基因拟南芥的抗氧化能力, 同时还能调节脯氨酸的合成来增强。转基因植物中大量积累的脯氨酸不仅维持了细胞的渗透平衡, 使转基因拟南芥具有更强的渗透调节能力, 同时, 大量积累的脯氨酸可能作为一种活性氧清除剂, 参与转基因植物氧化还原平衡的调节。
一定程度的非生物胁迫会引起植物抗逆相关基因的表达量上调[31]。有研究表明, 增加花青素含量可通过提高SOD, CAT和POD相关基因转录水平来提高盐胁迫下拟南芥幼苗的成活率[7, 32]。在本研究中, 干旱胁迫条件下转基因型拟南芥抗氧化酶相关基因AtCAT1、AtPOD1以及脯氨酸合成基因AtP5CS和抗逆相关基因AtRD29A的表达量均明显高于野生型拟南芥, 这可能是由于过表达NtUFGT基因促进了转基因拟南芥中花青素的积累, 而花青素的积累与植物的抗氧化活性呈正相关[31], 从而促进了抗逆相关基因的表达。
综上所述, 通过从唐古特白刺中克隆花青素合成路径中的关键基因类黄酮-3-O-葡萄糖基转移酶基因NtUFGT, 并成功转化拟南芥进行功能验证, 证实在干旱胁迫条件下, NtUFGT基因通过促进转基因拟南芥中花青素的积累来提高植物的抗氧化系统活性、渗透调节能力及抗逆相关基因的表达量, 从而提高拟南芥对干旱胁迫的耐受性。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|