作者简介:刘文文(1994-),女,安徽界首人,在读硕士。E-mail: 2497426062@qq.com
叶绿素含量直接影响植物光合效率,从而决定其生物量。叶绿素酸酯 a加氧酶(CAO)催化叶绿素酸酯 a转化成叶绿素酸酯b,是叶绿素合成的限速酶之一。本研究克隆了蒺藜苜蓿 MtCAO,该基因编码531个氨基酸。进化分析表明,MtCAO与双子叶植物的CAO亲缘关系较近。高等植物 CAO基因的结构保守,均含有9个外显子。 MtCAO主要在绿色组织尤其是叶片中高丰度表达。瞬时表达拟南芥原生质体试验显示,MtCAO-GFP融合蛋白定位于叶绿体。表达模式分析表明,茉莉酸甲酯(MeJA,100 μmol·L-1)及黑暗处理抑制 MtCAO的表达,而24 h内NaCl (100 mmol·L-1)及聚乙二醇(PEG,5%) 处理先诱导后抑制其表达,且该基因受昼夜节律调控。这与对 MtCAO启动子区顺式作用元件的预测结果一致。类似于超表达 AtCAO的拟南芥,超表达 MtCAO的拟南芥株系叶色正常,叶绿素含量及鲜重与野生型差异不显著,推测是由于 MtCAO高度保守的A结构域中的降解子导致的。
Plant biomass is determined by photosynthesis efficiency, which in turn is affected directly by the chlorophyll concentration. Chlorophyllide a oxygenase (CAO) is one of the three speed-limiting enzymes in the chlorophyll synthesis pathway, and catalyzes chlorophyllide a into chlorophyllide b. In this study, the open reading frame of Medicago truncatula CAO ( MtCAO), which encodes a protein of 531 amino acid residues, was cloned. Phylogenetic analysis demonstrated that MtCAO was closer to its dicot homologs than to those in more distantly related plant species. Different from CAOs in lower plants, CAOs in higher plants contain nine exons. MtCAO was preferentially expressed in green tissues, especially leaves. When transiently expressed, the MtCAO-GFP recombinant protein was localized in the chloroplast of Arabidopsis protoplast cells. The transcript of MtCAO was repressed by the treatment with methyl jasmonate (100 μmol·L-1) or darkness, but induced by NaCl (100 mmol·L-1) or PEG (5%) within 4 h then repressed until 12 h from application. Also, the expression of MtCAO fluctuated with the circadian clock. These results are consistent with the cis-element analysis of the MtCAO promoter. MtCAO was ecotopically expressed in Arabidopsis. The analysis of two independent transgenic lines revealed no significant difference in the content of chlorophyll, the chlorophyll a∶b ratio or shoot weight from the wild type. The results are similar to those from AtCAO overexpression Arabidopsis. Therefore, we postulate that the non-abnormal phenotype of the transgenic Arabidopsis constitutively expressing MtCAO probably results from the fact that the conserved A domain contains a “degron” motif, which was proven to hamper the elevation of AtCAO in Arabidopsis overexpressing AtCAO.
叶绿素是普遍存在于植物、藻类及蓝细菌等光合生物中的一类绿色色素。自然界中每年有几百万吨的叶绿素合成并降解[1]。叶绿素是一种四吡咯分子, 主要包括叶绿素a和叶绿素b。其中, 叶绿素a主要转化光能, 叶绿素b主要吸收光能。叶绿素a和叶绿素b吸收波段不同, 两种叶绿素的共同利用能够增加吸收光波长的范围[2]。叶绿素的生物合成是一个复杂的过程, 共由15种酶催化完成, 其中谷氨酰-tRNA还原酶、镁离子螯合酶及叶绿素酸酯 a加氧酶(chlorophyllide a oxygenase, CAO)是叶绿素合成过程中的3个限速酶。目前, 拟南芥(Arabidopsis thaliana)中已分离出27个编码叶绿素合成相关酶的基因[3]。Tanaka等[4]在研究莱茵衣藻(Chlamydomonas reinhardtii)的叶绿素b缺失突变体时初次发现了编码叶绿素酸酯a加氧酶的基因, 并命名为CAO。CAO主要将叶绿素a的前体物质叶绿素酸酯a的C7-甲基基团氧化成C7-甲酰基团, 从而催化叶绿素酸酯a转化成叶绿素酸酯b[5]。叶绿素酸酯b在叶绿素合酶的作用下, 迅速转化成叶绿素b[6]。在拟南芥、水稻(Oryza sativa)、大麦(Hordeum vulgare)、花叶矢竹(Pseudosasa japonica)及部分藻类植物中已经鉴定到了CAO基因[7, 8, 9, 10, 11]。通常, 植物CAO的缺失或过表达都直接影响叶绿素b的含量, 并改变叶绿素a/b的值[8, 9, 12, 13]。另外, 缺失CAO还会导致LHC蛋白无法积累, 从而影响叶绿体发育、光形态建成和叶绿体核信号传递[11, 14]。
植物通过调整叶绿素合成基因的表达水平来增强其对外界环境的适应性。例如, 在遮荫条件下, 耐阴品种的大豆(Glycine max)CAO表达量高于非耐阴品种[15]。缺铁处理后, 苹果(Malus sieversii)CAO及光合相关基因的表达量都增高[16]。同时, 高水平CAO能提高植物对逆境的耐受力。例如, 超表达CAO的烟草(Nicotiana tabacum)对强光的耐受力增强, 且产量增加[17]。相反的, 缺失CAO的水稻突变体活性氧含量增加、耐热性变差, 植株早衰且产量降低[18]。CAO还可以作为分子标记加速育种进程, 为植物遗传育种带来诸多便利。在水稻育种过程中将叶色变异作为标记, 用于苗期去除杂株[19]。过量表达CAO可以使植物出现滞绿现象, 有利于培育优质持绿干草[20], 而CAO缺失引起的叶色突变有利于培育新型花色的观赏植物。
蒺藜苜蓿(Medicago truncatula)因其与紫花苜蓿(Medicago sativa)亲缘关系较近, 已作为豆科模式植物被广泛研究。本研究克隆了编码蒺藜苜蓿叶绿素酸酯a加氧酶(MtCAO)基因, 利用生物信息学分析了其蛋白结构及功能保守区, 并研究了MtCAO的亚细胞定位及该基因在苜蓿组织、不同时间点和处理[黑暗、茉莉酸甲酯(methyl jasmonate, MeJA)、NaCl和聚乙二醇(polyethylene glycol, PEG)]条件下RNA水平的表达动态。通过对MtCAO超表达拟南芥植株的表型及叶绿素含量分析, 初步探讨了MtCAO的功能。研究结果从分子水平上揭示了MtCAO的表达调控特点及功能作用要素, 为通过分子手段培育高抗性持绿牧草提供了参考。
试验于2018年7月-2019年7月在中国农业科学院北京畜牧兽医研究所农业部牧草种质资源与育种重点实验室进行。
蒺藜苜蓿(生态型R108)种子保存于本实验室。种子用浓硫酸浸泡3 min, 清水冲洗置于4 ℃ 萌发后, 转于人工气候培养箱(光照16 h/黑暗8 h、温度26 ℃/22 ℃、相对湿度为60%), 待子叶张开后移至1/2霍氏营养液中(西美杰公司)生长, 每周更换一次营养液。
拟南芥(生态型Col-0)种子用10% NaClO消毒10 min, 无菌水清洗后种于1/2 MS固体培养基(8 g· L-1 琼脂粉, 15 g· L-1蔗糖)上。4 ℃ 48 h后转至人工气候培养箱(光照16 h/黑暗8 h, 温度22 ℃/20 ℃, 相对湿度为60%)生长至4片莲座叶后移入营养土(蛭石∶ 营养土=1∶ 1), 开花时用于遗传转化。
提取4周苗龄蒺藜苜蓿叶片总RNA(植物总RNA提取试剂盒, 艾德莱), 反转录成cDNA(Super RT cDNA第一链合成试剂盒, Takara)。PCR 扩增引物MtCAO-cDNA-F/R(表1)根据NCBI数据库(https://www.ncbi.nlm.nih.gov/)中蒺藜苜蓿MtCAO (XM_003589550.3)基因序列设计, 利用ExTaq DNA聚合酶(Takara)进行扩增。程序为:94 ℃预变性3 min, 94 ℃ 30 s、54 ℃ 30 s、72 ℃ 90 s循环25次, 最后72 ℃延伸5 min。扩增产物使用1%琼脂糖凝胶电泳, 回收(DNA纯化回收试剂盒, TransGen Biotech)。连接pCRTM8/GW/TOPO载体, 转化pTOPO-MtCAO至大肠杆菌(Trans-T1感受态, TransGen Biotech), 挑取阳性克隆测序(擎科生物公司)。
| 表1 试验所用引物 Table 1 Primers used in the study |
用ExPASy网站(https://www.expasy.org/)的ProtParam预测蛋白等电点及分子量, Prosite分析保守结构域和Protscale分析蛋白亲疏水性; 用SOPMA在线分析蛋白质二级结构(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html); 用Phobius在线分析蛋白质跨膜结构及信号肽(http://phobius.sbc.su.se/); 通过MEGA 7.0软件使用邻接法构建进化树, Bootstrap设置为1000次; DNAMAN (Version 7) 进行序列多重比对; 用Plantcare(http://bioinformatics.psb.ugent.be/webtools/plantcare/)分析MtCAO启动子区域(起始密码ATG上游2 kb)顺式作用元件。以上软件使用默认参数进行分析。
基因组织(根、茎、叶、花及果荚)表达分析所用材料来自两月龄蒺藜苜蓿(光8:00-24:00, 暗0:00-8:00)。同一生长期的蒺藜苜蓿, 从8:00开始每隔4 h取叶片, 用于分析一天中基因的表达动态变化。对于黑暗及MeJA(100 μ mol· L-1)处理, 4周苗龄的水培蒺藜苜蓿在处理0、4、8、12、24、48及72 h后收集叶片。对于NaCl (100 mmol· L-1)及PEG (5%)处理, 4周苗龄的水培蒺藜苜蓿在处理0、1、2、4、8、12及24 h后收集叶片。转基因拟南芥的鉴定材料来自2周龄叶片。利用荧光定量(SYBR Premix Ex Taq, Takara)在7300 Real Time PCR Systerm上进行扩增, 引物序列见表1。所有试验均设置3个生物学重复, 数据使用2-Δ Δ CT(Livak) 方法分析, 利用t检验进行显著性分析。
利用Gateway LR Clonase II Enzyme Mix(Invitrongen), 将测序正确的pTOPO-MtCAO与pMDC83表达载体进行同源重组, 获得35S::MtCAO-GFP融合表达载体。转化重组子至农杆菌(GV3101, 华越洋)。使用YEB液体培养基将农杆菌摇至OD600值为0.8~1.0, 离心收集菌体, 重悬浮于5% 蔗糖溶液(含0.02% Silwet L-77, 上海生工), 之后采用花序侵染法转化拟南芥[21]。成熟种子用潮霉素(5 mg· L-1)筛选转基因拟南芥。
提取两周苗龄的拟南芥叶片原生质体[22], 分别将35S::GFP及35S::MtCAO-GFP的质粒(500~800 ng· μ L-1)转入拟南芥原生质体中。28 ℃黑暗培养16 h后, 使用激光共聚焦显微镜(Leica SP-5, 日本)观察荧光。
采用乙醇浸泡法, 将4周苗龄拟南芥莲座叶(0.1 g)浸于10 mL乙醇(96%), 黑暗静置48 h至叶片完全脱色。使用超微量分光光度仪(德国)测定665、649和470 nm的吸光值, 分别计算叶绿素a及叶绿素b的浓度[23]。
采用Excel 2010进行统计分析, 结果以平均值± 标准误表示。用SOPMA、Phobius、TB tools、Excel 2010、MEGA 6.0等作图。
根据拟南芥CAO(At1g44446)查找蒺藜苜蓿的同源基因发现, 蒺藜苜蓿CAO由单基因(Mt1g030480)编码。利用生态型R108, 扩增到了MtCAO的开放阅读框(1596 bp), 编码531个氨基酸。对MtCAO蛋白的一级结构分析(expasy)显示, 蒺藜苜蓿CAO的相对分子质量为59.88 kDa, 理论等电点为8.18, 氨基酸的亲水性指数为-0.321, 属于亲水性蛋白。该蛋白二级结构(secondary structure prediction method, SOPMA)以无规卷曲及α -螺旋为主, 分别占41.24%和38.79%(图1A)。该蛋白的N端存在转运肽(1~16位氨基酸)(Phobius)(图1B), 推测该转运肽将CAO蛋白从细胞核引导至叶绿体发挥功能。蛋白结构域分析(Prosite)发现, MtCAO有3个保守基序:Rieske FeS, Mononuclear Fe及Unique site。根据蒺藜苜蓿数据库(http://plants.ensembl.org), MtCAO与已知上游最近的基因(Mt1g030505)相距3130 bp。本研究对MtCAO起始密码子(ATG)上游2 kb区域的分析(PlantCARE)结果显示, 该假定启动子区域主要包含光响应元件、茉莉酸甲酯响应元件、昼夜节律控制元件等调控元件(图1C)。
对13个物种中CAO同源基因的数目统计发现, 不同物种中CAO基因数目各异(表2)。根据植物碳(C)固定方式, 选取其中来自C3植物[包括拟南芥、蒺藜苜蓿、水稻、大豆、铁皮石斛(Dendrobium catenatum)、江南卷柏(Selaginella moellendorffii)、小立碗藓(Physcomitrella patens)和莱茵衣藻], C4植物[包括玉米(Zea mays)、高粱(Sorghum bicolor)]和景天酸代谢(crassulacean acid metabolism, CAM)植物凤梨(Ananas comosus)共11个物种的17个CAO蛋白, 进行进化分析(MEGA 7.0)(图2)。结果显示, 除来自水生植物莱茵衣藻的CrCAO外, 其他陆生植物的CAO同属于一个分支。其中, 低等陆生植物(包括江南卷柏和小立碗藓)与高等植物分别属于两个独立的亚支。高等植物中, 蒺藜苜蓿MtCAO与大豆和拟南芥的CAO属于双子叶植物组, 而来自单子叶植物(水稻、玉米等)的CAO属于另一组。以上结果表明, CAO在进化关系上符合植物从水生到陆生, 从低等到高等的进化过程, 而在植物光合作用碳同化方式(C3、C4或CAM)上并没有严格的区分。
| 表2 不同物种中编码CAO基因的信息 Table 2 Information of CAO encoding genes in the indicated species |
CAO基因的外显子数量分析表明, 水生植物莱茵衣藻CAO由5个外显子组成, 进化到低等陆生植物后外显子数目增加到8个, 高等植物CAO均含有9个外显子(表2)。从外显子长度上推测, 这可能是低等植物CAO的第一个外显子一分为二的结果。就单个外显子的长度而言, 不同物种中除含有非编码区(untranslated region, UTR)的外显子长度各异外, 其余外显子的长度大小相对一致。因此, CAO在植物由低等向高等进化的过程中, 转录本大小相对稳定, 内含子数目逐步增加。这一现象或许与高等植物的生存环境更加复杂多变有关。
氨基酸序列同源性分析显示, 蒺藜苜蓿MtCAO与双子叶植物CAO同源性较高, 其次为单子叶植物、低等陆生植物, 最后为低等水生植物。其中, 在高等植物中与大豆GmCAO3同源性最高(87.2%), 与拟南芥、水稻、玉米中CAO的同源性分别为75.8%、72.5%、和71.3%。结构域分析表明, 不同物种中的CAO主要包含3个保守区域:domain A, B和C。其中, domain A含有Degron(降解子)结构域, domain C中含有3个基序:Rieske FeS、Mononuclear Fe及Unique site[2]。蒺藜苜蓿CAO的domain A和C与拟南芥对应区域的同源性分别高达83.2%和81.1%, 暗示以上结构域的功能高度保守。
根据拟南芥的研究, AtCAO定位于叶绿体并参与叶绿素的合成[7]。为了研究MtCAO在细胞中的定位, 将MtCAO与GFP融合, 构建成35S::MtCAO-GFP重组表达载体, 并将35S::GFP及35S::MtCAO-GFP的质粒分别转入拟南芥原生质体中。荧光显微镜检测结果显示, 转化对照质粒(35S::GFP)的整个原生质体均有绿色荧光信号, 而转化质粒35S::MtCAO-GFP的原生质体中, 绿色荧光信号只在叶绿体中表达(图3)。该试验证明, 与拟南芥AtCAO一样, 叶绿体是MtCAO定位的特定细胞器。
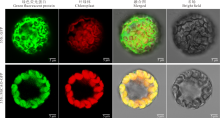 | 图3 MtCAO-GFP融合蛋白的亚细胞定位分析Fig.3 Subcellular localization of the MtCAO-GFP recombinant protein in Arabidopsis protoplast |
对蒺藜苜蓿根、茎、叶、花和果荚中MtCAO的表达量分析表明, MtCAO在以上组织中均有表达。其中, 绿色组织中表达水平明显高于根系, 且叶片中表达量最高, 约为根系中的31.8倍(图4A)。以上结果说明, MtCAO是一个广谱表达且具有组织偏好性的基因, 暗示MtCAO在植物绿色组织中发挥作用。
针对MtCAO启动子区域cis-element分析中有光响应元件、MeJA响应元件及昼夜节律响应等顺式调控元件(图1C), 研究了MtCAO 在相应处理下的表达情况。对蒺藜苜蓿在长日(光16 h/暗8 h)条件下24 h内不同时间点MtCAO的动态检测结果显示, 从光照(8:00)开始该基因的表达量迅速增加, 中午12:00达到最高值, 之后急剧下降, 到黑暗处理(24:00)时降到最低水平, 暗处理前后基本维持类似的低表达水平(图4B)。表明MtCAO在白天表达量高, 傍晚和凌晨低, 夜间表达量最低。即, 该基因的表达水平符合昼夜节律变化规律。进一步用长时间黑暗处理发现, 停止光照4 h后MtCAO的表达量开始降低(92%, P< 0.05), 随处理时间的延长表达水平急剧下降, 处理8 h后降到对照的20%, 到36 h时降到最低(11%, P< 0.05), 之后表达量在11%~20%波动(图4C)。以上结果表明, 黑暗处理抑制MtCAO的表达。另外, 在MeJA (100 μ mol· L-1)处理4 h时, MtCAO的表达量没有显著变化, 处理8和12 h后表达水平显著下降(12%; 18%, P< 0.05), 24 h时MtCAO的表达量急剧增加(110%, P< 0.05)。此后, 延长处理时间MtCAO的表达水平急剧降低(图4D)。即, 长时间MeJA处理抑制MtCAO的表达。短时间(< 4 h) NaCl (100 mmol· L-1)处理MtCAO的表达量显著增加(约140%, P< 0.05), 处理8 h时表达水平急剧下降(36%, P< 0.05), 到12 h时降到低谷(14%, P< 0.05), 24 h时MtCAO的表达量又达到处理前的水平(图4E)。类似的, PEG(5%)处理后MtCAO表达量呈现出先升高后降低, 最后接近未处理水平的变化趋势(图4F)。该结果表明, MtCAO对盐及干旱胁迫响应迅速, 处理1 d后MtCAO的响应减弱。综上所述, MtCAO的表达受光调节, 受MeJA及黑暗处理抑制, 而短时间(< 24 h)盐及干旱处理对MtCAO的表达是先诱导后抑制。
为了研究MtCAO在叶绿素合成途径中的作用, 采用花序侵染法将35S::MtCAO-GFP转化拟南芥, 使用潮霉素筛选得到超表达MtCAO的转基因拟南芥植株。对6个株系转基因植物(T2)的MtCAO转录水平验证表明, 与野生型相比, 转基因拟南芥中MtCAO异位表达, 且不同株系中表达量差异大。如: OE5和OE6两个株系的表达量分别为OE4的6.5和20.3倍(图5A)。由于各株系转基因植物的叶色与对照没有明显差别, 本研究选用OE5和OE6两个株系进行表型及定量研究(图5B)。对叶绿素a和叶绿素b的含量测定结果显示, 两个超表达株系(OE5 和OE6)的叶绿素b及总叶绿素含量与对照无显著差异, 而叶绿素a的含量略低于对照(图5C)。因而, 相对于野生型拟南芥, 两个超表达MtCAO的拟南芥株系的叶绿素a/b均没有发生显著变化(图5D)。这与Yamasato等[24]超表达AtCAO全长基因后观察到的转基因拟南芥叶绿素b含量与野生型差异不明显的现象一致。转基因植株的鲜重测量结果显示, 两个超表达MtCAO拟南芥株系与对照差异不显著(图5E)。推测由于叶绿素含量变化不显著, 对光合作用影响小, 因而转基因拟南芥的生物量变化没有达到显著性水平(P> 0.05)。
叶绿素酸酯a加氧酶(CAO)催化叶绿素酸酯a转化成叶绿素酸酯b, 是叶绿素生物合成过程中的限速酶之一。缺失该基因的突变体通常表现为叶色淡黄, 植株弱小[8, 10, 12]。本研究以豆科模式植物蒺藜苜蓿为材料, 克隆了蒺藜苜蓿叶绿素酸酯a加氧酶(MtCAO)并初步分析了该基因的进化关系、亚细胞定位、表达动态及转基因植物的表型。试验结果表明, 蒺藜苜蓿MtCAO 具有高等植物CAO的典型特点, 是蒺藜苜蓿叶绿素合成的重要基因。
双子叶植物蒺藜苜蓿的MtCAO与高等植物CAO进化关系近且高度保守。不同物种中编码CAO的基因数目各异, 似乎某些双子叶植物编码CAO的基因多于单子叶植物。总体来说, CAO依据从水生到陆生、从低等植物到高等植物的进化规律呈现出清晰的归属关系, 但CAO的进化分类似乎与植物的碳固定方式没有直接关系。CAO高度保守主要体现在基因结构一致和其氨基酸同源性高两个方面。首先, 植物CAO的内含子-外显子组成相似, 且外显子(不包括UTR)的长度一致。例如, 水生植物衣藻CAO有5个外显子, 到陆生植物, 其CAO外显子增加为8个(低等陆生植物)和9个(高等陆生植物)。从对应外显子大小上推测, 高等陆生植物CAO增加的1个外显子是低等陆生植物CAO的第一个外显子一分为二导致的。此外, CAO的功能结构域高度保守, 均含有3个关键的结构域(A, B和C domain)。其中, A结构域在积累CAO的过程中主要起抑制作用[25, 26]。B结构域不影响CAO的含量, 被推测为协助连接A和C结构域, 并为其提供足够空间, 辅助两者正常折叠[27]。C结构域中包含3个基序:Rieske FeS, Mononuclear Fe和Unique site[7]。其中, Rieske FeS及Mononuclear Fe传递电子并激活氧分子, 通过氧化叶绿素酸酯a的甲基, 将叶绿素酸酯a转化成叶绿素酸酯b[4]。大麦中Rieske铁硫结合区域的序列突变可以引起叶绿素b缺失、叶绿素a含量减少[28]。这是由于叶绿素b的减少, 使得光合作用的天线组装方式改变, 进而导致叶绿素a含量降低[18]。原核生物中部分蓝藻包括原绿球藻(Prochlorococcus)和原绿藻(Prochloron)含有CAO并产生叶绿素b[1], 但是原绿球藻和原绿藻的CAO均不含有A及B结构域, 暗示C结构域在原核生物叶绿素合成过程中发挥主要作用。
MtCAO的表达具有叶绿素合成基因的特点并受多种因素的影响。早年的研究表明, 水稻OsCAO1主要在光合组织中表达, 且表达水平受光诱导。oscao1突变体由于叶绿素b含量明显降低而呈现叶色浅绿的表型, 说明OsCAO1是水稻叶绿素合成的主效基因[8]。本研究对蒺藜苜蓿的研究显示, MtCAO定位于叶绿体中, 且MtCAO主要在绿色组织中表达。与非光合组织根相比, 叶片中MtCAO的表达量高达32倍。同时, MtCAO的表达受昼夜节律影响, 即光照4 h后表达量达到峰值, 之后表达水平逐步下降。事实上, 拟南芥中约有1/3的基因是受节律调节的[29]。其中, 叶绿素合成基因均与昼夜节律相关[30]。这是植物进化以适应地球光照规律, 增强光合作用提高自身竞争力的体现。叶绿素的合成过程也受光照时间的影响, 适当增长光照时间可以促进叶绿素的合成, 而长时间光照不足会导致叶绿素含量下降[31]。连续黑暗处理蒺藜苜蓿后, MtCAO的表达量显著降低, 说明叶绿素合成基因MtCAO的正常表达需要光照。本研究还发现MeJA处理显著抑制MtCAO的表达, 从而阻碍叶绿素的合成。这与通常植物受到机械损伤后MeJA含量增加, 叶色发黄相符[32]。另外, 短时间的NaCl及PEG处理对MtCAO的表达是先诱导后抑制。此外, 随着叶片的发生、成熟和衰老, 叶绿素经历从生成到降解的过程[33]。因此, 叶绿素的含量还可以作为植物营养胁迫、光合能力和发育各阶段的指示剂[34]。所以, 研究叶绿素合成相关基因对植物育种具有重要意义。
MtCAO的A结构域可能直接影响其功能。超表达MtCAO于拟南芥发现, 两个高丰度表达MtCAO的转基因拟南芥株系叶色没有明显变化, 叶绿素a、叶绿素b的含量和鲜重与对照Col-0差异不显著。Sakuraba等[25]分别将全长AtCAO和缺失A结构域的AtCAO转入拟南芥, 前者CAO没有积累且叶绿素b含量与野生型含量差异不显著, 但缺失A结构域的转基因株系中, B、C结构域在蛋白水平上大量积累且叶绿素b含量明显升高。 Sakuraba等[26]进一步证明A结构域存在降解子, 推测叶绿素b的积累能够改变A结构域的构象, 使得A结构域中的降解子能与某些蛋白酶结合, 从而造成CAO的降解。MtCAO与拟南芥CAO高度同源(75.8%), 尤其是A结构域(83.2%), 且都含有被称为"降解子"的短肽序列(QDV/LLTIML/ILH)。本研究推测, 类似于超表达拟南芥全长CAO, 异位表达MtCAO的拟南芥在转录水平上MtCAO的高丰度表达可能并不影响蛋白水平的表达。暗示MtCAO的A结构域中预测的降解子起作用, 从而平衡超表达CAO植物体内叶绿素a/b的值, 使植物以最高的效率吸收光能并进行光合作用。后期试验将分析超表达植物中蛋白水平上MtCAO的变化, 并研究超表达缺失A结构域的MtCAO转基因植物的表型及叶绿素相关指标, 为进一步揭示苜蓿CAO基因的功能提供直接的试验证据。
本研究通过克隆蒺藜苜蓿叶绿素酸酯a加氧酶(MtCAO)基因, 并根据CAO基因结构和氨基酸序列分析多物种中的进化关系, 发现CAO广泛存在于绿色光合生物中, 且植物尤其是高等植物的CAO高度保守。亚细胞定位和MtCAO的组织特异性表达都体现出作为叶绿素合成限速酶之一的CAO与叶绿素合成器官叶绿体紧密相关。同时, MtCAO的表达符合昼夜节律, 受MeJA和黑暗抑制, 也受短时间盐及干旱处理的影响。类似于前人对拟南芥CAO的研究, 异位表达MtCAO于拟南芥没有明显改变转基因植物的叶色及叶绿素含量, 推测是两者高度同源(83.2%)的A结构域中存在降解子导致。该研究结果对深入揭示苜蓿CAO基因功能, 进一步培育高光能利用效率的苜蓿新品种具有重要的理论意义。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|






