作者简介:魏鹏(1989-),男,新疆奇台人,助理研究员,在读博士。E-mail: xkyweipeng@163.com
荒漠草地占新疆草地总面积的46.9%,不同荒漠类型的气候差异显著,植被和土壤类型也各不相同。以准噶尔盆地大面积分布的3种代表性荒漠植被类型(南缘伊犁绢蒿荒漠、腹地白梭梭荒漠和北缘盐生假木贼荒漠)为研究对象,应用高通量测序技术,分析比较3种荒漠植被类型的土壤细菌群落组成和多样性特征。结果表明:放线菌门、变形菌门、绿弯菌门、酸杆菌门、芽单胞菌门和拟杆菌门是准噶尔盆地荒漠土壤中6个主要优势类群细菌,其相对丰度累计超过94%。放线菌门在3种荒漠类型中相对丰度最高,均超过50%,但差异不显著( P>0.05);酸杆菌门在伊犁绢蒿荒漠中相对丰度最高,厚壁菌门在白梭梭荒漠丰度最高,拟杆菌门在盐生假木贼荒漠丰度最高,且这3种菌门在3种荒漠类型中差异显著( P<0.05);在3种荒漠类型中,白梭梭荒漠细菌操作分类单元(OTU)数最少,多样性最低。Pearson相关性分析和RDA分析结果均表明,年均降水量和土壤有机碳是影响细菌群落结构组成和多样性最显著的环境因子。
Desert grassland accounts for 46.9% of the total grassland area in Xinjiang, with different desert types in areas of different climate, each with significantly different vegetation and soil types. Three representative desert vegetation types: Seriphidium transiliense desert in the southern margin, Haloxylon persicum desert in the hinterland and Anabasis salsa desert in the northern margin of the Junggar Basin, were chosen for study. The bacterial community composition and diversity characteristics of the three desert vegetation types were analyzed and compared using a high-throughput sequencing technique. It was found that Actinobacteria, Proteobacteria, Chloroflexi, Acidobacteria, Gemmatimonadetes, and Bacteroidetes were the six dominant groups of bacteria in these Junggar Basin soils. The cumulative abundance was more than 94%. Actinobacteria had the highest relative abundance (>50%) in all three desert types, and the difference between desert types for relative abundance of Actinobacteria was not significant ( P>0.05). Acidobacteria had a relative abundance in S. transiliense desert notably higher than in other desert types, while Firmicutes bundance was higher in H. persicum desert than in other desert types, and Bacteroidetes had the highest relative abundance in A. salsa desert, and these differences were significant ( P<0.05). Among the three desert types, the number of bacterial operational taxonomic units in H. persicum desert was the lowest and the community diversity was the lowest. Pearson correlation and redundancy analyses showed that average annual precipitation and soil organic carbon are the most significant environmental factors affecting the composition and diversity of the bacterial communities studied.
准噶尔盆地荒漠位于新疆北部, 是北疆重要的春秋冬三季放牧地, 有着重要的生态、经济和社会地位[1], 但由于人类盲目过度放牧和不当开垦等活动, 严重削弱了荒漠草地的生产功能和生态功能, 导致群落稳定性较低, 同时由于荒漠气候干燥, 降水较少, 造成植被稀疏、结构与营养级较少, 导致荒漠生态系统极其脆弱, 一旦破坏, 恢复困难[2], 严重影响了荒漠草地健康的可持续发展。
在荒漠草地中, 以土壤细菌为主的土壤微生物具有重要的生态功能, 其数量巨大、种类繁多, 构成了地球上大部分的遗传多样性[3], 是联系不同圈层物质与能量交换的重要纽带, 同时, 土壤细菌促进了土壤养分的形成、发育与分解[4, 5]; 土壤细菌是环境变化的敏感指标, 其组成和多样性与气温、降水以及土壤pH、有机碳和全氮等含量密切相关[6], 并对调控生态系统功能和过程方面发挥着重要作用[7, 8]。因此, 作为新疆重要的草地资源-准噶尔盆地荒漠, 研究环境因子对土壤细菌的影响及其响应是必要的。目前, 针对准噶尔盆地荒漠的研究大多集中于植物多样性格局、植物多样性对人类扰动(放牧、禁牧)的响应以及单一植被类型土壤微生物分布状况[9, 10, 11, 12, 13]等。研究表明, 土壤细菌群落大尺度空间分布的研究报道较少[14]。本研究选取准噶尔荒漠中大面积分布的3种代表性荒漠植被类型:南缘的伊犁绢蒿(Seriphidium transiliense)荒漠、腹地的白梭梭(Haloxylon persicum)荒漠和北缘的盐生假木贼(Anabasis salsa)荒漠作为对象, 通过高通量测序技术及土壤理化性质的相关性研究, 分析不同荒漠类型土壤细菌群落组成和多样性特征, 探讨影响其群落组成的主要环境因子。本研究不仅可以增进对准噶尔荒漠土壤细菌群落空间变化规律的认识, 还可为深入了解荒漠生态系统结构和功能, 建立合理管理措施提供重要依据。
研究区位于准噶尔盆地(N 43° 57'-47° 01', E 85° 52'-88° 12', 海拔350~1100 m), 属典型的中温带荒漠气候, 气候变化强烈, 年较差、日较差变化大, 年均温度4~10 ℃, 年均降水量50~150 mm, 山麓地带一般不超过200 mm。
伊犁绢蒿荒漠分布在准噶尔盆地南缘、天山北坡黄土覆盖的低山丘陵及山前冲积扇, 土壤为灰钙土或棕钙土, 建群种为伊犁绢蒿, 伴生种有木地肤(Kochia prostrata)、猪毛菜(Salsola collina)、新疆针茅(Stipa sareptana)、短柱苔草(Carex turkestanica)等。
白梭梭荒漠分布在准噶尔盆地腹地库尔班通古特沙漠的沙丘上, 建群种为白梭梭, 伴生种有角果藜(Ceratocarpus arenarius)、叉毛蓬(Petrosimonia sibirica)、双穗麻黄(Ephedra distachya)、对节刺(Horaninowia ulicina)等。
盐生假木贼荒漠分布在准噶尔盆地北缘, 处于乌伦古河和额尔齐斯河之间的古老阶地上。土壤为碱化或盐化的灰棕漠土, 土壤机械组成为沙砾质、砾质或壤质。建群种为盐生假木贼, 伴生种有心叶驼绒藜(Ceratoides ewersmanniana)、木地肤、木本猪毛菜(Salsola arbuscula)等。
以准噶尔盆地南缘的伊犁绢蒿荒漠、腹地的白梭梭荒漠和北缘的盐生木贼荒漠为研究对象, 于2018年9月11-18日在荒漠植物生长的高峰期进行野外取样1次。根据《1∶ 1000000中华人民共和国植被图》[15]、《新疆植被及其利用》[16]和野外实地踏查, 在每个荒漠类型选取10个样点(其中一个为国家固定监测点, 剩余9个点按照公里网格法布置)共计30个样点。每个样点随机设置5条样带(样带间距大于50 m), 土壤样品总数为150个(30个样点× 5条样带)。
1.3.1 土壤样品的采集 土壤样品通过5点法采集, 用土钻采集0~20 cm深度的土样, 将5个点土样捡出砾石、植物根系等杂物后, 混匀过2 mm筛, 将混合土样分为2份, 一份装入无菌密封袋置于-20 ℃车载冰柜中, 用于细菌多样性测定, 另一份放入布袋中, 常温风干保存, 用于土壤养分测定。
1.3.2 土壤养分测定 土壤养分测定参照鲁如坤[17]主编的《土壤农化分析方法》, 测定指标主要包括:电导率、pH、有机碳、全氮、全磷。
1.3.3 土壤微生物DNA提取、测序及处理 土壤DNA的提取主要参考Zhou等[18]的方法进行。利用土壤基因组DNA提取试剂盒先粗提土壤样品DNA, 然后利用0.8%的低熔点的琼脂糖凝胶对样品DNA进行纯化, 选用紫外分光光度计(NanoDrop ND-1000, Thermo Fisher Scientific, Waltham, MA, USA)对DNA定量。选用细菌16S rDNA V4区特异性引物, 520F(5'-barcode+AYTGGGYDTAAAGNG-3'), 802R(5'-TACNVGGGTATCTAATCC-3')进行PCR扩增。采用NEB Q5 DNA高保真聚合酶。
利用Illumina公司的TruSeq Nano DNA LT Library Prep Kit进行建库, 对合格的文库, 在MiSeq机器(Illumina)上, 上海派森诺生物科技股份有限公司利用MiSeq Reagent Kit V3(600 cycles)进行2× 300 bp的双端测序。通过QIIME软件[19]对原始数据(raw data)进行Reads拼接、Tags过滤, 嵌合体去除, 得到有效数据。有效序列按照97%的一致性聚类成为操作分类单元(operational taxonomic units, OTU), 并采用SILVA数据库Release115[20]对OTU进行注释。
采用QIIME软件计算土壤细菌的多样性值, 包括OTU数、Shannon-Wiener指数、ACE指数和Chao1指数。利用SPSS 22.0软件对环境因子进行单因素和多因素方差分析、Duncan显著性检验及Pearson相关性分析。利用R软件进行冗余分析(redundancy analysis, RDA)。
对取样点的土壤因子和气候因子进行调查和指标计算(表1)。3种荒漠类型土壤均为碱性, 且差异显著(P< 0.05), pH大小排序为:盐生假木贼荒漠> 白梭梭荒漠> 伊犁绢蒿荒漠。3种荒漠类型土壤电导率为218.90~296.20 μ s· cm-1, 盐生假木贼荒漠电导率显著高于其他2种类型。伊犁绢蒿荒漠土壤有机碳含量最高, 为18.34 g· kg-1; 盐生假木贼荒漠次之, 为13.37 g· kg-1; 白梭梭荒漠最低, 仅为3.26 g· kg-1。土壤全氮含量的变化规律和有机碳的变化规律较为相似, 伊犁绢蒿荒漠土壤全氮含量最高, 为1.31 g· kg-1, 白梭梭荒漠、盐生假木贼荒漠土壤全氮含量分别是伊犁绢蒿荒漠的13.74%和37.40%。白梭梭荒漠土壤全磷含量显著低于其他2种荒漠类型(P< 0.05)。3种荒漠类型年均降水量差异显著(P< 0.05), 盐生假木贼荒漠年均降水量比伊犁绢蒿荒漠和白梭梭荒漠分别高34.19%和121.01%。白梭梭荒漠年均温最高为9.14 ℃, 显著高于伊犁绢蒿荒漠和盐生假木贼荒漠(P< 0.05)。
| 表1 不同荒漠类型环境因子比较 Table 1 Summary of environmental parameters in different desert types |
伊犁绢蒿荒漠9个样品, 共含有443007条有效序列。白梭梭荒漠9个样品, 共含有415194条有效序列。盐生假木贼荒漠9个样品, 共含有431789条有效序列。对有效序列按97%的序列相似度进行归并和OTU划分, 按照每个OTU在每个样本中所包含的序列数, 构建OTU丰度矩阵, 并对获取的每个样本的序列总数进行随机抽样, 以抽取到的序列数与其对应的OTU数构建稀疏曲线(图1), 3种荒漠类型土壤样品的稀疏曲线均趋于平坦, 表明测序结果已足够反映当前样本所包含的多样性。
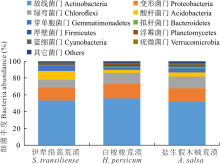
细菌优势类群相对丰度在不同荒漠类型中存在一定的差异(图2)。放线菌门(Actinobacteria)、变形菌门(Proteobacteria)和绿弯菌门(Chloroflexi)在荒漠土壤中相对丰度较高, 均超过10%, 是荒漠中的优势类群。另外酸杆菌门(Acidobacteria)、芽单胞菌门(Gemmatimonadetes)和拟杆菌门(Bacteroidetes)在荒漠土壤中的相对丰度超过1%, 是荒漠中主要细菌群落。其中放线菌门相对丰度在荒漠中占比最高, 在各类型中均超过50%, 其相对丰度从白梭梭荒漠、伊犁绢蒿荒漠到盐生假木贼荒漠逐渐降低。变形菌门相对丰度由高到低依次为:白梭梭荒漠> 盐生假木贼荒漠> 伊犁绢蒿荒漠。绿弯菌门相对丰度在盐生假木贼荒漠最高, 伊犁绢蒿荒漠最低。酸杆菌门在伊犁绢蒿荒漠丰度为10.15%, 显著高于白梭梭荒漠和盐生假木贼荒漠。
3种荒漠类型土壤细菌Alpha多样性结果见表2。伊犁绢蒿荒漠平均OTU数量为3153, 白梭梭荒漠平均OTU数量为2857, 盐生假木贼荒漠平均OTU数量为3133, 伊犁绢蒿荒漠和盐生假木贼荒漠土壤OUT分别比白梭梭荒漠土壤OTU显著高了10.36%和9.66%(P< 0.05)。Chao1指数和ACE指数在3种荒漠类型中差异不显著(P> 0.05), 盐生假木贼荒漠和伊犁绢蒿荒漠的Shannon-Wiener指数显著高于白梭梭荒漠(P< 0.05)。
| 表2 不同荒漠类型细菌群落多样性 Table 2 Diversity of bacteria communities in different desert types |
在荒漠中, 细菌OTU数与土壤有机碳、全磷和年均降水量呈极显著正相关关系(P< 0.01), 与全氮呈显著正相关关系(P< 0.05), 与年均气温呈极显著负相关关系(P< 0.01)。Shannon-Wiener指数与土壤有机碳、全磷和年均降水量均呈极显著正相关关系(P< 0.01), 与年均气温呈极显著负相关关系(P< 0.01)。Chao1指数与全磷和年均降水量呈极显著正相关关系(P< 0.01), 与土壤有机碳呈显著正相关关系(P< 0.05), 与年均气温呈极显著负相关关系(P< 0.01)。OTU数、Shannon-Wiener指数和Chao1指数与pH和电导率均无显著相关关系(表3)。
| 表3 土壤细菌多样性与环境因子相关关系 Table 3 Correlation between soil bacteria diversity and environmental factors |
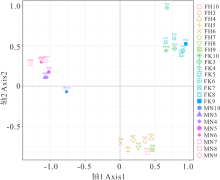
基于UniFrac距离的非度量多维尺度分析(non-metric multidimensional scaling, NMDS)表明, 不同荒漠类型的土壤细菌群落结构显著不同。伊犁绢蒿荒漠、白梭梭荒漠和盐生假木贼荒漠细菌群落结构明显不同, 细菌群落沿不同荒漠类型在空间上产生聚集(图3)。
根据所检测的所有环境变量, 将不同荒漠类型细菌优势群落组成趋势对应分析(detrended correspondence analysis, DCA), 排序轴的最大值为1.924, 所以采取冗余分析(RDA)。在整个研究区域, 影响细菌群落的7个环境因子(主要有年均气温、年均降水量、土壤全钾、全氮、全磷、土壤有机碳、土壤pH)对群落物种分布的影响具有显著性(P=0.001); 7个环境因子对物种分布总的解释量为49.25%, 其中轴1和轴2能解释33.85%(图4a)。影响伊犁绢蒿荒漠细菌群落的环境因子主要有年均降水量、年均气温、土壤有机碳和土壤pH, 相关系数分别为0.453、0.386、0.438、0.385(图4b); 影响白梭梭荒漠细菌群落的环境因子主要有年均降水量、土壤pH和土壤全氮, 相关系数分别为0.413、0.788、0.516(图4c); 影响盐生假木贼荒漠细菌群落的环境因子主要有年均降水量、土壤有机碳和电导率, 相关系数分别为0.414、0.398、0.687(图4d)。
土壤是草地植被的立地条件, 是生物与非生物环境之间进行物质与能量交换的重要纽带[21]。在荒漠地区, 土壤有机碳、盐分和降水量是影响草地类型成因的关键因子[22, 23, 24], 这3种荒漠类型存在明显的空间降水梯度, 其土壤理化性质差异显著(表1)。伊犁绢蒿荒漠分布在天山北坡黄土覆盖的低山丘陵及山前冲积扇, 土壤养分、水分以及温度综合条件都要比盐生假木贼荒漠和白梭梭荒漠要好; 白梭梭抗旱、抗热性都很强, 喜光, 根系发达, 防风固沙能力强, 故分布在准噶尔盆地沙漠地区的沙丘或厚层沙地上; 准噶尔荒漠北部额尔齐斯河与乌伦古河的古老阶地属于盐碱荒漠, 土壤为盐化石膏灰棕荒漠土, 故形成了大面积分布的盐生假木贼荒漠。
土壤细菌群落组成与草地类型之间相互适应、相互影响[25]。本研究表明, 3种荒漠类土壤细菌群落主要由放线菌门、变形菌门、绿弯菌门、酸杆菌门、芽单胞菌门和拟杆菌门6个优势类群组成, 这与前人研究结果相似[26]。细菌优势类群相对丰度在不同草地类型中存在差异。例如, 许多研究表明酸杆菌门、厚壁菌门和放线菌门是不同荒漠类型土壤细菌的优势群落[27, 28]。如图3所示, 放线菌门、变形菌门和绿弯菌门细菌是3种荒漠类型中的优势类群。其中放线菌门在白梭梭荒漠相对丰度最高, 盐生假木贼荒漠最低, 说明放线菌门具有低的水分耐受性, 这与前人研究结果相似[29, 30]。酸杆菌门相对丰度在伊犁绢蒿荒漠最高, 白梭梭荒漠最低, 说明这一类群可能对土壤碳获得性或者土壤pH比较敏感, 已有研究表明这一类群主要由土壤pH驱动, 与土壤pH呈负相关[31]。绿弯菌门在盐生假木贼荒漠丰度最大, 在伊犁绢蒿荒漠丰度最低, 说明这一类群具有耐盐或者嗜盐的特性。
前人关于土壤细菌地理格局的研究大部分表明, 土壤pH是影像其群落组成和多样性的关键环境因子[32, 33]。本研究采用Pearson相关性分析得出影响研究区域细菌群落组成和多样性是由降水量和土壤有机碳含量决定的; 通过非度量多维尺度分析(NMDS)和RDA分析结果表明, 不同荒漠类型中细菌群落组成和影响其群落结构的环境因子明显不同(图3和图4), 但同样得出, 年均降水量和土壤有机碳是影响3种荒漠类型的共有环境因子, 而不是土壤pH, 分析其原因可能为研究的区域位于荒漠区, 土壤均呈碱性, 故而模糊了土壤pH的影响, 研究区域地上植被稀疏, 仅有一些短命植物, 耐旱小半灌木、灌木以及乔木, 使得降水量和土壤养分成为其关键的限制性环境因子。
放线菌门、变形菌门、绿弯菌门、酸杆菌门、芽单胞菌门和拟杆菌门是准噶尔荒漠土壤细菌群落的6个主要优势类群。
白梭梭荒漠的土壤细菌OTU数和Shannon-Wiener指数显著低于伊犁绢蒿荒漠和盐生假木贼荒漠, 而伊犁绢蒿荒漠和盐生假木贼荒漠二者之间Alpha多样性差异不显著。
年均降水量和土壤有机碳是影响细菌群落组成和多样性特征最主要的环境因子, 其中年均降水量和土壤有机碳与其呈极显著正相关。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|