作者简介:王春明(1979-),女,甘肃武威人,副研究员,硕士。E-mail: wchm179@126.com
2017年10月在河北省黄骅市发现二月兰的一种叶部病害,感病叶片初生黑褐色、形状不规则的小病斑,后逐步发展成为具有明显同心轮纹状病斑,平均病株率和病叶率分别为96.2%和87.6%。为了明确该病害的致病菌,以组织分离法进行病原物的分离培养,对分离得到的菌落进行纯化和单孢分离后,选取代表性菌株GS1-1、HH2-1和HH3-1按照柯赫氏法则进行致病性测定,均能引起二月兰叶斑病。并对这3个菌株进行rDNA-ITS和 EF-1 α(tef)序列分析,结果表明,菌株GS1-1、HH2-1和HH3-1的ITS序列均与甘蓝链格孢(MN173824、MN173825、MN173823、MF462311)相似性达99%以上,其中与甘蓝链格孢(MF462311)相似性达100%;GS1-1、HH2-1和HH3-1的 EF-1 α基因序列与甘蓝链格孢(JX213350、KF889266、KT895946、KC584642、LC480212和KT895946)的亲缘关系最近,同源性达99%,且和以上各自对应的菌株在系统发育树上聚为一类,与形态学鉴定结果相一致。选取菌株GS1-1进行生物学特性研究,结果表明该菌株最适营养生长和产孢的培养基为马铃薯蔗糖琼脂培养基,最适营养生长的碳源和氮源分别为麦芽糖和蛋白胨,最适产孢的碳源和氮源分别为葡萄糖和酵母膏;最适菌丝生长温度为25 ℃(在5~35 ℃均可生长),最佳产孢温度为28 ℃;12 h光暗交替条件促进菌丝营养生长和产孢。
A leaf spot disease was found on Orychophragums violaceus in Huanghua City, Hebei Province, during October of 2017. The infected leaves were initially black and brown with irregular small disease spots, which gradually developed into necrotic spots with concentric circles, affecting 96.2% of plants observed and 87.6% of leaves on each plant. In order to identify the pathogen, samples were isolated from infected leaves by tissue separation and cultured. After purification, three isolates were obtained (GS1-1, HH2-1, and HH3-1), and their pathogenicity tested according to Koch’s rule. Test results confirmed that the three isolates reproduced the original symptoms and were therefore the causative agent of the observed O. violaceus leaf spot disease. For the three isolates, DNA was extracted, amplified and sequenced by rDNA-ITS, and the results showed the three isolates had a very close relationship to Alternaria brassicicola (MN173824, MN173825, MN173823 and MF462311), and 100% similarity with A. brassicicola (MF462311). The results also showed a very close relationship of the three isolates to certain other A. brassicicola isolates (JX213350, KF889266, KT895946, KC584642, LC480212 and KT895946) through EF-1 α gene sequencing, which was consistent with the results of morphological identification. The vegetative growth and sporulation conditions of isolate GS1-1 were studied by biological methods. It was found that the optimal medium for vegetative growth and spore production of isolated GS1-1 was PSA, and the optimal carbon and nitrogen sources for vegetative growth were maltose and peptone, respectively. The optimal carbon and nitrogen sources for sporulation were glucose and yeast extract, respectively. The optimal colony growth temperature was 25 ℃, with the temperature range over which colony growth occurred being 5-35 ℃, and the optimal spore production temperature was 28 ℃. Alternate 12 h light and dark periods promoted colony growth and sporulation.
二月兰(Orychophragmus violaceus), 又名诸葛菜, 为十字花科诸葛菜属二年生草本植物, 因农历二月前后盛开蓝紫色花, 故称二月兰[1]。由于其耐寒、耐阴性强, 对土壤光照等条件要求较低, 易于栽培, 普遍分布于中国华北、东北地区及北方各省市, 常野生于平原、山地、路旁、地边或杂木林缘, 可用作地被, 具有食用、饲用和观赏价值, 其景观绿化成效较为突出[2, 3]。同时, 又可榨取高档食用油, 还能提取油酸, 是很好的保健品添加剂[4]。目前, 二月兰也被作为重要的绿肥在生产上推广应用, 华北地区利用二月兰良好的越冬性已构建了二月兰— 春玉米(Zea mays)的生产模式, 此模式不仅解决了华北地区冬春季节农田土壤裸露问题, 改善华北地区冬春季节生态环境, 并且翻压二月兰能够提高春玉米产量、降低化肥用量、增加肥料利用率[5]。赵秋等[6]研究表明, 二月兰对盐渍化土壤具有有效的培肥效果; 梁金凤[7]发现二月兰翻压可以增加土壤有机质及有效养分, 改善土壤结构, 提高土壤肥力进而改善农田土壤, 增加农作物产量。杨璐等[8]通过研究发现, 翻压二月兰能影响玉米干物质积累和养分吸收等, 由于二月兰有一定的养分供应能力, 翻压后能显著提高玉米生物量、籽粒产量及养分吸收量, 并随二月兰翻压量增加而呈上升趋势。
然而, 随着二月兰种植面积的进一步扩大, 其病虫害逐渐成为影响产量和品质, 以致限制广泛推广应用的主要因素之一。2017年10月30日在河北省黄骅市对二月兰病虫害进行调查时发现二月兰上的一种叶斑病, 严重影响了二月兰叶片的光合作用, 使其生物产量受损。为此, 本试验对河北省黄骅市二月兰叶斑病进行病样采集、病原菌室内分离纯化、致病性测定、形态学观察及核糖体DNA内转录间隔区(rDNA-ITS)和翻译延伸因子1α (EF-1α )序列分析确定其致病菌分类地位, 并对其生物学特性进行研究, 以期为二月兰叶斑病的发病规律、防治提供理论依据。
供试培养基:马铃薯葡萄糖琼脂(potato dextrose agar, PDA)培养基(马铃薯200 g, 葡萄糖15 g, 琼脂粉12 g, 蒸馏水1000 mL), 马铃薯蔗糖琼脂(potato sucrose agar, PSA)培养基(马铃薯200 g, 蔗糖15 g, 琼脂粉12 g, 蒸馏水1000 mL), 马铃薯糖(potato dextrose, PD)培养液(马铃薯200 g, 葡萄糖15 g, 蒸馏水1000 mL), 玉米叶粉培养基(玉米叶粉末20 g, 葡萄糖15 g, 琼脂12 g, 蒸馏水1000 mL), 燕麦培养基[燕麦片200 g(煮好后过滤), 葡萄糖15 g, 琼脂12 g, 蒸馏水1000 mL], 玉米粉琼脂培养基[玉米粉200 g(煮好后过滤), 葡萄糖15 g, 琼脂12 g, 蒸馏水1000 mL], LB(Luria-Bertani)固体培养基(胰蛋白胨10 g, 酵母提取物5 g, 氯化钠10 g, 琼脂12 g, 蒸馏水1000 mL), 碳氮源基础培养基为查氏培养基[硝酸钠3 g, 磷酸氢二钾1 g, 硫酸镁(MgSO4· 7H2O) 0.5 g, 氯化钾0.5 g, 硫酸亚铁0.01 g, 蔗糖30 g, 琼脂12 g, 蒸馏水1000 mL]。
试剂及仪器:琼脂粉、葡萄糖、蔗糖、乳糖、麦芽糖、果糖、可溶性淀粉、DL-天冬酰胺、牛肉膏、酵母膏、硝酸钾、硝酸钠、硫酸铵、蛋白胨、尿素, 购自甘肃瑞通生物科技有限公司; 真菌基因组DNA 快速提取试剂盒购自生工生物工程(上海)股份有限公司; SPX-400IC型人工气候培养箱(上海博讯实业有限公司医疗设备厂); DYY-12型电泳仪(北京市六一仪器厂); 7500 ABI Real-Time PCR System(美国ABI公司); OLMPUSIX 71倒置光学显微镜(日本OLMPUS公司)。
1.2.1 病样调查及症状观察 于2017年10月, 在河北省黄骅市发现二月兰叶斑病, 采集具有典型发病症状的二月兰叶片, 观察并记录病害症状, 并带回实验室进行分离。
1.2.2 病原菌分离纯化 采用组织分离法[9], 将二月兰病斑的病健交界处用灭过菌的剪刀取 5 mm× 5 mm大小的组织块, 将组织块浸泡在75%乙醇中30~60 s 进行表面消毒, 无菌水冲洗3 次后, 用灭菌的滤纸吸干组织块表面水分, 用灭菌的镊子夹至PDA平板上, 每皿放5个组织块, 置于培养箱中, 25 ℃倒置恒温黑暗培养。待材料边缘长出菌丝后根据颜色和形态的差异挑取不同菌落按常规微生物学方法分离, 单孢纯化后编号并转接到PDA斜面上4 ℃保存。
1.2.3 致病性测定 孢子悬浮液的制备:将供试菌株接种到PDA平板上培养1周后, 用无菌水冲洗分生孢子, 用血球计数板配制成浓度为1× 105个· mL-1孢子悬浮液。
接种方法:采用孢子悬浮液喷雾接种法, 2017年11月1日将二月兰种子在55 ℃温水中进行温汤浸种表面消毒, 晾干后播种于装有灭菌基质的花盆中, 每盆播种二月兰种子30粒, 放置于玻璃温室正常培养, 出苗后选取长势一致的二月兰植株, 每盆留苗20株。于二月兰3~4叶期(2017年11月18日), 使用小喷壶将添加0.5%吐温-20的孢子悬浮液均匀喷雾接种到健康的二月兰叶片上, 对照接种喷雾0.5%吐温-20, 之后正常温室管理, 逐天观察发病症状并照相。
1.2.4 病原菌鉴定 形态学鉴定:该菌在PDA平板活化后, 用6 mm 打孔器打成菌饼, 接种于PDA培养基平板中央, 重复3次。25 ℃恒温黑暗条件下培养, 逐日观察菌株在PDA培养基平板中的菌落形态、气生菌丝状况、颜色变化等。培养7 d后, 对其菌落形态特征、孢子形态、大小及颜色进行观察描述并拍照。参照张天宇[10]《中国真菌志(链格孢属)》及Simmons 等[11]《Alternaria, an identification manual》对链格孢菌的描述, 对该菌进行形态学分类鉴定。
分子生物学鉴定:在形态学鉴定的基础上, 选用PD液对菌株GS1-1、HH2-1和HH3-1进行菌丝体培养, 离心后用滤纸过滤回收菌丝体。选用EF-1α 引物[12]:EF1-728F (5'-CATCGAGAAGTTCGAGAAGG-3')和EF1-986R (5'-TACTTGAAG-GAACCCTTACC-3'); rDNA-ITS通用引物:ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')进行PCR扩增, 引物均由上海生工生物工程公司合成。25 μ L反应体系为:ddH2O 9.5 μ L、2× PCR Master mix 12.5 μ L、DNA模板1 μ L、10 μ mol· L-1上下游引物各1 μ L 。反应程序为:95 ℃预变性3 min; 95 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸60 s, 共35个循环; 最后72 ℃延伸5 min。扩增产物送交上海生工公司测序。获得的序列与从GenBank 数据库中获得的相关链格孢EF-1α 和rDNA-ITS基因序列进行比较, 利用Megalign 7.0软件以邻接法构建系统发育树, 确定菌株GS1-1、HH2-1和HH3-1的分类地位。
1.2.5 菌株GS1-1生物学特性研究 不同培养基对菌株GS1-1营养生长与产孢量的影响:将菌株GS1-1在PDA平板上25 ℃下培养7 d, 用灭过菌的直径6 mm的打孔器切取菌落边缘菌饼, 分别转移至6种不同的固体培养基中央, 25 ℃恒温黑暗培养8 d后, 用十字交叉法测量菌落生长直径, 用血球计数板镜检孢子数量, 每个处理3次重复。
不同碳、氮源对菌株GS1-1营养生长与产孢量的影响:将菌株GS1-1在PDA平板上25 ℃下培养7 d, 用灭过菌的直径6 mm的打孔器切取菌落边缘菌饼, 分别转移至以蔗糖、葡萄糖、果糖、麦芽糖、乳糖、可溶性淀粉代替基础培养基中的碳源制成的6种不同碳源的固体培养基中央和以蛋白胨、牛肉膏、酵母膏、DL-天冬酰胺、硝酸钾、尿素、硫酸铵、硝酸钠代替基础培养基中的氮源制成的8种不同氮源的固体培养基中央, 25 ℃恒温黑暗培养8 d后用十字交叉法测量菌落生长直径, 用血球计数板镜检孢子数量, 每处理3次重复。
不同温度对菌株GS1-1营养生长与产孢量的影响:将菌株GS1-1在PDA平板上25 ℃下培养7 d, 用灭过菌的直径6 mm的打孔器切取菌落边缘菌饼, 转移至PSA平板中央, 分别置于 5、10、15、20、25、28、30和35 ℃共8个温度梯度下进行黑暗培养, 8 d测量菌落生长直径, 用血球计数板镜检孢子数量, 每处理 3 次重复。
不同光照对菌株GS1-1营养生长与产孢量的影响:将菌株GS1-1在PDA平板上25 ℃下培养7 d, 用灭过菌的直径6 mm的打孔器切取菌落边缘菌饼, 转移至PSA平板中央, 置于12 h光暗交替(12 h光+12 h黑暗)、24 h连续光照(光照强度1500 lx)、24 h连续黑暗(无光照条件)的智能人工气候箱内, 25 ℃下恒温培养, 8 d后测量菌落生长直径, 用血球计数板镜检孢子数量, 每处理3次重复。
应用Excel 2010及DPS 7.05软件对数据进行处理分析。采用完全随机设计进行单因素方差分析, 采用Duncan氏新复极差法进行差异显著性分析。
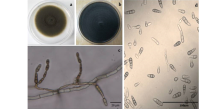
田块病株率为96.2%, 病叶率为87.6%。感病叶片初生黑褐色、形状不规则的小病斑, 逐步发展成为有明显同心轮纹状的近圆形黑色病斑, 发生严重时病斑密集成片, 叶片枯死(图1A, B)。对采集的病叶进行分离培养、单孢纯化后, 选取代表性菌株GS1-1、HH2-1和HH3-1对其进行致病性测定。
接种3 d后, 发现接种菌株GS1-1、HH2-1和HH3-1的二月兰叶片出现大量褪绿的小斑点, 而后斑点逐渐变成小黑点, 后期出现明显的黑色同心轮纹形圆斑, 发病症状与田间采集的病叶基本相同(图2A, B)。综上对病原菌致病性的试验结果, 并对发病叶片进行病原菌再分离、纯化培养, 得到与原接种所用相同病原菌, 分离率为100%, 说明GS1-1、HH2-1和HH3-1均是二月兰叶斑病的致病菌。
该菌在PDA培养基上菌落初期为橄榄灰, 短绒状, 边缘整齐或辐射状(图3a); 菌落后期逐渐转为褐色至灰黑色(图3b)。分生孢子梗浅褐色到褐色, 直立, 不分枝或少分枝, 直或上部随着产孢作屈膝状弯曲。分生孢子棕褐色, 圆筒形至椭圆形, 具一短喙, 成长链, 广卵圆, 卵形, 近椭圆形, 新生分生孢子体长(4.4~6.2) μ m× (8.7~26.1) μ m, 老熟分生孢子体长(10.9~11.8) μ m× (25.8~35.2) μ m, 具横隔1~8个, 纵隔少见, 偶见1格(图3c, d)。根据形态特征可初步鉴定其为甘蓝链格孢(Alternaria brassicicola)。
经与GenBank数据库中链格孢属rDNA-ITS序列比对, 发现菌株GS1-1、HH2-1和HH3-1的ITS序列均与甘蓝链格孢(MN173824、MN173825、MN173823、MF462311)相似性达99%以上, 其中与甘蓝链格孢(MF462311)相似性达100%。GS1-1、HH2-1和HH3-1与EF-1α 基因序列甘蓝链格孢(JX213350、KF889266、KT895946、KC584642和LC480212)的亲缘关系最近, 同源性达99%。
利用Megalign 7.0采用Neighbor-Joining (邻近连接法)构建基于ITS序列系统发育树并用 Bootstrap软件对系统树进行检验, 其中菌株HH2-1、GS1-1和HH3-1分别与甘蓝链格孢(MK880427、MN173825和MN173824)聚在系统发育树的同一个分枝(图4); 构建基于EF-1α 基因序列系统发育树, 菌株HH2-1与甘蓝链格孢(JX213350、KT895946、KC584642和LC480212)聚为同一类群, 而菌株GS1-1和 HH3-1均与甘蓝链格孢(KF889266)同在一个类群(图5)。两个基因序列都能准确地将3株分离菌与其他类别的链格孢分离开, 总体表现出较高的保守性, 因此, 结合形态学及分子生物学将菌株GS1-1、HH2-1和HH3-1鉴定为甘蓝链格孢。
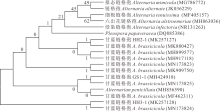 | 图4 基于ITS序列建立的菌株GS1-1, HH2-1 和 HH3-1的系统发育树Fig.4 Phylogenetic tree of isolated GS1-1, HH2-1 and HH3-1 based on ITS |
2.5.1 不同培养基对菌株GS1-1营养生长与产孢量的影响 菌株GS1-1在供试的6种不同培养基上均能生长(图6A)。在PSA生长最快, 但其与在PDA和玉米叶粉培养基上差异不显著(P> 0.05)。菌株GS1-1在供试的6种不同培养基上均能产孢, 最适宜产孢的培养基为PSA, 1 mL孢子悬浮液中平均产孢量对数值达到6.91。其他5种培养基上平均产孢量对数值在5.66~6.81(图6B)。
2.5.2 碳源对菌株GS1-1营养生长与产孢量的影响 菌株GS1-1在供试的6种碳源培养基上均能生长。生长最适的碳源为麦芽糖, 平均菌落直径为6.19 cm; 与其他5种碳源培养基的营养生长差异显著(P< 0.05)。可溶性淀粉碳源培养基的菌落直径较低, 显著低于其他碳源培养基(P< 0.05)(图7A)。菌株GS1-1适宜产孢的碳源为葡萄糖, 但与蔗糖和麦芽糖为碳源培养基的产孢量对数值之间差异不显著(P> 0.05); 乳糖为碳源的培养基产孢量最低, 平均产孢量对数值为6.05, 显著低于以上3种碳源培养基(P< 0.05), 但其与果糖及可溶性淀粉产孢量对数值之间差异不显著(P> 0.05)(图7B)。
 | 图7 碳源对菌丝营养生长和产孢量的影响 Ⅰ :蔗糖 Sucrose; Ⅱ :葡萄糖 Dextrose; Ⅲ :麦芽糖 Maltose; Ⅳ :乳糖 Lactose; Ⅴ :果糖 Fructose; Ⅵ :可溶性淀粉 Soluble starch.Fig.7 Effect of carbon on colony growth and sporulation quantity |
2.5.3 氮源对菌株GS1-1营养生长与产孢量的影响 菌株GS1-1在供试的8 种氮源培养基上均能生长。生长最适的氮源为蛋白胨, 平均菌落直径为5.62 cm, 与DL-天冬酰胺为氮源的培养基菌落直径之间差异不显著(P> 0.05); 其他6种氮源上的平均菌落直径为1.38~5.45 cm, 以硫酸铵和尿素为氮源培养基的菌落直径较低, 显著低于其他6种氮源培养基(P< 0.05)(图8A)。在供试的8种氮源中菌株GS1-1均可以产孢, 其中最适宜产孢的氮源为酵母膏, 1 mL孢子悬浮液平均产孢量对数值为6.47, 显著高于其他各处理(P< 0.05), 其他7种氮源培养基1 mL孢子悬浮液平均产孢量对数值在4.50~6.11(图8B)。
2.5.4 温度对菌株GS1-1营养生长与产孢量的影响 菌株GS1-1在5~35 ℃温度范围内均能生长, 菌落生长第8天平均菌落直径为1.04~7.17 cm。但在不同温度条件下, 该菌株菌落扩展速度不同, 适宜温度为25~28 ℃, 菌落平均直径为7.01~7.17 cm, 其中最适宜温度为25 ℃, 菌落平均直径高达7.17 cm, 温度低于5 ℃或高于35 ℃菌丝生长速率缓慢(图9A)。在5~35 ℃的温度范围内该菌株均能产孢, 平均产孢量对数值为5.31~6.75, 适合产孢温度范围为25~28 ℃, 平均产孢量对数值为6.66~6.75, 其中最适宜产孢温度为28 ℃(图9B)。
2.5.5 光照对菌株GS1-1营养生长与产孢量的影响 菌株GS1-1对光照条件要求不太严格, 在24 h黑暗、24 h光照、12 h黑暗+12 h光照条件下, 平均菌落直径分别为4.75、4.56和5.23 cm(图10A), 经方差分析24 h光照与12 h黑暗+12 h光照条件差异显著(P< 0.05), 但其与24 h黑暗条件之间差异不显著(P> 0.05)。菌株GS1-1在24 h黑暗、24 h光照、12 h黑暗+12 h光照条件下均可以产孢, 光暗交替能促进产孢, 产孢量对数值可达6.81(图10B)。
由于链格孢属真菌具有寄主范围广、传播途径多和侵染力强等特点, 可引起多种植物病害, 曾经在各国都造成过巨大的经济损失[13]。目前已报道的由链格孢属真菌引起的植物病害有多种, 如玉米链格孢叶斑病(Alternaria tenuissima)、甘草(Glycyrrhiza uralensis)叶斑病(Alternaria azukiae)、烟草(Nicotiana tabacum)赤星病(Alternaria alternata)、半夏(Pinellia tube)叶斑病、小麦(Triticum aestivum)黑胚病(Alternaria tenuis & Alternaria alternata)、马铃薯(Solanum tuberosum)早疫病(Alternaria solani)、小麦叶斑病(Alternarian tenius)、大白菜(Brassica campestris)黑斑病(Alternaria brassicicola & Alternaria brassicae)、万寿菊(Tagetes erecta)叶斑病(Alternaria tenuissima)和瓜类作物黑斑病(Alternaria cucumerina)等。此外, Woody等[14]研究发现链格孢属真菌能产生十多种不同的真菌毒素, 如链格孢酚(alternariol)、链格吡喃酮(altenuene)、链格孢酸(alternaric acid)等, 此类毒素对哺乳动物及人都有毒性。也有学者在研究引起哮喘的过敏原中发现, 链格孢属真菌的分生孢子可以释放过敏原引起哮喘[15, 16]。因此链格孢属真菌病害的研究工作在全世界范围内从未停止过, 由其引起的新寄主作物上的病害时有报道, 如Faedda等[17]首次在意大利发现链格孢属真菌交链链格孢(Alternaria alternata)能引起石榴(Punica granatum)上的病害, 在中国Bai等[18]首次报道链格孢属真菌能引起枣(Ziziphus jujuba)叶斑病(Alternaria alternata), Vicent等[19]在西班牙初次报道由链格孢属真菌引起的石榴黑心病(Alternaria alternata)。曾向萍等[13]在中国首次报道链格孢属真菌能引起大麻(Cannabis sativa)叶斑病(Alternaria alternata)。Nesma 等[20]在阿尔及利亚首次报道链格孢属真菌能引起空心菜(Ipomoea aquatica)和苦苣菜(Sonchus oleraceus)黑斑病(A. alternata)。
链格孢属真菌形态特征由于寄主及培养条件等不一致变化较大, 采用传统的形态学方法鉴定到种比较困难。随着分子生物学技术的不断发展, rDNA-ITS、EF-1α 序列分析等技术在真菌分类上的应用, 使得链格孢属真菌分类更准确。因此, 本研究在形态学鉴定的基础上, 采用rDNA-ITS序列和EF-1α 基因序列相结合的分析技术对二月兰叶斑病菌进行深入细致的研究, 进一步验证传统形态学鉴定结果, 确定了二月兰叶斑病病原菌为甘蓝链格孢。据报道, 甘蓝链格孢能引起多种十字花科植物叶部病害, 如1979年Wu等[21]报道甘蓝链格孢在台湾某地引起花椰菜(Brassica oleracea)黑斑病; 1989年李明远[22]研究发现甘蓝链格孢可引起北方十字花科蔬菜黑斑病; 2003年肖长坤等[23]也报道甘蓝链格孢是引起十字花科蔬菜黑斑病的常见种类之一, 它可以通过芸薹属和萝卜属蔬菜的种子及杂草和植株病残体等途径传播危害十字花科蔬菜; 2005年荷兰学者Kö hl等[24]对甘蓝链格孢引起的花椰菜黑斑病进行了系统研究; 2007年王风敏等[25]研究结果表明甘蓝链格孢是造成陕西省大白菜黑斑病的唯一病原菌。但甘蓝链格孢能引起二月兰叶斑病在国内外鲜有报道。2017年10月在对河北省黄骅市进行二月兰病虫害调查中发现, 甘蓝链格孢是引起二月兰叶斑病的病原菌, 在致病性测定时, 发现接种后发病症状与田间发病症状基本一致, 从接种发病部位分离到和田间发病相同的病原菌。
为了有效地控制该病的发生和蔓延, 本研究对其生物学特性进行了研究。研究结果表明该菌对营养条件要求不严格, 对环境适应性强, 在不同的培养基上均能较好的生长和产孢, 但最适生长和产孢的培养基为PSA; 通过研究不同碳、氮源对病原菌菌丝生长和产孢量的影响可知, 该菌对供试的各种碳、氮源培养基具有明显的选择作用, 最适菌丝生长的碳氮源分别为麦芽糖和蛋白胨, 尿素和硫酸铵对菌丝生长有明显的抑制作用, 可溶性淀粉碳源培养基的菌落直径较低, 显著低于其他碳源培养基。而王宁宁等[26] 研究表明, 在以淀粉作为碳源的培养基上, 菌丝生长指数及菌丝干重均最大, 说明淀粉为甘蓝链格孢菌菌丝生长的最佳碳源, 本研究结果与此不一致, 分析造成这种差异的主要原因可能与菌株及基础培养基不同有关。如本研究所用碳、氮源基础培养基为查氏培养基, 而王宁宁等[26]则以 PDA 为基础培养基。肖长坤等[27]对引起白菜黑斑病的甘蓝链格孢菌株Abra-US和Abra-C研究发现12 h光暗交替、24 h光照、24 h黑暗对两个菌株菌丝生长影响不大, 而本研究发现12 h光暗交替条件对该病原菌菌丝生长和产孢有明显的促进作用, 分析其主要原因可能与菌株来源及光照强度等有关系。研究还发现菌株GS1-1在5~35 ℃条件下均可生长, 最适生长温度为25 ℃, 最佳产孢温度为28 ℃, 这与王春明等[28]对引起花椰菜黑斑病病原菌菌株Alct-2最适生长温度为25 ℃的结论一致。
本研究明确了二月兰叶斑病病原菌的分类地位, 为二月兰叶斑病的防治提供了一定的理论依据, 但对于病原菌在二月兰上的流行规律、发病原因及对二月兰品质的影响、综合防治措施等还有待进一步研究。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|