作者简介:李志龙(1992-),男,甘肃酒泉人,在读硕士。E-mail: lizhilongde@163.com
为了揭示连续施用不同氮量对半干旱地区马铃薯根际细菌群落结构及反硝化作用的影响。通过大田试验设置了6个不同施氮量处理:N0(对照,不施氮)、N75(施氮量75 kg·hm-2)、N150(施氮量150 kg·hm-2)、N225(施氮量225 kg·hm-2)、N300(施氮量300 kg·hm-2)和N375(施氮量375 kg·hm-2),研究了连续5年不同施氮量对半干旱地区马铃薯根际细菌群落结构及反硝化作用过程中编码亚硝酸还原酶的关键酶基因 nirK和 nirS丰度的影响。结果显示:各处理土壤中$NO_{3}^{-}$ -N含量随施氮量的增加显著增加,最高施氮量处理(N375)土壤中$NO_{3}^{-}$-N含量高达80.41 mg·kg-1,分别比其他处理增加了86.87%~856.12%;土壤亚硝酸还原酶活性随着施氮量的增加随之增强,高氮处理显著高于低氮处理。高通量测序结果显示,大量施氮降低了细菌群落的Alpha多样性,显著改变了土壤细菌群落的物种组成;与N0处理相比,其他各施氮处理根际土壤中变形菌门和厚壁菌门的相对丰度增加了1.66%~26.53%和22.59%~85.52%,放线菌门和酸杆菌门的相对丰度降低了3.48%~34.63%和4.21%~37.12%,高氮处理显著低于不施氮及低氮处理;高量施氮显著提高了根际土壤中 Lactococcus、 Bacillus和 Lysobacter的相对丰度。根际土壤中 nirK和 nirS相对丰度随施氮量的增加随之增加,高氮处理中 nirK和 nirS相对丰度分别比N0处理增加了116.26%、101.49%和28.24%、8.47%。Person相关性分析表明, nirK相对丰度与土壤$NO_{3}^{-}$-N含量呈显著正相关关系,pH与 nirK和 nirS的丰度呈显著负相关关系。大量施氮造成土壤剖面中$NO_{3}^{-}$-N积累量的增加以及pH值降低是引起根际细菌群落结构以及 nirK和 nirS丰度变化的主要原因。
A five-year field experiment was conducted at Dingxi in the Gansu Province of China from 2013 to 2018 to determine the effects of continuous application of different nitrogen rates on bacterial community structure and denitrification mechanisms. The experiment had six nitrogen application rates, namely: No nitrogen application (control, N0), 75 kg N·ha-1 (N75), 150 kg N·ha-1 (N150), 225 kg N·ha-1 (N225), 300 kg N·ha-1 (N300) and 375 kg N·ha-1 (N375). It was found that nitrate ($NO_{3}^{-}$-N) content and nitrite reductase activity significantly increased with increasing nitrogen application rates. Treatment N375 increased $NO_{3}^{-}$-N content by 86.87%-856.12% when compared with the other treatments. Results from high-throughput sequencing showed that N375 significantly reduced the Alpha diversity of the bacterial community and changed the bacterial community composition of the rhizosphere. The control increased the relative abundance of Proteobacteria and thick-walled bacteria by 1.66%-26.53% and 22.59%-85.52%, respectively when compared with the nitrogen treatments. The relative abundance of nirK and nirS increased with increasing nitrogen application rates. Treatment N375 increased the relative abundance of nirK and nirS by 116.26% and 28.24%, respectively when compared with the control. Pearson correlation analysis showed that the relative abundance of nirK was significantly and positively correlated with $NO_{3}^{-}$-N while soil pH was negatively correlated with the abundance of nirK and nirS. The accumulation of $NO_{3}^{-}$-N and the reduction of soil pH due to the high nitrogen application rate changed the bacterial community structure and nirK and nirS abundance.
微生物是土壤中最活跃的组成部分[1]。根际土壤— 根际微生物组成的土壤微生态系统极其复杂, 微生物的生理类群在土壤微生态环境中发挥着重要的作用, 在氮素形态转化中具有特定的功能[2]。土壤中的氮素绝大部分都是有机氮, 有机氮只有在微生物(氨化细菌)及土壤酶的作用下矿化后, 才能被植物吸收利用[3]。长期大量施氮在降低氮肥利用率的同时, 导致土壤剖面中硝酸盐富集, 造成严重的资源浪费以及环境污染[4], 并且显著影响了土壤细菌的群落结构和多样性[5]。施氮通过影响土壤微生物种群比例和活性, 影响土壤供应有效氮的能力, 从而影响作物的生长发育。土壤细菌作为主导农田土壤微生物的主要类群, 可以敏感响应土壤养分含量及土壤肥力的变化。反硝化是在反硝化微生物驱动下完成的, 在农田生态系统的氮素循环过程中具有重要的地位。反硝化作用强度直接影响作物对氮素的利用[6]。
旱地土壤中的反硝化作用主要受到土壤水分含量、通气状况、土壤温度、作物根系种类、耕作措施以及施氮量等诸多种因素的影响[7, 8, 9, 10, 11], 并以施氮量的影响最为显著[12, 13]。已有的研究结果表明, 土壤中反硝化作用强度随氮肥施用量的增加而增加[14], 长期施氮不仅会增加土壤中的反硝作用化强度, 而且会显著改变反硝化细菌的群落结构[15, 16, 17]。
反硝化作用是由反硝化微生物所驱动的微生物学过程, 参与这一过程中的微生物种类繁多, 最初在细菌中发现。已有的研究发现, 细菌和古菌中约有50多个属、130多个种的微生物具有反硝化能力[18, 19, 20, 21]。也有报道指出, 真菌也参与了这一作用的全部或部分过程[22, 23, 24, 25]。但是, 对于反硝化真菌和古菌的研究多限于纯培养体系和森林等自然生态系统[20], 而农田土壤生态系统中关于反硝化作用的研究则主要由细菌主导。
反硝化作用是将N
参与反硝化作用的微生物大多数具有编码硝酸还原酶的基因narG和napA, 但这两种基因也存在于反硝化种群之外的微生物中[31]。因此, 研究者们通常采用编码亚硝酸还原酶的功能基因nirK和nirS作为分子标记[32, 33]。研究发现, 长期施用尿素能增加土壤中nirK和nirS的基因丰度[34, 35, 36]。
已有的关于反硝化作用的研究大多在集中在森林土壤[37]、水稻(Oryza sativa)土壤[38, 39, 40, 41]、毛竹(Phyllostachys edulis)土壤[42]、湿地[43, 44]和冬小麦(Triticum aestivum)农田[45, 46]等生态系统中, 而有关半干旱条件下马铃薯(Solanum tuberosum)根际的反硝化作用方面的研究鲜见报道。为此, 本研究在甘肃省马铃薯主产区, 定西市安定区布置田间定位试验, 运用传统的土壤农化方法, 结合高通量测序及实时荧光定量PCR等分子生物学研究手段, 研究施用不同氮量对半干旱地区马铃薯根际细菌群落结构及反硝化作用机制的影响, 旨在探明连续施氮对根际细菌群落结构和反硝化作用对不同施氮量的响应机制。
试验地位于甘肃省定西市安定区香泉镇(35° 27'7″ N, 104° 30'34″ E, 海拔2053~2556 m), 年均温度 6.9 ℃, 年降水量400 mm左右, 多集中在7— 9月。无霜期140 d, 80%保证率≥ 10 ℃的年积温为2075.1 ℃, 蒸发量1400 mm以上, 属中温带半干旱气候, 土壤类型以黄绵土为主。
定位试验始于2013年4月, 田间试验设置6个不同施氮处理:N0(对照, 不施氮); N75(施氮量75 kg· hm-2); N150(施氮量150 kg· hm-2); N225(施氮量225 kg· hm-2); N300(施氮量300 kg· hm-2); N375(施氮量375 kg· hm-2)。每个处理4次重复, 随机区组排列, 小区面积7.2 m× 6.0 m=43.2 m2。其中N225处理根据甘肃省定西市测土配方施肥为最佳施氮处理。各施肥处理的底肥一致[配施磷肥为过磷酸钙(P2O5, 16%), 施磷量225 kg P2O5· hm-2、配施钾肥硫酸钾镁(K2O, 24%), 施钾量292.5 kg K2O· hm-2], 氮肥为尿素(N, 46%); N:P2O5:K2O=1:1:1.3。每年均已以基肥形式, 将不同施氮处理沟施入土壤中。采用人工起垄, 宽垄双行覆膜种植模式, 采用鸭嘴形播种工具将种子埋入距垄面20 cm处, 各垄播种两行。垄宽60 cm, 行距60 cm, 株距25 cm, 种植密度为6.675× 104株· hm-2。试验供试品种为‘ 青薯九号’ 由定西农业科学院提供。
样品采集时间为2017年8月18日, 参考常海娜等[47]的根际土采集方法。每个处理4个小区, 每个小区随机选取5株马铃薯挖掘根系, 共20株。采用抖根法并用毛刷采集植株根际土壤, 同一小区的土壤样品均匀混合。部分土壤样品储存于-80 ℃冰箱待进行高通量测序分析, 其余土壤样品用于土壤化学性质的测定。
参照鲍士旦[48]的方法, 测定土壤硝态氮、铵态氮、有机质含量和pH; 参照李振高等[49]的方法, 测定土壤脲酶、土壤硝酸还原酶和土壤亚硝酸还原酶活性。
同时运用R 3.5.0等相关软件计算土壤细菌和真菌群落Alpha多样性指数如Chao 1指数、Shannon指数。计算公式如下:
Schao1=Sobs+
式中:Schao1=估计的OTU数; Sobs=实际观测到的OTU数; n1=只含有一条序列的OTU数目(如“ singletons” ); n2=只含有两条序列的OTU数目(如“ doubletons” )。
式中:Sobs=实际测量出的OTU数目; ni=第i个OTU所含的序列数; N=所有的序列数。
用E.Z.N.A.土壤DNA试剂盒(Omega Bio-tek, Norcross, GA, U.S)提取样品DNA, 利用引物515F:5'-GTGCCAGCMGCCGCGG-3'和907R:5'-CCGTCAATTCMTTTRAGTTT-3'对细菌16S rDNA基因V4~V5区进行PCR扩增。利用2%琼脂糖凝胶提取扩增子, 使用AxyPrep DNA凝胶试剂盒纯化(Axygen Biosciences, Union City, CA, U.S)并使用QuantiFluorTM-ST(Promega, U.S)定量。根据Illumina基因组DNA文库的制备过程, 利用聚合DNA产物构建了Illumina对端文库。在Illumina HiSeq平台(上海BIOZERON有限公司)上对扩增文库进行配对测序(2× 250)。
荧光定量PCR:采用MG96* (杭州朗基科学仪器有限公司)扩增仪进行实时荧光定量PCR分析。分析目标基因包括土壤细菌16S rDNA gene和真菌18S rRNA gene, 标准曲线取自相应基因代表性克隆重组质粒的10倍稀释样, 稀释梯度6到8个, 空白样品的模板为水。然后根据标准曲线的浓度计算出样品中的基因拷贝数, 最后以每克干土中的基因拷贝数为单位进行分析, 每个样品3次重复。定量PCR的反应体系为30 μ L, 其中包括:模板1.5 μ L, 正向和反向引物分别为1 μ L(10 μ mol· L-1), 15 μ L qPCR Mix(Takara, Dalian, China)和11.5 μ L灭菌蒸馏水。
nirK、nirS基因 Real-time PCR反应体系:15 μ L qPCR Mix、2 μ L Mg2+(25 mmol)、0.5 μ L Forward Primer(10 μ mol)、0.5 μ L Reverse Primer(10 μ mol)、2 μ L Template DNA, ddH2O补至30 μ L(以上流程及反应由上海凌恩生物科技有限公司测定)(表1)。
| 表1 本研究所用的引物和条件 Table 1 Primers and conditions used in this study |
采用SPSS 22、R 3.5.0数据处理软件对实验数据进行统计分析, 并用Origin 2017、Adobe Illustrator CS6软件制图。
连续5年施氮显著增加了土壤的$NO_{3}^{-}$-N含量, 增加的幅度随施氮量的增加显著增加(表2)。其中, N375处理下土壤$NO_{3}^{-}$-N含量达到80.41 mg· kg-1, 比N0处理增加了856.12%。施氮处理对土壤$NH_{4}^{+}$-N和有机质(SOM)含量无显著影响, 但是显著降低了土壤pH, 降幅为0.12~0.43个单位(表2)。
| 表2 不同处理下根际土壤化学性质 Table 2 Chemical properties of rhizosphere soil under different treatments |
土壤脲酶的活性随施氮量的增加呈现先增后减的趋势。当施氮量为300 kg· hm-2时脲酶活性达到最大, 在N375处理中脲酶活性下降(图1A)。土壤中硝酸还原酶的活性随着施氮量的增加而显著增强, 并在N375处理硝酸还原酶活性最大, 为0.251 μ g· g-1· 24 h-1。与对照相比增加了641.00%(图1B)。与对照相比施氮显著增加了土壤亚硝酸还原酶的活性。当施氮量为300 kg· hm-2时亚硝酸还原酶活性达到最大。施氮处理亚硝酸还原酶活性高于不施氮处理(图1C)。
Illumina PE250高通量测序结果优化后共获得970692条有效序列, 通过OTU(操作分类单元operational taxonomic units)聚类分析共得到9928个OTU(表3)。各处理土壤样品中在相似性0.97条件下得到Alpha多样性指数, 在N375处理时加Shannon指数最低; OTU和Chao 1指数虽然没有显著性差异, 但N375处理中OTU和Chao 1指数最低, 这说明过量施氮可以降低细菌的多样性。
| 表3 不同施氮量处理对细菌Alpha多样性指数的影响 Table 3 Effect of different nitrogen application rate on bacterial Alpha diversity index |
连续施用不同氮量土壤细菌16S rDNA优势门水平分布特征(图2)。从中可以看出土壤中细菌优势门(相对丰度> 1%)为9个, 分别为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatimonadetes)、浮霉菌门(Planctomycetes)、拟杆菌门(Bacteroidetes)和硝化螺旋菌门(Nitrospirae)。在主要的9个主要的微生物16S rDNA文库中变形菌门(21.16%~25.71%)、放线菌门(17.18%~24.29%)、厚壁菌门(11.46%~17.01%)、酸杆菌门(7.65%~10.49%)这些门占据了63.13%~68.72%以上的序列。
 | 图2 土壤细菌门水平分布特征(相对丰度> 1%)Fig.2 Relative abundance of bacterial phyla under different nitrogen application (relative abundance> 1%) |
随着施氮量的增加各处理的门水平绝对量发生了变化, 变形菌门和厚壁菌门的丰度显著提高。相比于对照(N0)处理, 各施氮处理中变形菌门增加了1.66%~26.53%, 厚壁菌门增加了22.59%~85.52%; 放线菌门和酸酐菌门相对丰度显著降低, 各施氮处理土壤中放线菌门和酸杆菌门相比对照不施氮处理降低了3.48%~34.63%和4.21%~37.12%。施氮显著提高了高氮处理中Firmicutes相对丰度, 但降低了Acidobacteria相对丰度, 在N300和N375处理中Firmicutes相对丰度分别为17.01%和16.38%, 较N0增加了48.43%和42.95%; 在N300和N375处理中Acidobacteria门的相对丰度分别为7.65%和8.79%, 较N0降低了37.18%和19.40%。
检测到的相对丰度大于1%的18个属, 在属水平上随施氮量的增加细菌相对丰度增加(图3)。芽孢杆菌纲中乳球菌属(Lactococcus)、芽孢杆菌属(Bacillus)和溶杆菌属(Lysobacter)3个属相对丰度显著增加, 比N0处理分别增加38.68%~74.58%、22.26%~104.88%和26.32%~161.00%。施氮显著提高了高氮处理中Lactococcus、Bacillus和Lysobacter的相对丰度, 在N300和N375处理中分别为Lactococcus(7.40%、7.30%)、Bacillus(6.72%、6.40%)和Lysobacter(2.07%、3.51%), 比对照处理分别增加74.58%、72.17%和104.88%、98.12%以及117.89%、161.00%。
 | 图3 土壤细菌属水平分布特征(相对丰度> 1%)Fig.3 Relative abundance of bacterial genera under different nitrogen application (relative abundance> 1%) |
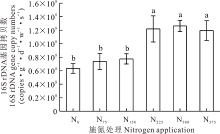
由图4可知, 与N0相比施氮显著提高了根际细菌数量。根际土壤中16S rDNA基因数量在1× 107 copies· g-1· d-1· w-1· s-1数量级以上。低氮以及不施氮处理土壤中细菌数量显著低于适量施氮及过量施氮处理。适量施氮和过量施氮能增加根际土壤中细菌数量。
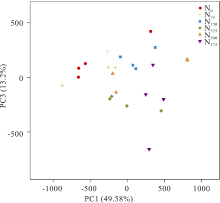
为了可视化展示根际细菌群落结构变化对不同施氮处理的响应, 本研究通过PCA(主成分分析)分析(图5)。分析结果显示, 施氮处理在PC1轴上与不施氮肥处理显著分开(Adonis:R2=0.37015, P=0.001), 解释度达49.58%; 这说明施氮肥能显著影响根际土壤中细菌群落分布, 但其影响因素需要进一步的研究。
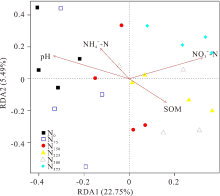
为了解环境因素对根际细菌群落结构的影响, 通过本试验的关联环境因子, 如土壤有机质(SOM)、土壤pH、硝态氮(N
实时荧光定量PCR技术能更好的描述根际土壤中nirK和nirS基因数量的变化。如图7所示, 各处理根际土壤中nirK和nirS数量在1.14× 105~2.36× 105 copies· g-1· d-1· w-1· s-1和1.45× 106~1.80× 106 copies· g-1· d-1· w-1· s-1。nirS基因拷贝数均高于nirK基因拷贝数, nirS/nirK为7.62~12.72。根际土壤中nirK在N0和N75处理中无显著性差异, 当施氮量超过75 kg· hm-2后, nirK数量显著增加(P< 0.05); nirS相对丰度在N0至N225处理间无显著性差异, 当施氮量超过225 kg· hm-2后nirS数量增加(P< 0.05)。结果表明, nirK对氮素的响应比nirS更为敏感。
Pearson相关性分析表明(表4), N
| 表4 nirK、nirS Pearson相关性分析 Table 4 nirK, nirS Pearson correlation analysis |
在本研究中, 马铃薯根际细菌主要由变形菌门 (Proteobacteria)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)组成。这一结果与国内外关于土壤细菌多样性的很多研究相同[50, 51, 52, 53]。另外, 本研究中酸杆菌门在高氮处理下显著降低。有研究表明, 酸杆菌具有降解纤维素和半纤维素的功能, 对植物残体降解起到重要的作用, 在底物中添加甲醇和甲烷能促进酸杆菌数量的增长, 土壤酸杆菌在土壤中的相对丰度与土壤pH值呈显著负相关关系[54, 55, 56]。氮素添加亦会导致土壤酸杆菌相对丰度的减少[57, 58, 59, 60, 61, 62], 本研究结果与其一致。究其原因, 在本研究条件下, 可能是由于氮素过高导致碳源受限而引起的酸杆菌门丰度降低。
本研究中各施氮处理Shannon指数显著低于对照处理, 同时最高施氮量处理N375的土壤样品OTU与Chao1值最低, 说明长期过量施氮也降低了半干旱地区马铃薯根际细菌种群丰富度和多样性, 过量使用氮肥会导致土壤细菌多样性降低, 使得土壤细菌群落结构发生变化, 与前人研究结果一致[63, 64, 65, 66]。
1)施氮肥导致根际细菌群落多样性降低。
2)土壤剖面中
3)施氮促进了根际土壤中反硝化作用强度, 增加了根际土壤中nirK、nirS型反硝化微生物丰度。
4) nirK对氮素的响应比nirS更为敏感。
5) 土壤
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|
| [66] |
|
| [67] |
|
| [68] |
|
| [69] |
|
| [70] |
|
| [71] |
|