作者简介:宗文贞(1992-),女,甘肃榆中人,在读博士。E-mail: zongwzh17@lzu.edu.cn
单宁是高等植物产生的次级代谢产物。单宁和单宁-有机氮络合物在植物与土壤间的氮循环过程中扮演着重要的角色。单宁参与氮素循环的机制主要包括络合有机氮、影响土壤微生物活性以及影响土壤酶活性。以往的研究并未深入探讨单宁对各种有机氮的络合能力,以及菌根真菌和腐生真菌对单宁-有机氮络合物的降解机制。因此,本研究着重讨论了单宁对各种有机氮的络合能力、络合物的降解机制、单宁对土壤酶活性的抑制作用以及单宁对土壤微生物的影响,并综述了单宁在氮循环过程中的作用,如减缓凋落物分解,抑制净氮矿化,影响净硝化和氮固持等。结果表明:单宁能够络合大部分有机氮;单宁的结构和浓度可显著影响其对土壤酶活性和净氮矿化的抑制效果以及对土壤微生物活性和多样性的作用,该结论可为进一步理解单宁在植物与土壤间氮循环过程中的角色奠定基础。
Tannins are secondary metabolites produced by higher plants. Tannins and tannin-linked organic nitrogen complexes play an important role in the nitrogen cycling at the plant-soil interface. The mechanisms by which tannins participate in the nitrogen cycling mainly include complexing organic nitrogen, affecting soil microbial activities and soil enzyme activities. Previous studies have not explored the complexation capacity of tannins to various organic nitrogen compounds, and the degradation mechanism of mycorrhizal fungi and saprophytic fungi on tannin-linked organic nitrogen complexes. Therefore, this review focuses on the complexation capacity of tannins to bind with various organic nitrogen compounds, the degradation mechanism of the complexes, the inhibition of soil enzyme activities by tannins and the influences of tannins on activities of soil microorganisms. Roles such as slowing of litter decomposition, inhibition of net nitrogen mineralization, and effects of tannins on net nitrification and nitrogen fixation in the nitrogen cycle is summarized. The findings of this review indicate that tannins can complex most of the organic nitrogen compounds; the structure and concentration of the tannins present can significantly affect the inhibitory actions of tannins on soil enzyme activities and net nitrogen mineralization, and soil microbial activity and diversity. These conclusions lay a foundation for further understanding of the role of tannins in nitrogen cycling at the plant-soil interface.
单宁是植物产生的次级代谢产物, 许多木本植物和一些高等草本植物均含有丰富的单宁[1, 2], 其在植物各个组织中的含量仅次于纤维素、半纤维素和木质素[3, 4]。以往对单宁的研究主要集中于单宁的抗氧化性、保护植物免受紫外线辐射以及对食草动物和病原体的防御机制方面[5, 6]。近年来, 越来越多的研究开始关注单宁对生态系统养分循环尤其是氮循环的影响[1, 7, 8]。单宁可能通过影响凋落物分解、氮矿化、氮硝化和氮固持等生态过程积极参与植物与土壤之间的氮素循环。单宁参与氮素循环的机制主要包括络合有机氮如蛋白质[9]、影响土壤生物活性[8, 10, 11, 12]以及影响土壤酶活性[13, 14]等。
在已发表的关于单宁影响土壤养分循环的综述中, Schofield等[7]和Kraus等[1]综述了2000年以前的研究成果, 而近20年来的最新研究成果尚未有综述报道。此外, Adamczyk等[15]主要综述了单宁与非蛋白有机氮的络合以及单宁对土壤酶活性的作用, 并未深入探讨单宁对各种有机氮的络合能力, 以及单宁及其络合物在植物-土壤氮循环中的角色。因此, 为了补充以往综述的不足, 本研究对以下方面进行了重点阐述:1)单宁含量和结构的测定方法; 2)单宁-有机氮络合物被菌根真菌和腐生真菌降解利用的机制; 3)单宁对土壤酶活性的影响; 4)单宁在植物-土壤氮循环中的作用, 包括抑制凋落物分解、抑制净氮矿化、影响净硝化和抑制氮固持等。
单宁是相对分子量为 500~20000 Da的多酚类聚合物[16]。水溶性单宁的分子量一般为500~3000 Da[17], 非水溶性单宁为3000~20000 Da[16]。按照化学结构的差异, 通常将单宁分为缩合单宁(condensed tannins, CT)和水解单宁(hydrolyzable tannins, HT)。缩合单宁, 也称原花青素(proanthocyanidin), 是两个或多个黄烷-3-醇的寡聚物或聚合物(图1a, b), 其相对分子量较大, 化学性质稳定[2]。组成缩合单宁的单体可以根据B环上羟基数目的多少进行分类, 含2个羟基的单体为原花青素(procyanidin, PC), 含3个羟基的单体为原翠雀啶(prodelphinidin, PD)(图1a), 有研究表明, PD的反应活性比PC更强[18]。水解单宁的相对分子量较小, 通常以一个葡萄糖为核心, 利用分子内的酯键将葡萄糖与多个没食子酰基相连接(图1c, d)[2]。水解单宁在酸碱的作用下易发生水解反应, 因此化学性质不稳定[19, 20]。
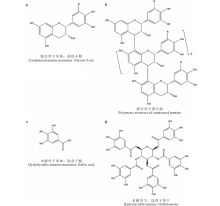 | 图1 缩合单宁和水解单宁的结构 a: R=H: 原花青素 Procyanidin (PC); R=OH: 原翠雀啶 Prodelphinidin (PD); b: n代表n个重复的单元n stands for n repeating units.Fig.1 The structure of condensed tannins and hydrolyzable tannins |
缩合单宁广泛分布于多种植物中, 包括蕨类植物、裸子植物、被子植物、单子叶植物和双子叶植物, 而水解单宁仅存在于双子叶植物中[1, 21]。一些木本植物能够产生缩合单宁和水解单宁, 如格陵兰喇叭茶(Ledum glandulosum)、熊果树(Arctostaphylos nummularia)和杜鹃花(Rhododendron macrophyllum)等[1], 而草本植物仅产生缩合单宁, 如珠芽蓼(Polygonum viviparum)和黄花棘豆(Oxytropis ochrocephala)等[22]。由于水解单宁性质的不稳定性, 大多数陆地生态学研究主要关注缩合单宁对土壤养分循环的作用。
植物中单宁的含量与结构不仅取决于植物的种类、所在的组织和生长年限[1, 23], 还与环境因子如土壤肥力[24, 25]、土壤pH[26]以及光照强度[27]有关。
植物中的单宁结构复杂, 其含量测定和结构鉴定的难度均较大。植物样品的种类、取样时间、采集方法、贮存条件以及对样品的物理加工方法都会影响单宁的提取和定量分析结果。
缩合单宁含量的测定方法包括盐酸-丁醇法、香草醛法和高效液相色谱法(high-performance liquid chromatography, HPLC)等[7, 28]。缩合单宁的结构鉴定方法包括间苯三酚解聚法和硫解法[7, 28], 以及近年来发展的新方法如气质联用(gas chromatography coupled with mass spectrometry, GC-MS)[29]、13C核磁共振(13C nuclear magnetic resonance, 13C-NMR)[29, 30]、近红外光谱(near-infrared spectrometry, NIRS)[29]和基质辅助激光解析电离飞行时间质谱法(matrix assisted laser desorption ionization time of flight mass spectrometry, MALDI-TOF MS)[31, 32]等。
水解单宁含量的测定方法包括碘酸钾(KIO3)氧化法、亚硝酸钠(NaNO2)氧化法、罗丹宁(rhodanine)法和高效液相色谱法等[28]。水解单宁的结构鉴定方法包括高效液相色谱法[28]和基质辅助激光解析电离飞行时间质谱法[33]。
单宁参与植物与土壤间氮素循环的机制主要包括络合有机氮化物如蛋白质, 影响土壤生物活性, 以及影响土壤酶活性等。
单宁对蛋白质的络合主要在以下两种情况中发生:当贮藏在植物成熟组织液泡中的单宁与细胞质中的蛋白质接触时; 当单宁与凋落物中的蛋白质、土壤中的蛋白质或胞外酶络合时[9]。单宁-蛋白质络合物的形成导致了植物叶片在成熟期的颜色变化, 有研究表明, 在植物成熟期间叶片中的单宁-蛋白质络合物含量可占其干重的20%[34]。
单宁与蛋白质的络合反应被许多内外因素所影响。其中, 内因包括单宁的分子量大小、结构(如聚合度、B环上羟基的数目)和浓度, 以及蛋白质的分子量大小、结构、氨基酸组成和等电点等; 外因包括反应溶液的试剂组成、反应温度和pH值等[35, 36]。与低分子量单宁相比, 高分子量单宁一般能够络合更多的蛋白质, 形成难降解的络合物[37, 38]。有研究表明, 缩合单宁的浓度与其沉淀蛋白质的能力呈显著正相关关系[39], 然而, 也有研究者得到相反的结论[40]。此外, 与结构紧密的蛋白质(如溶菌酶、肌红蛋白)相比, 结构疏松的蛋白质(如牛血清蛋白、组蛋白F1)对单宁的亲和性更高[41]。当环境pH值接近蛋白质的等电点时, 单宁对蛋白质的沉淀作用最强, 可能是由于蛋白质在该pH值下的溶解度最低[36]。根据溶解性的差异, 单宁-蛋白质络合物可以分为易溶性和难溶性化合物, 一般在单宁过量或环境pH值为蛋白质的等电点附近时, 通常形成难溶性络合物, 而在蛋白质过量时则形成易溶性络合物[41]。
单宁对蛋白质沉淀量的测定比较困难, 部分原因是许多测定蛋白质含量的标准方法(如紫外吸收法、Lowry法和Bradford法等)容易受到单宁的干扰[38]。单宁-蛋白质络合物的结构可以通过基质辅助激光解析电离飞行时间质谱和电喷雾质谱(electrospray ionization mass spectrometry, ESI-MS)[33, 42]等方法进行鉴定。
单宁-蛋白质络合物很难被土壤微生物降解[43], 然而一些研究认为, 欧石楠菌根(ericoid mycorrhizal, ERM)真菌和腐生真菌(saprotrophic fungi)能够降解单宁-蛋白质络合物[44, 45, 46], 其中, 腐生微生物分泌的具有腐生功能基因编码的酶能够降解大分子络合物[47]。外生菌根(ectomycorrhizal, ECM)真菌能否降解单宁-蛋白质络合物, 各项研究结果并不一致。有研究认为, ECM真菌如大毒滑锈伞(Hebeloma crustuliniforme)、土生空球菌(Cenoccocum geophilum)能够利用络合物中的氮素[45, 46, 48], 可能是由于ECM真菌分泌了能够降解络合物的酶, 也可能是ECM真菌利用了络合物中先由腐生微生物转化或矿化之后的氮素[49, 50]。有研究表明, 有些ECM真菌如双色蜡蘑(Laccaria bicolor)、粘盖牛肝菌(Suillus bovinus)并不能利用络合物中的氮素[44], 可能是由于这类真菌不能分泌降解络合物的酶[50]。综上所述, 不同ECM真菌对络合物中氮素的利用能力有差异, 可能是由于不同谱系的ECM真菌在进化过程中保留腐生功能基因的程度存在显著差异[51], 导致不同ECM真菌分泌出具有不同功能的酶。
除蛋白质外, 单宁还可以络合大部分非蛋白有机氮化合物。有学者研究了单宁酸和缩合单宁对非蛋白有机氮化合物的沉淀作用, 研究的化合物包括20种氨基酸、7种多肽、3种多胺、5种含氮碱基(腺嘌呤、鸟嘌呤、胞嘧啶、尿嘧啶和胸腺嘧啶)和3种氨基糖(N-乙酰-β -D-氨基葡萄糖、几丁质、壳聚糖), 结果表明, 单宁能够沉淀精氨酸、胰岛素、多胺、含氮碱基、几丁质和壳聚糖[52]。单宁和非蛋白有机氮化合物的反应与其和蛋白质的反应模式相似, 许多因素如单宁的结构和浓度、有机氮化合物的类型和浓度、反应溶液的pH等都可对沉淀作用产生重要影响[41, 52]。由于这类研究是在反应溶液中进行的[52], 因此, 未来的研究需要确定类似的络合反应能否在土壤环境中发生, 以及这些单宁-非蛋白有机氮络合物是否像单宁-蛋白质络合物一样稳定。
单宁与有机氮化物的络合反应有可能改变土壤氮素的有效性。在许多土壤氮素矿化缓慢的自然生态系统, 如北极苔原、北方森林和高寒草甸, 土壤全氮的95%以上为有机氮[53], 包括氨基酸、蛋白质、多肽和氨基糖等[26, 54]。土壤有机氮与单宁络合后, 形成难降解的单宁-有机氮络合物, 减少了可矿化的有机氮量, 导致植物和微生物可吸收利用的无机氮浓度降低。此外, 单宁-有机氮络合物的形成减少了土壤氮素的淋失, 有效地保留了生态系统中的氮素[54]。在富含单宁的生态系统中, 土壤中大分子的单宁-有机氮络合物的降解有可能是调控该地区土壤氮素循环的关键步骤[55]。
植物中的单宁通过淋溶或分泌作用进入土壤后, 对土壤微生物的活性和动物活动有显著的影响。
单宁可能通过影响土壤微生物的活性和物种多样性调控植物与土壤间的氮循环。大量研究结果表明, 单宁能够显著抑制土壤微生物活性[56, 57]。有研究者阐述了其可能的机制:1)单宁抑制土壤胞外酶活性; 2)单宁通过络合土壤有机氮从而剥夺了微生物用于生长的底物; 3)单宁对微生物有直接的毒性[56]。然而也有许多研究表明, 单宁可以显著促进土壤微生物的活性[8, 11, 58]。这些研究结果的差异可能与单宁的分子量、结构及其浓度有关。近年来的一些研究将植物中的单宁按照分子量大小提取分离后发现, 低分子量单宁(< 1000 Da)显著促进了土壤微生物呼吸, 而高分子量单宁(> 1000 Da)显著抑制了微生物呼吸[8, 56], 因此低分子量单宁可能作为微生物的碳源, 而高分子量单宁可能对微生物有毒性。另一方面, 有研究者对单宁的作用浓度进行了研究, 结果表明, 随着单宁浓度在一定范围内(0.68~10 mg· g-1)的增加, 土壤微生物活性逐渐增大[11, 58]; 但是当添加的单宁浓度高达50 mg· g-1时, 微生物呼吸被抑制[57], 表明高浓度的单宁对微生物有毒性。
单宁可能影响土壤微生物的物种多样性。有研究者在土壤中添加缩合单宁并于室内培养一个月后发现, 土壤中腐生真菌的数量增加, 细菌的数量相对减少, 真菌与细菌的比值增大[12]。亦有研究者发现, 凋落物中的单宁含量与土壤中的真菌数量呈正相关关系, 但其与革兰氏阴性细菌的数量呈负相关关系[59]。
综上所述, 在以往研究中, 单宁对土壤微生物活性和多样性的影响结果不一致, 其原因很可能是单宁的类型、化学结构和性质具有多样性, 从而导致其作用结果的差异[1]。然而, 由于单宁结构复杂, 其鉴定和表征较为困难, 因此很少有研究者使用结构确定的单宁测定其对土壤微生物活性和多样性的影响。
除了能够被单宁影响的土壤微生物之外, 还有一些土壤微生物能够对单宁进行降解利用, 这类微生物主要是真菌如欧石楠菌根真菌、一些木质腐生真菌和部分外生菌根真菌[60]。单宁被土壤微生物降解的难易程度主要取决于其类型和分子量, 如水解单宁较缩合单宁更易被降解[61], 低分子量的单宁较高分子量的单宁更易被降解[56]。
单宁可能对土壤动物的活动有抑制作用, 如单宁可以抑制土壤中线虫和蚯蚓的活动[10]。单宁通过影响凋落物的适口性, 降低了大多数土壤动物对凋落物的消耗[62], 从而保留了凋落物中的养分。另一方面, 有研究发现, 蚯蚓和多足虫能够降解土壤中的单宁和单宁-蛋白质络合物[63]。
单宁可能通过影响土壤酶活性从而调控植物与土壤间的养分循环。土壤酶是一类复杂蛋白质, 它们参与了土壤生物化学过程的各个环节, 如有机质的分解和矿化等[64]。因此, 单宁可能会利用其沉淀蛋白质的性质络合土壤酶, 从而间接影响氮素循环。大多数研究结果表明, 单宁对参与植物与土壤间养分循环的土壤酶活性有显著的抑制作用(表1)。然而, 也有研究者认为, 单宁不一定是土壤酶活性的抑制剂, 而很可能是酶活性的调节剂[15]。
| 表1 不同物种单宁对土壤酶活性的影响 Table 1 Effects of tannins from different species on soil enzyme activities |
单宁对土壤酶活性的抑制效果主要取决于单宁的结构、浓度和酶的类型等三方面因素[15, 65, 66]。1)单宁结构对酶活性的影响:有研究表明, 缩合单宁与水解单宁的混合物对酶活性的抑制作用显著高于缩合单宁, 可能是由于单宁混合物的结构更多样化, 能够在更多的位点与酶结合[65]。亦有研究者发现, 含有较高PD:PC单体比例的缩合单宁比含有较低PD:PC单体比例的缩合单宁对土壤酶的抑制效果更强[66], 其原因可能是含3个羟基的PD单体较含2个羟基的PC单体活性更强[18, 67]。2)单宁的浓度对酶活性的影响:有研究显示, 当单宁浓度从5 μ g· mL-1增加到80 μ g· mL-1时, 其对过氧化物酶活性的抑制作用逐渐增大[65]。3)土壤酶类型对单宁抑制酶活性的影响:有研究发现, 单宁对氧化还原酶(如过氧化物酶、多酚氧化酶)的抑制效果显著高于其对水解酶(如N-乙酰-β -D-氨基葡萄糖苷酶、β -葡萄糖苷酶)的作用[65]。
除了对土壤酶产生抑制作用外, 单宁亦可能促进土壤酶活性。例如, 有研究发现缩合单宁可显著促进N-乙酰-β -D-氨基葡萄糖苷酶的活性[66]。另有学者发现, 低浓度的单宁可显著促进几丁质酶、芳基硫酸酯酶和酸性磷酸酶的活性[68]。
单宁对酶的抑制效果并不能直接根据单宁对蛋白质的沉淀能力来预测[69]。例如, 缩合单宁与水解单宁的混合物沉淀蛋白质的能力显著低于缩合单宁, 但是其对β -葡萄糖苷酶的抑制作用却显著高于缩合单宁[65]。
在植物与土壤间的氮素循环过程中, 单宁能够显著抑制凋落物的分解, 降低土壤的净氮矿化, 影响净硝化, 以及抑制氮素的固持。
在自然生态系统中, 凋落物分解是土壤氮素的重要来源, 单宁通过影响凋落物的分解从而间接影响土壤氮素循环。许多研究结果显示, 凋落物中的单宁含量与凋落物分解速率呈负相关关系[71, 72, 73]。单宁减缓凋落物分解的可能机制如下:1)单宁络合凋落物中的有机氮, 形成难降解的单宁-有机氮络合物, 阻止凋落物中有机氮的降解; 2)单宁可能络合土壤胞外酶, 使其失去降解凋落物的能力[65]; 3)单宁对土壤微生物有直接的毒性或抑制作用, 阻止了微生物对凋落物的生物降解[56]。
大量研究结果表明, 单宁添加至土壤后, 显著降低了土壤的净氮矿化[8, 12, 57, 58]。单宁主要通过两类途径降低土壤无机氮库, 第一类是生物途径:1)单宁络合土壤酶使其失去活性, 导致一部分土壤有机氮不能被酶分解矿化; 2)单宁的毒性直接抑制了一些土壤微生物的活性[56], 导致能够降解有机氮和生成无机氮的微生物减少; 3)低分子量单宁可以作为土壤微生物的碳源, 增加微生物的氮固持[58]。第二类是非生物途径, 即单宁络合有机氮形成难降解的单宁-有机氮络合物[74], 从而降低土壤无机氮库。
单宁对土壤净氮矿化的抑制作用主要取决于其结构和浓度[11, 66]。1)单宁的结构是影响其抑制净氮矿化的主要因素。有研究者提取分离了珠芽蓼凋落物中的缩合单宁, 将单宁添加到土壤中培养后, 含有较高PD:PC单体比例的缩合单宁比含有较低PD:PC单体比例的缩合单宁对净氮矿化的抑制更强[66], 可能是由于含3个羟基的PD单体较含2个羟基的PC单体活性更强[18, 67]; 亦有研究者提取了欧洲赤松(Pinus sylvestris)和欧洲云杉叶片中的缩合单宁, 将其分离为分子量不同的4个组分, 之后将不同组分的单宁添加到土壤中进行室内培养, 结果表明, 低分子量的单宁组分对净氮矿化的抑制作用显著高于高分子量的单宁组分[8]。2)单宁的浓度亦可显著影响其对净氮矿化的抑制。有研究者在土壤中添加了不同浓度的白杨(Populus balsamifera)单宁, 室内培养一个月后测定土壤净氮矿化, 结果表明, 高浓度单宁对净氮矿化的抑制效果显著高于低浓度单宁[57]; 亦有学者得到了相似的结论, 即糖枫(Acer saccharum)凋落物中单宁的浓度越高, 其对土壤净氮矿化的抑制效果越明显[11]。
单宁对土壤净硝化的影响存在诸多争议。有研究表明, 单宁显著抑制净硝化[67, 74, 75], 然而亦有学者认为, 单宁对净硝化没有影响[56, 58]。此外, 不同类型的单宁对土壤净硝化的抑制效果不同。有研究者发现, 单宁添加至土壤后, 水解单宁显著降低了净硝化, 而缩合单宁对净硝化几乎没有影响[76]。然而, 亦有研究发现, 缩合单宁能显著抑制净硝化, 并且低分子量的缩合单宁对净硝化的抑制作用显著高于高分子量的缩合单宁[66]。综上所述, 单宁对土壤净硝化的影响可能与其种类、结构和性质有关。
目前, 很少有研究报道单宁对氮素固持的作用[77, 78]。Schimel等[77]通过室内试验与野外试验相结合的方法, 证明白杨通过释放单宁显著抑制了氮固持。亦有研究者得到了相似的结论, 即单宁可以通过抑制土壤微生物活性从而降低微生物对氮素的固持作用[78]。
众多研究结果表明, 单宁的结构差异可显著影响其对植物与土壤之间氮素循环的作用, 然而在以往的研究中, 单宁的结构大多未被表征, 因此, 在未来的研究中, 应该着力于鉴定和表征单宁的结构, 从而阐明不同结构的单宁对土壤氮素循环影响的差异。
在富含单宁的生态系统中, 单宁-有机氮络合物是土壤中氮素的重要存在形式, 因此该络合物的降解有可能是调控该地区土壤氮素循环的关键步骤。但是, 迄今为止, 单宁-有机氮络合物的形成仅在条件可控的实验室环境中得到了证实, 并且单宁-有机氮络合物在土壤中的降解机制仍不明确。在探索菌根真菌降解单宁-蛋白质络合物的前期研究中, 尚有一些不足之处:1)很多研究将商品化的水解单宁即单宁酸(tannic acid)作为单宁的代表与蛋白质形成络合物[50, 79, 80, 81], 但是单宁酸与缩合单宁的性质差异较大, 其形成的单宁酸-蛋白质络合物比缩合单宁-蛋白质络合物更易被土壤微生物降解利用[43, 81]。2)许多研究在实验室环境下进行, 如将菌根真菌培养在含有单宁-蛋白质络合物的培养基上, 鉴定其菌丝生长率[48, 49, 79], 或者采集野外土壤, 于室内添加单宁-蛋白质络合物后进行培养, 测定土壤净碳矿化率、净氮矿化率和真菌生物量[81], 因此, 这些试验未能全面地反映野外复杂的土壤环境对结果的影响。因此, 今后迫切需要建立对土壤中单宁-有机氮络合物的鉴定和定量方法, 使用接近实际情况的单宁化合物, 并着重考虑在野外条件下, 菌根真菌以及其他土壤微生物对单宁-蛋白质络合物的吸收利用, 从而阐明该络合物的形成和分解对植物与土壤间氮素循环的重要作用。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|
| [66] |
|
| [67] |
|
| [68] |
|
| [69] |
|
| [70] |
|
| [71] |
|
| [72] |
|
| [73] |
|
| [74] |
|
| [75] |
|
| [76] |
|
| [77] |
|
| [78] |
|
| [79] |
|
| [80] |
|
| [81] |
|


