作者简介:崔雪莲(1995-),女,甘肃临洮人,在读硕士。E-mail: cuixl18@lzu.edu.cn
醉马草为多年生禾本科草本植物,广泛分布于我国西北干旱-半干旱草原,其与内生真菌形成的互惠共生体具有较强的抗逆性,在自然生境中具备一定的竞争力。种子萌发及幼苗生长是植物生活史最重要的时期,决定植物未来的竞争力。通过发芽和盆栽试验,以携带(endophyte-infected, E+)和未携带(endophyte-free, E-)内生真菌的醉马草为材料,设置5个不同脱落酸(ABA)浓度,研究外源喷施ABA对醉马草内生真菌共生体幼苗建植过程的影响。结果表明:2.0 mg·L-1的ABA浓度对醉马草种子的发芽率、胚芽长、胚根长有显著的促进作用;1.0 mg·L-1 的ABA浓度较CK组对醉马草的净光合速率、根冠比、根表面积、根直径、根体积和根头数有显著的促进作用,但当ABA浓度为4.0 mg·L-1时表现为抑制作用。上述结果说明内生真菌具有对外源ABA的利用能力,但这与外源ABA的浓度有很大关系。
Achnatherum inebrians is a perennial bunchgrass of the Poaceae family, widely dispersed in the arid and semi-arid grasslands of northwest China. It forms a reciprocal symbiosis with Epichloё endophyte. The presence of the endophyte provides A. inebrians strong resistance to various stresses, making it more competitive. Both seed germination and seedling growth are important stages of plant growth, determining the future competitiveness of plants. In the present study, a gradient of five different abscisic acid (ABA) concentrations was set up to explore how exogenous ABA affects endophyte-infected (E+) and endophyte-free (E-) A. inebrians seed germination and seedling growth. It was found that the germination rate, embryo length and radicle length of both E+ and E- A. inebrians seeds were significantly promoted when treated with 2.0 mg·L-1 ABA solution. The net photosynthetic rate, root:shoot ratio, root area, root diameter, root volume and number of roots of the seedlings were higher when treated with 1.0 mg·L-1 ABA than those in the CK group. In contrast, the germination A. inebrians seeds and seedling growth were inhibited when treated with 4.0 mg·L-1 ABA solution. These results indicate that the interaction between Epichloё endophyte and an appropriate concentration of ABA improves seeds germination and seedling growth, and enhances the photosynthetic capacity of A. inebrians.
禾草内生真菌(Epichloё )是指能够在禾草体内(叶鞘、叶片、茎髓和种子等组织)度过大部分或全部生命周期, 但不使宿主表现出任何外部症状的一大类真菌[1]。截至目前, 已在全世界80个属的300多种禾草中发现了内生真菌[2], 我国在至少21个属77种天然草地禾草中发现内生真菌[3]。醉马草(Achnatherum inebrians)是我国西北天然草原主要的多年生丛生禾草, 多分布于干旱-半干旱高寒草原区, 在当地的草地群落中具有明显的生长优势。2004年, 我国学者Li等[4]将从甘肃肃南醉马草植株上分别分离获得的内生真菌鉴定并命名为甘肃内生真菌(Epichloё gansuense), 这是我国学者在国际学术界正式命名的首个内生真菌新种。Nan等[5]对我国北方20个不同地理种群中醉马草的带菌情况、共生体的生态分布及内生真菌的分类地位进行了系统研究, 发现野生醉马草种群的带菌率近乎100%。后续开展的系统研究表明, 内生真菌与醉马草形成共生体, 一方面可产生有毒的生物碱, 致使采食带菌禾草的马、牛、羊、鹿等家畜产生中毒症状给草地畜牧业造成巨大损失[6]; 另一方面, 二者形成互惠共生关系, 宿主植物为内生真菌提供生命所需的矿物质和光合产物, 而内生真菌则提高宿主植物的光合能力[7]、土壤中养分元素和水分的吸收和利用能力[8]以及显著提高共生体自身抵抗生物胁迫[9, 10]和非生物胁迫[7, 11]的能力, 使带菌醉马草在野外具备较强的生长优势。
种子萌发是植物生长的重要时期, 决定植物在生境中的竞争力, 其不仅与遗传相关, 还受外界环境的影响, 如温度、水分、光照、胁迫等, 以上因素通过影响种子内源激素的平衡进而影响种子萌发[12, 13]。激素是植物体合成的调节自身生长发育的一类重要的化学物质, 在生物及非生物胁迫的环境条件下对植物生长及其生理过程起着至关重要的调节作用[14, 15]。其中, 脱落酸(abscisic acid, ABA)就是关键激素之一, 对种子萌发有重要作用[16]。另外, 适宜浓度的ABA可以提高种子的发芽率、发芽势、发芽指数、胚芽长和胚根长, 并增强种子中的过氧化氢酶(catalase, CAT)、过氧化物酶(peroxidase, POD)、超氧化物歧化酶(superoxide dismutase, SOD)、抗坏血酸过氧化物酶(ascorbata peroxidase, APX)活性和可溶性糖含量[17], 促进种子萌发及幼苗生长。光合作用是植物生长过程中最为重要生理过程之一。任何情况下, 保持有效的光合作用对植物的正常生长是十分重要的[18]。ABA作为一种常见激素, 参与了植物渗透调节、抗氧化保护、气孔调节和光合作用[19]等生理过程。喷施ABA可提高植物叶片的叶绿素含量和净光合速率[20], 还可通过激活抗氧化系统中的相关酶活性, 如SOD、POD、CAT、APX、谷胱甘肽还原酶(glutathione reductase, GR)等, 清除逆境中所产生的过剩自由基, 缓解活性氧(reactive oxygen species, ROS)对宿主细胞的损伤[21]。同时, 外源喷施ABA使植物细胞中渗透调节物质、可溶性糖及脯氨酸含量增加、渗透势下降、保水能力增强, 均有利于宿主植物度过恶劣条件[22]。ABA还被广泛地认为可在器官和细胞水平增加根系导水率, 通过调节植物根系、冠层、叶片的水分传输来改变植物体的水分状况, 促使根系快速吸水[23], 通过调节水通道蛋白, 提高根系水分传导[24], 帮助植物应对逆境考验。
在自然生境中, 内生真菌赋予醉马草生长及抗逆优势, 使其具备较强的竞争力, 而逐渐淘汰了未携带内生真菌的醉马草。种子萌发及幼苗生长是植物生长的重要时期, 决定植株未来的竞争力, 携带内生真菌的醉马草(endophyte-infected, E+)在种子萌发及幼苗生长阶段如何从与未携带内生真菌的醉马草(endophyte-free, E-)的竞争中脱颖而出, 仍有待研究。因Epichloё 属内生真菌侵染禾草地上部分, 已有的禾草内生真菌共生体研究多侧重于对宿主植物地上指标的影响[25, 26], 对其根系的影响则鲜有报道。根系是与植株的生长环境接触最为广泛, 也是最先感知环境变化并对之做出响应的器官, 对生境的变化极为敏感。内生真菌与外源ABA互作会对根系产生怎样的影响还不得而知。本研究通过发芽和盆栽两部分试验, 探索外源ABA和内生真菌互作对醉马草种子萌发及幼苗生长的影响, 旨在明确ABA在禾草-内生真菌共生体建植过程中发挥的作用, 以期能够进一步丰富禾草内生真菌提高宿主植物竞争力的机理。
1.1.1 供试种子 为了确保种子基因型的一致性, 供试醉马草种子来于同一株E+醉马草植株。将收集到的一半醉马草种子用稀释100倍的70%的甲基托布津浸泡2 h灭菌, 灭菌后得到E-醉马草种子(因灭菌不一定完全、彻底, 所以得到的E-醉马草种子可能不纯)。2014年春季, 将获得的E+、E-种子分别采用穴播的方式种植于兰州大学榆中校区试验地(103° 36'52″ E, 36° 28'42″ N, 海拔1653 m), 建立种子扩繁小区。待种子萌发后, 每穴间苗至一株。幼苗生长出新的分蘖后, 参照李春杰等[27]的方法对其进行叶鞘部内生真菌检测, 判断幼苗带菌情况, 并做标记。2016年秋, 分别收集种子成熟的E+、E-醉马草, 单株保存。回到实验室后, 参照李春杰等[27]的方法进行茎秆检菌, 再次确定带菌情况后, 将E+、E-植株脱粒, 种子分别保存。将上述所得的E+、E-种子各分为两部分, 一部分用于发芽试验, 一部分用于盆栽试验。
1.1.2 ABA溶液 ABA购买自上海中秦化学试剂有限责任公司。将ABA粉剂用蒸馏水配成浓度为0.25、0.5、1.0、2.0和4.0 mg· L-1的水溶液, 备用。
1.2.1 发芽试验 参照卫东等[28]的方法, 于2019年3月15日采用纸上(TP)发芽床发芽, 用0.01 mg· L-1氯化汞溶液和70%乙醇分别对醉马草种子进行表面消毒, 随后用去离子水对种子彻底冲洗后。将E+、E-种子分别放入用无菌过滤纸铺成的芽床培养皿中, 每个培养皿放置50粒种子, 设置5个ABA浓度梯度, 每天加入2 mL相应浓度的ABA水溶液, 以相同体积蒸馏水为对照(CK), 每个处理5次重复。置于光照周期为16 h光照/8 h黑暗, 温度为25 ℃的培养箱(GXZ-128/158, 中国)中, 并定期随机调整位置。每隔2 d更换无菌滤纸, 避免ABA富集。14 d后对种子发芽率和幼苗生长指标进行测定, 以产生正常种苗为发芽标准。
1.2.2 温室盆栽试验 本试验于2019年3月12日至6月12日在兰州大学榆中校区智能温室进行[温度(26± 2) ℃, 湿度(42± 2)%]。用直径17 cm, 高14 cm的塑料花盆, 每个花盆底部垫一张滤纸, 再装入700 g质量比为1:1的经120 ℃干热灭菌5 h的蛭石和风干泥炭土。播种共计60盆。每盆播种3粒与发芽试验母本相同的健康、籽粒饱满的种子, 并按需浇水。出苗后, 间苗至1株。播种6周后, 挑选长势相似的E+、E-醉马草幼苗各30盆, 每2 d分别用浓度为0、0.25、0.5、1.0、2.0、4.0 mg· L-1的ABA溶液喷施E+、E-醉马草植株, 并随机调换花盆摆放位置。每个处理5个重复, 试验为期3周。
1.3.1 发芽指标测定 按照《草种子检验规程GB/T 2930-2017》计算种子发芽率[29]:
发芽率=(正常幼苗数/供试种子数)× 100%
发芽试验结束后, 从每皿中随机选取10株幼苗测量并记录其胚芽长和胚根长。
1.3.2 净光合速率的测量 在对醉马草植株喷施ABA的第3周, 采用手提式的光合作用测定系统LI-6400 (LI-COR Inc., Lincoln, NE, 美国), 对植株中高度最高的叶片进行净光合速率的测定。随机测定3个点, 3个点的平均值即为待测植株的光合指标。
1.3.3 叶绿素SPAD 值的测定 采用手持叶绿素仪(SPAD-502Plus, Konica Minolta Sensing, INC, 日本)对测定光合指标的相同叶片进行叶绿素SPAD值测量。所选叶片随机测量3次, 3次读数的平均值即为该叶片的叶绿素含量的相对值(soil and plant analyzer development, SPAD)。
1.3.4 生长参数数据的测定 地上指标测定:叶绿素含量及光合反应速率测定完成后, 将植株从花盆中取出, 去掉蛭石和泥炭土, 用蒸馏水将植株的根部及叶片冲洗干净, 并用吸水纸将水分吸干。在测量及统计完植株株高及分蘖后, 用剪刀将地上、地下部分分开, 并放在80 ℃烘箱中烘干至恒重, 分别测其重量即为植株地上、地下干重。
根冠比=地下部分干重/地上部分干重
根系指标测定:将清洗好的待测根系用甲基蓝染液染色后, 蒸馏水漂洗3次, 然后将根均匀无交叉的分散在玻璃根盘内, 并盖上遮光板, 运用扫描仪(Hewlett-Packard, 美国)扫描根系, 所得图像保存为TIFF格式图片。再运用Delta-T Scan 2.04 软件(Delta-T Devices, 英国)分析扫描所得图片, 获取根表面积、根直径、根体积及根头数等相关数据。
用SPSS 17.0 (SPSS公司, 美国)软件进行数据统计分析, 通过双因素方差分析ABA、内生真菌及其互作对醉马草发芽、生长、光合及根系指标的影响, 单因素方差分析E+或E-在不同ABA喷施浓度下的相关指标差异, 独立样本T检验比较同一ABA喷施浓度下, E+与E-间相关指标差异, 显著性区间均定义在95%水平。所测数据用平均值± 标准误进行展示, 并用Excel制图。
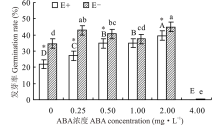
2.1.1 不同浓度ABA处理E+、E-醉马草种子发芽率的影响 醉马草种子发芽率受到内生真菌及ABA浓度的显著影响(P< 0.05), 也受两者交互作用的显著影响(P< 0.05)(表1)。对不同ABA 浓度处理下的E+、E-种子分别比较发现, 随着浓度的增大, E+的种子发芽率大体呈显著地先升后降的趋势(P< 0.05), E-则有所波动, 但均在2.00 mg· L-1时种子发芽率达到最大, 分别达39.7%和45.0%(图1)。至4.0 mg· L-1时, ABA对E+、E-醉马草种子发芽率均表现出显著的抑制作用(P< 0.05)。对照处理中, E+种子发芽率显著低于E-种子(P< 0.05), 但随着ABA浓度的增加, 二者间的差距逐渐缩小, 至ABA浓度为1.0 mg· L-1时, 差异不再显著(P> 0.05)(图1)。
| 表1 内生真菌(E)与ABA(A)对醉马草种子的发芽率、胚芽长和胚根长的影响的双因素分析 Table 1 Analysis of two-way ANOVA for the effects of Epichloё (E) and ABA concentrations (A) on germination rate, shoot and root length of drunken horse grass seed |
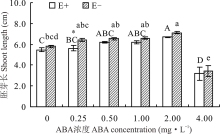
2.1.2 不同浓度ABA处理对醉马草种子胚芽长和胚根长的影响 醉马草种子胚芽长受内生真菌及ABA浓度的显著影响(P< 0.05), 也受两者交互作用的显著影响(P< 0.05)(表1)。对不同ABA 浓度处理下的E+、E-种子分别比较发现, 随着浓度的增大, E+、E-的胚芽长均呈先升后降的趋势, 在2.00 mg· L-1时, 种子胚芽长显著高于CK(P< 0.05), 分别高出22.0%和22.1%, 至4.0 mg· L-1时, ABA对醉马草种子胚芽长表现出显著的抑制作用(P< 0.05), 较CK分别低41.7%和41.4%。除在0.25 mg· L-1时, E+种子胚芽长显著低于E-种子外(P< 0.05), 其余浓度条件下, 二者间差异不显著(P> 0.05)(图2)。
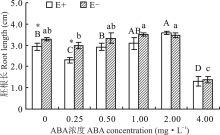
醉马草种子胚根长受内生真菌及ABA浓度的影响显著(P< 0.05), 但受两者交互作用的影响不显著(P> 0.05)(表1)。对不同ABA 浓度处理下的E+、E-种子分别比较发现, 随着浓度的增大, E+、E-的胚根长大体呈先升后降的趋势, 在2.00 mg· L-1时, E+种子胚根长显著高于CK(P< 0.05), 高出22.5%。至4.0 mg· L-1时, ABA对E+、E-醉马草种子胚根长表现出显著的抑制作用(P< 0.05), 胚根长分别降低了55.8%和58.1%。除在对照处理和0.25 mg· L-1时E+胚根长显著低于E-种子外(P< 0.05), 其余浓度条件下, 二者间差异不显著(P> 0.05)(图3)。
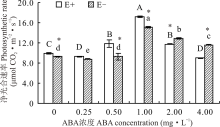
醉马草的净光合速率受内生真菌及ABA浓度的显著影响(P< 0.05), 也受两者交互作用的显著影响(P< 0.05)(表2)。对不同ABA 浓度处理下的E+、E-植株分别比较发现, 随着浓度的增大, E+、E-的净光合速率均呈显著地先升后降的趋势(P< 0.05), 且在1.00 mg· L-1时净光合速率达到最大, 较CK分别高71.4%和59.8%。同时, 在对照处理及ABA浓度为0.50和1.00 mg· L-1时E+醉马草的净光合速率显著高于E-植株(P< 0.05), ABA浓度为2.00和4.00 mg· L-1时E+醉马草的净光合速率显著低于E-植株(P< 0.05)(图4)。
| 表2 内生真菌(E)与ABA浓度(A)对醉马草的叶绿素SPAD值、净光合速率、根冠比、根直径、根表面积、根体积、根头数的影响的双因素分析 Table 2 Analysis of two-way ANOVA for the effects of Epichloё (E) and ABA concentrations (A) on chlorophyll SPAD, photosynthetic rate, root-shoot ratio, root diameter, root area, root volume and root tip count of drunken horse grass seed |
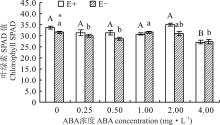
醉马草叶绿素SPAD值受内生真菌及ABA的显著影响(P< 0.05), 但受两者交互作用的影响不显著(P> 0.05)(表2)。对不同ABA 浓度处理下的E+、E-幼苗分别比较发现, 随着浓度的增大, E+、E-醉马草的叶绿素SPAD值呈先降后升再降的趋势, 在对照处理时, E-叶绿素SPAD值达到最大, 其余各浓度条件下差异不显著(P> 0.05), 4.00 mg· L-1的ABA对E+的叶绿素SPAD值表现出显著的抑制作用(P< 0.05), 较CK低22.0%, 其余浓度条件下, 较CK差异不显著(P> 0.05)。在对照处理中, E+叶绿素SPAD值显著高于E-植株(P< 0.05), 其余浓度条件下, 二者差异不显著(P> 0.05)(图5)。
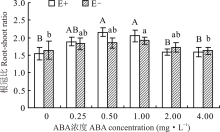
醉马草的根冠比受ABA浓度的显著影响(P< 0.05), 但受内生真菌及两者交互作用的影响不显著(P> 0.05)(表2)。ABA处理下, 随着浓度的增大, E+、E-的根冠比呈先升高后降低的趋势, 在浓度为0.50 mg· L-1时E+的根冠比达到最大, 在浓度为1.00 mg· L-1时E-根冠比达到最大, 较CK分别高出38.6%和15.2%。在对照处理及ABA浓度为2.00和4.00 mg· L-1时, E+的根冠比低于E-, 在其余浓度条件下, E+根冠比高于E-, 但差异均不显著(P> 0.05)(图6)。
不同ABA喷施浓度显著影响醉马草根表面积、根直径、根体积及根头数(P< 0.05), 根直径受两者交互作用的显著影响(P< 0.05), 根表面积、根体积、根头数均受内生真菌及两者交互作用的影响不显著(P> 0.05)(表2)。
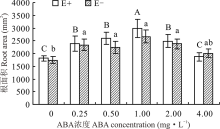
对不同ABA浓度处理下的E+、E-幼苗分别比较发现, 随着浓度的增大, E+的根表面积呈先升后降的趋势, E-则变化较平缓, 在1.00 mg· L-1时, 二者根表面积达到最大, 较CK分别高出64.9%和53.6%。在ABA浓度为4.00 mg· L-1时, E+的根表面积低于E-, 其余各浓度条件下E+均高于E-, 但二者之间差异不显著(P> 0.05)(图7)。
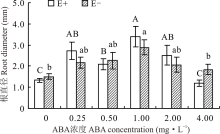
对不同ABA浓度处理下的E+、E-幼苗分别比较发现, 随着浓度的增大, E-的根直径呈先升后降的趋势, E+则有所波动, 但均在1.00 mg· L-1时显著高于CK(P< 0.05), 分别高出137.8%和80.9%。在ABA浓度为0.25、 1.00和2.00 mg· L-1时, E+的根直径高于E-, 其余各浓度条件下E+均低于E-, 二者之间差异均不显著(P> 0.05)(图8)。
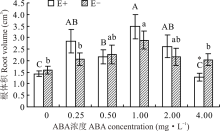
对不同ABA浓度处理下的E+、E-幼苗分别比较发现, 随着浓度的增大, E-的根体积呈先升后降的趋势, E+则有所波动, 但均在1.0 mg· L-1时显著高于CK(P< 0.05), 分别高出136.2%和72.8%。当ABA浓度为4.00 mg· L-1时, E+植株的根体积显著低于E-植株(P< 0.05), 其余浓度条件下, 二者间差异不显著(P> 0.05)(图9)。
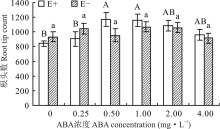
对不同ABA浓度处理下的E+、E-幼苗分别比较发现, 随着浓度的增大, E+的根头数呈先升后降的趋势, E-则变化较平缓, 在ABA浓度为0.50和1.00 mg· L-1时E+显著高于CK(P< 0.05), 分别高出37.9%和37.0%。在对照处理及ABA浓度为0.25 mg· L-1时, E+的根头数低于E-, 其余各浓度条件下E+均高于E-, 二者之间差异均不显著(P> 0.05)(图10)。
禾草内生真菌与宿主形成互惠共生体, 可促进宿主植物生长, 提高其生存能力[9, 10, 11], 但事实并非总是如此, 某些特定条件下, 内生真菌与宿主间的关系会由共生转为寄生, 从而对宿主造成消耗[30], 这种转变很大程度上取决于宿主、内生真菌基因型和宿主生境型[31]。本研究中, E+醉马草的发芽率、胚芽长、胚根长均低于E-醉马草。这可能是因为在种子萌发初期, 内生真菌的生长消耗了种子内部有限的营养物质, 从而降低了幼苗生长所需能量的供给, 故E+醉马草种子的萌发及初期生长较E-处于劣势。ABA是一种能够调控种子萌发、胚胎成熟、气孔开闭及适应胁迫等过程的激素[32], 其对种子发芽的调控包括从对休眠的诱导、保持和解除到最初的萌发转变以及种子萌发过程中储藏物代谢的调控等[33]。对多种植物的研究表明, 种子萌发时, 对外源ABA浓度变化比胚的内源ABA含量变化更为敏感[34]。本试验发现, 当ABA浓度为2.00 mg· L-1时对醉马草种子的发芽率、胚芽长、胚根长有显著的促进作用, 但当ABA浓度为4.00 mg· L-1时则为抑制作用, 表明外源ABA对植物种子萌发的影响存在一定的浓度阈值[35], 适宜的ABA浓度有利于促进醉马草种子快速萌发, 而浓度过高时, 则会适得其反。这与前人在小麦(Triticum aestivum)[34]和羊草(Leymus chinensis)[36]上取得的研究结果相似, 较高浓度的ABA 可阻碍种胚吸水以及细胞壁降解酶的合成等过程[37], 从而抑制了种子的萌发, 并对种子胚根、胚轴的分化和生长产生抑制[38], 而适宜浓度的ABA添加, 可有效调控带菌植株体内的物质、能量代谢过程[39], 这或许会缓解发芽初期因供能不足对E+醉马草生长产生的制约, 从而提高了E+醉马草在建植过程中种子萌发时期的生长能力。
植物光合作用是保障其生物量积累的重要生理过程之一, 光合能力的强弱与叶绿素含量紧密相关[40]。本试验中, E+醉马草的叶绿素SPAD值及净光合速率高于E-。这与前人的研究结果相似, 内生真菌可有效提高宿主植物的叶绿素含量, 增强其光合能力, 以获取更多的养分积累[7]。这不仅可满足植物的正常生长发育, 内生真菌自身也可从宿主植物中摄取更多生长所需的养分和空间。ABA可调节气孔开闭从而影响植物光合及蒸腾速率[41]。本试验中, 喷施适宜浓度的外源ABA可提高醉马草的净光合速率, 促进其生长发育, 这与前人在小麦和水稻(Oryza sativa)等作物上开展的相关研究结果一致[19, 22]。当喷施0.50和1.00 mg· L-1的ABA时, E+与E-间净光合速率差异大于CK处理, 表明适宜浓度的ABA可促使内生真菌对醉马草光合能力发挥更大的增益作用。也就是说, ABA可能作为被内生真菌调动的物质, 在调节光合能力的机制中发挥着重要作用。前人已在多年生黑麦草(Lolium perenne)和高羊茅(Festuca arundinaceae)的相关研究中发现, 内生真菌侵染后, 会增加二者内源ABA和生长素(auxin, IAA)的积累[20, 42]。但内生真菌是否会调节宿主植物醉马草中ABA合成相关基因的表达, 以增加共生体内ABA的含量并为其所用, 仍有待进一步研究。
根系在植物的生长发育过程中, 不仅起着固定植物和吸收水分及养分的作用, 还具有合成植物激素和必须物质的功能[43]。由于其是植物从土壤中获取水分的最主要途径, 因此根系的长度、密度等形态对植物的生长发育起着十分关键的作用[44]。本试验结果表明, 在对照处理中, E+醉马草根头数、根体积和根直径均低于E-醉马草, 说明内生真菌可在保证其正常生长不受影响的前提下, 尽量控制宿主植物地下生物量, 避免冗余生长[30], 但有研究认为, 内生真菌的侵染可增加宿主植物根系生物量, 通过发达的根系吸收土壤中的水分和养分, 促进宿主植物的生长[45]。也有研究表明, 决定根系吸水能力的是其在土壤中的分布及形态特征, 而非数量[46, 47]。ABA可通过调节Ca2+、H2O2、ROS等重要信号分子, 以调节根系的生长[48]; 也可通过与根系生长密切相关的其他激素的协同、拮抗作用, 如吲哚乙酸等, 以达到控制根系生长[49], 调节植物对土壤中水分及养分的吸收能力的目的[50]。本试验中, 喷施ABA对醉马草的根系形态影响显著。其中, 当喷施ABA浓度为1.00 mg· L-1时, 对醉马草的根表面积、根直径、根体积和根头数有明显的促进作用, 而当ABA浓度达到4.00 mg· L-1时, 开始呈现下降趋势。表明喷施适宜浓度的ABA可通过促进根系发育, 以扩大植物吸收水分和养分的范围, 增强其对土壤深层水分和养分的利用能力, 从而更好地促进植物的生长发育[51]。然而, 内生真菌与ABA互作是如何通过改善植物根系形态结构和功能来提高植物生长的还有待于深入研究。
种子萌发初期, 内生真菌因自身生长消耗掉了种子中储存的一部分能量, 导致醉马草E+种子的萌发与胚芽、胚根生长落后于E-。但在幼苗期, 内生真菌对醉马草的光合能力表现出明显的增益效果, 借助于光能积累, 宿主植物得以快速生长, 继而为真菌提供更多的养分供应与更大的生长空间, 形成良性循环。适宜的ABA浓度可进一步促进内生真菌对醉马草光合能力的增益效果, 表明ABA可能作为内生真菌可利用的物质之一, 在其调控宿主植物光合能力的机制中发挥着重要作用, 但内生真菌能否促使共生体合成更多内源ABA, 以为其所用, 仍有待进一步研究。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|