作者简介:邢易梅(1995-),女,内蒙古通辽人,在读硕士。E-mail: xym95101@163.com
紫花苜蓿是多年生优质豆科牧草,对改善生态环境和农牧作物结构调整有重要作用。然而,土地盐碱化严重影响苜蓿正常的生长发育。丛枝菌根真菌(AMF)和根瘤菌是土壤中较为常见的共生菌,可与紫花苜蓿等豆科植物共生,并能与苜蓿形成AMF-苜蓿-根瘤菌共生系统。本研究利用摩西球囊霉菌和中华根瘤菌单接种、混合接种紫花苜蓿,比较单接种和混接种对其耐碱能力的影响。结果表明:在正常情况下,单接种和混合接种与未接种(NI)相比生长量均有所提高,主要表现在叶绿素含量更高,植株的根长、株高相对较大,分枝数较多,生长更加茂密。碱胁迫处理后,各组植株生长均受到不同程度的抑制,而混合接菌组则表现出更高的耐碱性,与NI组相比,主要表现在有较低的MDA含量和相对电导率,有较高的细胞相对含水量, 并且表现出较高的抗氧化酶的活性(SOD、POD、CAT)。综合以上指标分析,单接种和混合接种均能提高植株的渗透调节能力和抗氧化能力,降低细胞膜的损伤,但混合接种的效果更佳。
Alfalfa is a perennial legume with high forage yield and quality that plays an important role in eco-environment improvement and cropping rotations. However, land salinization seriously inhibits the normal growth and development of alfalfa. Arbuscular mycorrhizal fungi (AMF) and rhizobia (R) are common symbiotic soil microorganisms. They can coexist with legumes such as alfalfa, and form a symbiotic system comprising AMF-alfalfa-R. In this study, we inoculated alfalfa with Glomus mosseae and Sinorhizobium meliloti, and compared the alkali resistance of plants with inoculum combinations. It was found that without alkali stress, the growth of G. mosseae-inoculated plants or R-inoculated plants was higher than that of non-inoculated (NI) ones. Important differences included higher chlorophyll content, relatively longer root length, higher plant height, and increased branch number. With alkali stress treatment, the growth of each group was inhibited in different ways, but the inoculated groups again showed higher alkali tolerance than NI. Compared with NI, the malondialdehyde content and relative conductivity remained at a low level in the NI group. The relative water content of the cells was higher, as were the activities of superoxide dismutase, peroxidase and catalase. Based on these results, single inoculation and mixed inoculation can both improve the osmotic adjustment ability and antioxidant capacity of alfalfa, and reduce damage to the cell membrane, but the results of mixed inoculation is even better.
紫花苜蓿(Medicao sativa)是优质多年生豆科牧草, 有“ 牧草之王” 的美誉[1], 根系发达, 营养丰富, 可被用于防风固沙, 园林绿化, 因其蛋白含量丰富, 是世界上栽培最广的豆科牧草[2]。
目前, 我国土地盐碱化面积逐年递增, 严重影响我国农牧业发展, 苜蓿长期处在高盐土壤中, 使渗透势改变, 离子平衡失调, 氨基酸代谢、糖代谢等代谢途径发生改变, 导致苜蓿产量和品质受到严重影响[3]。
丛枝菌根真菌(arbuscular mycorrhizal fungi, AMF)在根际养分循环中起着重要的作用, 形成的菌根吸收土壤中的养分, 提高植物对氮/磷的利用率, 促进植物生长, 在提高土壤肥力和植物生物量中发挥重要作用[4, 5]。接种AMF的植物, 叶绿素含量[6]、膜渗透调节[7]和抗氧化能力[8]增强, 可有效缓解逆境对植物的伤害。研究表明, 接种摩西球囊霉菌(Glomus mosseae)的苜蓿与正常苜蓿相比耐盐碱能力提高[9]。对大豆(Glycine max)、玉米(Zea mays)等农作物接种AMF能改善其生长状态, 提高植物抗旱性[10]和抗病性[11]。
根瘤菌(Sinorhizobium meliloti)是革兰氏阴性菌(G-), 在土壤中可与豆科植物共生形成根瘤, 起到固氮作用。研究表明接种根瘤菌可以提高大豆, 苜蓿等豆科作物的抗旱、耐盐碱能力[12, 13, 14]。胁迫条件下, 根瘤菌自身抗氧化酶的活性升高, 能够及时清除植物体内产生的活性氧[15, 16], 使宿主植株抵御逆境胁迫的能力增强。
AMF和根瘤菌接种对植物生物量可产生很强的协同效应, 主要表现在对氮源的吸收[17]。两种根系共生菌都能提高植物茎中氮素含量, 其中根瘤菌能提高根中氮素含量, AMF可将氮源运送到茎中, 更有利于植物生长繁殖及抵御逆境。 在氮源丰富的环境中, 豆科植物结瘤减少, 固氮能力下降, 生物量也随之下降。接种AMF可以促进结瘤率, 增强固氮, 使植物在高氮源的环境下更有效地利用氮源, 减小丰富氮素对结瘤的抑制作用, 且高氮源也可提高AMF的定殖率。因此, 丛枝菌根真菌和根瘤菌混合接种对豆科植物氮的吸收和利用具有相互协同作用和依赖性[18]。在植物耐逆方面, AMF和根瘤菌两种根系共生菌既可单独发挥作用, 也可协同作用促进植物生长, 提高植物耐逆性。双接种AMF和根瘤菌显著增加大豆生物量, 氮、磷含量及根系上的总根瘤数[19]。镉胁迫和酸胁迫下, 双接种AMF和根瘤菌促进绿豆(Vogna radiata)和苜蓿的生长, 增加其生物量和结瘤数, 并提高绿豆的抗氧化酶活性[20, 21]。同时, 这种混接方式还能通过调节植物抗病相关酶活性提高苜蓿的抗病性[22]。因此, 本研究比较了混合接种根瘤菌和AMF及单独接种对提高苜蓿耐碱性的影响, 为盐碱地苜蓿的种植提供一种有效的途径, 并为生产复合生物菌肥提供新思路。
试验于2019年1月在东北农业大学生命科学学院实验楼温室中进行。紫花苜蓿龙牧806购自黑龙江省畜牧研究所。编号为BGC XJ08A摩西球囊霉菌购自北京农林科学院, 耐碱苜蓿中华根瘤菌(CCBAU 81024)购自中国农业大学根瘤菌资源保存中心。
培养基质选用河沙(流水冲洗15 min, 最后蒸馏水冲洗一次, 125 ℃高温灭菌2 h)。
试剂:超氧化物歧化酶(superoxide dismutase, SOD)、过氧化物酶(peroxidase, POD)、过氧化氢酶(catalase, CAT)、丙二醛(malondialdehyde, MDA)、脯氨酸、可溶性糖试剂盒购自苏州科铭生物技术有限公司。
1.2.1 紫花苜蓿的培养及碱胁迫处理 为了提高种子的萌发率, 对紫花苜蓿种子进行春化, 75%乙醇消毒, 10%次氯酸钠灭菌5 min, 无菌水充分冲洗, 最后将种子放在铺有湿润滤纸的培养皿上, 置于培养箱(光照16 h, 25 ℃)中萌发, 一周后, 沙土移栽, 同时接种丛枝菌根真菌的处理组(AI)在土层下2 cm处放置2.5 g摩西球囊霉菌(BGC XJ08A), 接种根瘤菌的处理组(RI)用根瘤菌液浸泡幼苗, 更有益于侵染, 然后移栽, 同时设置未接菌处理组(NI)。混接丛枝菌根真菌和根瘤菌的处理组重复以上两项操作。幼苗期, 浇灌1/5倍的霍格兰营养液, 4周后, RI和混合接种摩西球囊霉菌-根瘤菌(MI)组植株浇灌无氮营养液, 以激活根瘤菌, 并在每月定期接种根瘤菌。16周后, 选取长势基本一致的4组植株, 用100 mmol· L-1, pH 8.5 NaHCO3溶液碱胁迫处理, 分别在0、5和8 d取样, 每组30株样本, 单株取样, -80 ℃保存备用。
1.2.2 根长、株高、分枝数及相对含水量测定 根长、株高和分枝数:用直尺测量根长、株高, 计数法测分枝数, 最后求均值。
相对含水量(relative water content, RWC)=(Wf-Wd)/(Wt-Wd)× 100%
式中:Wf表示组织鲜重; Wd表示组织干重; Wt表示组织被水分饱和后重量。
1.2.3 侵染率的测定 选取AI和MI组植株根部, 经蒸馏水冲洗1 min, 剪成长度约2 cm根段若干份, 对根段进行透明、酸化、染色、脱色、复染等处理后制片观察。
侵染率=侵染区总面积/视野总面积× 100%
1.2.4 叶绿素含量的测定 用TYS-B型号(中国峰龙化学仪器公司)叶绿素仪测定植株叶绿素含量。
1.2.5 相对电导率的测定 采用抽真空方法测定叶片电导率。
1.2.6 生理指标测定 采用可见分光光度法测定丙二醛、脯氨酸、可溶性糖含量; 采用紫外分光光度法测定超氧化物歧化酶、过氧化物酶和过氧化氢酶活性, 具体实验操作参考相应试剂盒说明书。
采用Graph Pad Prism 5统计分析试验数据标准差、方差并作t-检验处理, 分析单接种植株生理生化指标与混合接菌植株的差异, P< 0.05标注显著性字母。
比较了混合接种根瘤菌与摩西球囊霉菌(MI)和单接种摩西球囊霉菌(AI)侵染率的差异, 由图1所示, A图中的泡囊数明显少于B图, AI和MI侵染率存在差别, 并且MI的侵染率是AI的1.47倍, 差异性显著(P< 0.05)。由此可知, 接种根瘤菌有利于摩西球囊霉菌的侵染率。
比较不同接菌处理后植株的生长状态, 即株高、根长和分枝数, 各组植株株高、根长均存在不同差异(图2)。MI的株高最高, 分别与NI和RI产生显著差异(P< 0.05), 且是它们的1.12和1.19倍。接菌组AI、RI和MI根长相差不大, 但与未接菌组NI比, 差异显著(P< 0.05), 分别是NI的1.21、1.09、1.27倍。4组植株分枝数比较发现, AI与NI和RI植株间存在显著性差异(P< 0.05), 且分别是NI和RI的1.42、1.38倍。MI与NI和RI植株也存在显著性差异, 分别是NI和RI的1.59、1.63倍, 由此知接种摩西球囊霉菌可以提高苜蓿分枝数, 且与根瘤菌混接效果更佳。
对4组紫花苜蓿进行碱胁迫处理, 观察苜蓿表型差异(图3A)。碱胁迫处理5 d时, 4组植株生长状态均发生变化, 叶片变黄, NI植株叶片黄化明显。碱胁迫处理8 d时, NI植株生长受到抑制, 萎蔫程度最高, 叶片黄化率约为1/3。此时, 其他3组植株受损程度也有所上升, 但MI植株损伤程度相对较低, 耐碱性更好。
 | 图3 碱胁迫处理后紫花苜蓿表型、叶绿素、相对电导率和相对含水量的变化Fig.3 Differences in alfalfa phenotypic, chlorophyll, relative conductivity and relative water content after treatment with alkali stress |
从相应的生理指标分析可知, 0 d时, 接菌组叶绿素含量高于未接菌组, 存在显著差异(P< 0.05, 图3B), 且AI、RI、MI组分别是NI组的1.16、1.22、1.22倍。碱胁迫8 d时, 4组植株叶绿素含量均表现下降, 且NI、AI和RI组植株与5 d时相比均产生显著差异(P< 0.05), 而MI植株叶绿素含量仍最高, 且与其他3组存在显著差异(P< 0.05), 在碱胁迫处理8 d时, NI的叶绿素含量最低, MI是NI的2.04倍。叶片的相对含水量与叶绿素含量的变化有相似的规律, 0 d时, MI植株叶片相对含水量显著高于NI植株 (P< 0.05, 图3C)。在碱胁迫8 d时, MI植株的叶片含水量并无明显变化, 但其他3组相对含水量均明显下降, 且与MI产生显著差异(P< 0.05), MI的相对含水量分别是NI、AI、RI植株的1.29、1.27、1.09倍。又测定了4组植株碱胁迫后相对电导率的变化, 结果表明, 0 d时, 4组植株相对电导率无明显差异; 碱胁迫处理后, 4组植株相对电导率均上升, RI和MI组在碱胁迫8 d 时显著上升(P< 0.05), 而NI组在碱胁迫处理5 d时便显著上升, 8 d时, NI组相对电导率分别是AI、RI、MI的1.59、1.70、2.07倍, 存在显著性差异(P< 0.05, 图3D)。综上所述, 单接根瘤菌和单接摩西球囊霉菌均能使苜蓿保持叶绿素含量和相对含水量, 并降低相对电导率, 使苜蓿更耐碱, 但是混合接种的效果更为明显。
0 d时, 各组植株根和叶中MDA含量无显著差异。碱胁迫后, NI组植株根和叶中MDA含量明显上升, 而AI、RI和MI上升趋势不明显, 尤其是MI组(图4)。碱胁迫后, AI和RI组叶片中MDA含量变化较MI大, 但都明显低于NI组。碱胁迫8 d时, NI组植株根和叶的MDA累积量最大, 与AI、RI、MI组存在显著差异(P< 0.05), 在根中分别是AI、RI、MI组植株的3.02、3.77、3.33倍, 在叶中分别是AI、RI、MI组植株的1.34、1.33、2.07倍。MDA的含量与细胞膜损伤程度呈正相关, 由以上结果可知, 单接种根瘤菌和单接摩西球囊霉菌均能降低细胞膜的损伤程度, 且混合接种的效果优于单接种。
碱胁迫后4组植株根和叶中3种抗氧化酶酶活变化如图5所示, 总体看, 在未经胁迫处理时, MI组根中3种酶的酶活力均不同程度的高于NI组, 其中SOD、POD、CAT显著高于NI组(P< 0.01); 而在叶中, 则表现为MI组SOD显著高于NI组(P< 0.01), 而CAT则显著低于NI组。经碱胁迫处理后, 根中NI组SOD和CAT酶活性下降, POD酶活性上升, 相比NI组, MI组3种酶酶活性变化更为显著。在碱胁迫处理8 d后, MI组SOD、POD、CAT酶活性均显著高于NI组, 分别是NI组的2.97、1.42、2.43倍。而RI和AI组中酶的活性较NI组差异并没有MI组显著, 尤其是在碱胁迫处理8 d。
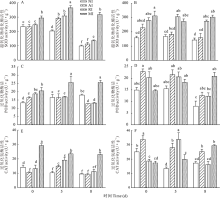 | 图5 碱胁迫处理不同时间点的紫花苜蓿根(A、C、E)和叶(B、D、F)中抗氧化酶的活性Fig.5 Activity of antioxidant enzymes in roots (A, C, E) and leaves (B, D, F) of alfalfa at different time points treated with alkaline stress |
在叶中, 4组植物酶活性的表现与根中有不同之处, 但相同的是MI组3种酶的酶活性在碱处理8 d均显著高于NI组(P< 0.05)。碱胁迫处理前后, RI组SOD酶活性均高于AI组, 与MI组变化一致, 碱胁迫处理8 d更为显著。而CAT的酶活性, 则在未处理和碱胁迫8 d时表现出AI组高于RI 组。POD酶活性, AI和RI组在未经碱胁迫处理时高于NI和MI组, 并持续到碱胁迫处理5 d。碱胁迫处理8 d时, 则明显下降, 最终低于MI组。由此推测, 接种根瘤菌和菌根真菌可以有效改变不同抗氧化酶活性, 而双接种两种促生菌则可更有效的提高苜蓿在碱胁迫下的抗氧化能力。
2.6.1 脯氨酸含量变化 脯氨酸是细胞膜渗透调节的重要物质, 遭受碱胁迫的植物体中脯氨酸含量发生变化。由图6所示, 0 d时, MI组根和叶中脯氨酸含量均显著高于NI组。碱胁迫处理后, 4组植株根和叶中脯氨酸含量均显著上升。碱处理5 d时, 3组接菌植株根中脯氨酸含量均显著高于NI组; 8 d时, RI组植株脯氨酸含量显著高于其他3组。在叶中, 碱处理5 d时各组脯氨酸含量无显著差异, 8 d时RI组显著高于NI组。
 | 图6 碱胁迫处理不同时间点的紫花苜蓿根(A)和叶(B)中脯氨酸的含量Fig.6 Proline content in alfalfa roots (A) and leaves (B) treated with alkali stress at different time points |
2.6.2 可溶性糖含量变化 可溶性糖不仅可为植物生长发育提供能量, 也可作为响应逆境胁迫的信号分子。由图7可知, 在根中, 0 d时, NI和MI的可溶性糖含量与AI、RI相差较大(P< 0.05); 碱胁迫5 d时, RI组可溶性糖依然显著高于其他3组; 8 d时RI和MI的可溶性糖含量显著高于NI。与根结果相似, 在叶中, 未经碱处理时, RI组中可溶性糖含量显著高于其他3组(P< 0.05), 碱处理后, 各组中可溶性糖含量均上升, 尤其是MI组, 持续显著性上升, 在碱处理8 d时, AI、RI和MI组可溶性糖含量均显著高于NI组。由此可知, 接种根瘤菌可以提高根和叶中可溶性糖含量, 碱胁迫处理后, 单接种和混合接种均可以持续提高根和叶中可溶性糖的含量以缓解渗透压。
豆科植物作为丛枝菌根真菌和根瘤菌的共同宿主, 可以形成AMF-豆科植物-根瘤菌3重共生体。两种微生物与宿主植物通过交换信号分子, 相互作用以及侵染, 在植物根系定殖或结瘤[23]。AMF、根瘤菌和宿主植物间的信号传导过程中有相同的信号来源和传导途径, 如植物根系分泌的类黄酮不仅能够激活根瘤菌中的结瘤调控蛋白, 还能促进AMF孢子的萌发、菌丝伸长和分枝[24], 促进AMF定殖; 同样接种AMF能促进结瘤及其固氮作用, 促进宿主植物生长。本研究中发现, 混合接种组摩西球囊霉菌的侵染率要显著高于单接种组。由此可见, 根瘤菌的接种, 促进了摩西球囊霉菌的定殖。两者之间存在相同的信号分子, 而该物质是否是类黄酮还有待进一步研究。
AMF和根瘤菌接种对植物生长具有协同效果, 两种菌在氮源吸收方面具有互补增效的作用, 是提高生物量的主要原因[17]。研究中发现, 单接种AMF和混合接种两种菌的苜蓿株高和分枝数都明显高于未接种的苜蓿, 也略高于单接种根瘤菌的苜蓿。可见, 接种摩西球囊霉菌可以提高苜蓿分枝数, 且与根瘤菌混接效果更佳, 可有效提高苜蓿的生物量, 该结果与蒙程等[21]的研究结果一致。原因可能与氮的吸收有关。两种共生菌在宿主植物对氮的运输和积累方面存在不同的机制, 根瘤菌和AMF均能提高根中氮素含量, 而AMF可将氮源运送到茎中, 更有利于植物提高生物量[18]。
刘倩等[25]研究表明, 接种 AMF或根瘤菌均可有效缓解盐碱胁迫对苜蓿造成的伤害, 提高其对盐碱的耐受能力; 且同时接种 AMF 及根瘤菌效果最好, 其次是单独接种 AMF, 单独接种根瘤菌作用相对最小。本研究使用耐碱苜蓿中华根瘤菌和摩西球囊霉菌共同接种苜蓿, 结果发现单接种和混合接种均能提高苜蓿的耐碱性, 但是混合接种的结果明显优于单接种, 主要表现在苜蓿的生物量、抗氧化酶活性和渗透调节能力。并且发现在未经碱胁迫处理时, 苜蓿根长、叶绿素含量、SOD、POD酶活力、脯氨酸和可溶性糖的含量都明显高于未接种苜蓿。碱处理后, 研究结果与之前的报道一致, 单接种和混合接种后, 苜蓿的耐逆性提高。但与刘倩等[25]报道不同的是, 单接种根瘤菌并不如其研究所说作用最小, 相反, 在某些生理指标中还比单接种摩西球囊霉菌有更好的作用。如RI组SOD和POD酶活性均较AI组更高。尤其是可溶性糖和脯氨酸的含量, 在未经处理就表现出明显高于AI组, 在碱胁迫后, 甚至高于混合接种组。
碱胁迫下植物细胞膜最先受损伤, MDA 是反映细胞受损程度的膜质过氧化产物。碱胁迫后, 接菌组MDA含量显著低于未接菌组, 且混合接菌组叶片中MDA含量最低。可能是AMF和根瘤菌提高了植物保护酶活性, 及时清除植物体内活性氧。混合接种组中3种抗氧化酶活性明显高于未接种组的结果也证实了该假设。可溶性糖是重要的营养物质和响应胁迫的信号分子, 在渗透调节方面起重要作用, 维持细胞膜结构的完整。碱胁迫前, 各组植株可溶性糖存在显著差异。随胁迫时间延长, 接菌组植株均高于未接菌组, 尤其单接根瘤组可溶性糖含量最高。说明根瘤菌能增强苜蓿渗透调节能力, 更能有效提高苜蓿耐碱性。这与王卫栋等[26]研究结果一致, 即接种根瘤菌激活的紫花苜蓿具有最强的抗氧化和渗透调节能力, 然而, 碱胁迫后各组根和叶中脯氨酸含量并无显著差异。前期研究发现, 接种根瘤菌紫花苜蓿根中氨基酸代谢物增加, 包括氨基酸有机酸、糖类等各种渗透调节物质[27], 接菌组相对于未接菌组还有其他渗透调节物质发挥作用。
研究结果表明, 双接种AMF与根瘤菌的效果优于单接种, 双接种能明显提高宿主植物生长, 并促进宿主植物的耐碱能力, 然而也要认识到双接种的正效应有一定的局限性, 正效应的发挥受到AMF、根瘤菌和豆科植物之间组合的匹配关系及土壤条件的影响。有研究表明, 不同的AMF与不同效率的根瘤菌进行组合试验, 发现有效根瘤菌对植株生长发育的促进效应明显被不匹配的AMF削弱, 而根瘤菌和AMF的最佳组合才可以获得最大的生物量和抗逆性[28, 29]。本研究使用的是苜蓿中华根瘤菌和摩西球囊霉菌的组合, 通过单接种实验可以看出, 两种菌都是苜蓿有效的根系共生菌, 两者的混合也具有协同促进作用。影响AMF和根瘤菌双接种效应的因素除了AMF-根瘤菌-豆科植物之间的组合外, 土壤中的非生物因素和根际土壤中的生物因素以及接种条件和方式都会对正效应产生影响。两种共生菌一方面通过对宿主植物的直接或间接作用促进对方的生存与发展; 一方面又存在着对营养及生态位的竞争。因此它们二者之间也存在负效应[30], AMF与根瘤菌也存在不同程度的拮抗性[31]。因此, 利用两种菌的共生体系, 提高逆境生态区苜蓿的生物量, 恢复生态系统的植被还需要对具体的应用环境进行必要的验证。
在正常情况下, 单接种根瘤菌、AMF及混合接种AMF和根瘤菌均能提高植物生长量。碱胁迫处理后, 植物生长发育受到抑制, 而接种AMF或根瘤菌均能提高植物抗氧化和膜渗透调节能力, 表现出更高的耐碱性, 且两种共生菌混合接种效果最佳。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|






