作者简介:覃凤飞(1973-),女,广西南宁人,讲师,博士。E-mail: qinffei@njau.edu.cn
为探讨外源2,4表油菜素内酯(EBR)对高温与弱光胁迫下紫花苜蓿生长与光合性能的调节作用,采用绿色遮阳网模拟遮荫条件,设置3种光环境[全光照(L0)、46.30%透光率(L1)和28.63%透光率]和4种EBR浓度[蒸馏水(CK)、0.01、0.1和1 mg·L-1],研究越夏期弱光胁迫下叶面喷施EBR对紫花苜蓿幼苗的形态、生长、光合色素含量、光合参数和光合-光响应曲线的影响。结果表明:越夏期随遮荫程度增加,紫花苜蓿冠层光合有效辐射(PAR)、红光与远红光比值(R/FR)、红光和紫外光波段占PAR的比例明显下降,绿光波段占PAR的比例明显上升;遮荫及EBR处理下,与对照相比,紫花苜蓿叶面积,叶重比,节间长,茎叶夹角,叶绿素a、b含量和胞间CO2浓度明显增加,叶面温度(Tleaf)和类胡萝卜素含量明显降低。轻度遮荫及1 mg·L-1 EBR处理下紫花苜蓿净光合速率和最大净光合速率与L0无显著差异。Pearson相关分析结果表明,越夏期遮荫条件下,紫花苜蓿冠层PAR、R/FR和紫外光波段占PAR的比例与光强显著正相关。遮荫及EBR处理下,紫花苜蓿根重比与光强显著正相关,主茎节数与光强无明显相关性。综合上述结果,越夏期遮荫条件下,外源EBR可调整紫花苜蓿植株结构,降低叶面温度,促进光合色素的合成,提高光合效率,缓解高温与弱光对紫花苜蓿生长的抑制作用。L1条件下,外源1 mg·L-1 EBR对紫花苜蓿生长的促进作用最明显。
This study investigated the regulatory effects of exogenous 2, 4-epibrassinolide (EBR) on the growth and photosynthesis of alfalfa under high temperature and low light stress in summer. A simulated shade experiment with green shade mesh was conducted by setting up three light environments [full sunlight (L0), 46.30% sunlight (L1), and 28.63% sunlight] and four EBR concentrations [distilled water (CK), 0.01, 0.1, and 1 mg·L-1]. The effects of EBR on the morphology, growth, photosynthetic pigment content, photosynthetic parameters and photosynthetic light-response curve were assessed. Results showed that the photosynthetically active radiation (PAR), red to far-red (R∶FR) ratio and percentages of the red and violet bands in PAR on the alfalfa canopy significantly decreased and that the percentage of the green band significantly increased with increasing shade in summer. Compared with CK, the leaf area, leaf mass rate, internode length, acropetal angles between leaf and mainstem, chlorophyll a and b contents, and intercellular CO2 concentration significantly increased, and temperature of the leaf thermocouple (Tleaf) and carotenoid content significantly decreased under shaded conditions. Compared with L0, the net photosynthetic rate and maximum net photosynthetic rate did not show distinct changes with 1 mg·L-1 EBR treatment under L1 in summer. The results of Pearson correlation analysis showed that PAR, R∶FR, and the percentage of the violet band on the alfalfa canopy had significant positive correlations with light intensity under shaded conditions. The root mass rate had a distinctly negative correlation, and the node number of the mainstem had no significant correlation with light intensity under EBR or shade treatments. The above results indicate that exogenous EBR can regulate the plant structure, decrease Tleaf, promote the synthesis of photosynthetic pigments, and improve the photosynthetic efficiency, and in this way alleviate high temperature and low light stress in alfalfa. Among the rates tested, 1 mg·L-1of EBR was the optimal concentration to improve the growth of alfalfa under slight shading (L1) during the summer period.
近年来, 随着我国南方农区畜牧业的快速发展, 家畜对饲草的需求量急剧增加, 加上我国南方农区土地资源普遍不足, 且大多用于种植粮食作物, 种植饲草的土地尤为缺乏, 因此牧草产量无法满足畜牧业发展的需求。随着我国农业产业结构的调整, 牧草间作和套种制度在一定程度上缓解了这一困境。然而, 在与高秆作物间作/套种模式下, 高秆作物冠层叶片对光的反射和吸收造成下层植被生长环境中光合有效辐射(photosynthetically active radiation, PAR)常低于全光照的50%, 红光与远红光比值(red to far-red ratio, R/FR)范围由单作条件下的1.05~1.35降低至0.55~0.85[1]; 下层植物光合作用效率和形态建成受到间作环境中特殊光质和弱光的影响而出现茎秆细长纤弱易倒伏, 叶片变薄, 分枝减少, 相对生长速率降低, 生长发育延迟等症状, 即避荫反应(shade avoidance response)[2, 3], 从而导致其生物量下降。此外, 我国南方地区夏季炎热, 大多数优质牧草种起源于高纬度地区, 间作套种牧草同时面临高温的胁迫, 进一步限制了牧草的生长。因此, 寻求南方牧草间作体系中高温弱光胁迫下牧草光合作用的改善途径, 对提高间作牧草的产量和品质具有重要的意义。
大量研究发现, 植物生长调节剂亚精胺(spermidine, Spd)、一氧化氮(nitrogen monoxide, NO)、脱落酸(abscisic acid, ABA)、抗坏血酸(aseorbie acid, ASA)、矮壮素(cycocel, CCC)等对植物光合作用、光合产物的运输与分配、内源激素代谢、保护酶活性诱导等生理过程具有积极的调控作用, 可调节植物生理代谢, 减轻胁迫伤害[4, 5, 6, 7]。油菜素内酯(brassinolide, BR)属于甾醇类, 被称为植物的天然生长调节剂, 2, 4表油菜素内酯(2, 4-epibrassinolide, EBR)是在作物上应用最多的BR化合物之一, 其重要作用之一是通过改变植物生理生化过程, 如促进细胞的伸长、分裂和光合产物的运输, 维持较高的叶绿素含量, 延缓衰老, 减缓脂膜过氧化作用, 增强植物的抗逆性[8, 9]。高温与弱光对植物的主要影响之一是降低植物的光合速率, EBR可通过保护植物光合器官, 缓解高温与弱光对植物的胁迫作用。高温条件下, 外源EBR处理可明显增大无柄小叶榕(Ficus concinna var. subsessilis)净光合速率和气孔导度、降低蒸腾速率[10]。弱光胁迫下, 外源EBR可通过改变植物叶片结构, 显著提高植物叶面积、叶片干重、茎叶夹角, 降低植物气孔密度和叶片厚度, 改善植物的光合性能[11, 12]。
紫花苜蓿(Medicago sativa)起源于近东中心, 其高产、蛋白质含量高、抗逆性强、适应范围广, 可固氮, 保持水土, 并具有一定的耐荫性[13], 因此是目前我国南方间作套种的主要优质牧草种之一。当环境中PAR低于全光照的50%[13]或气温高于30 ℃时[14], 紫花苜蓿生物量明显下降, 极大地限制了紫花苜蓿在间作套种体系中的应用。据此, 本研究采用绿色遮阳网模拟遮荫的方法, 研究高温与弱光胁迫下, 外源EBR对紫花苜蓿生长与光合特性的影响, 探讨外源EBR对提高紫花苜蓿耐高温和耐弱光胁迫的可行性, 为紫花苜蓿在我国南方地区的间作套种提供理论依据。
供试紫花苜蓿品种为“ 吉利” (Jili), 秋眠级6级, 由加拿大育成, 生长性能较好, 广泛种植于我国南方气候过渡地区。
试验地区位于江苏省南京市溧水区南京农业大学白马实验基地网室大棚。南京市溧水区地处北纬31° 23'-31° 48', 东经118° 51'-119° 14', 属亚热带湿润季风气候。四季分明、季风显著、冬冷夏热、雨热同季、梅雨显著、光热充沛, 年平均气温为15.5 ℃, 最冷月为1月, 最热月为7月。试验期间, 7月昼夜平均气温分别为33.77和26.16 ℃, 8月昼夜平均气温分别为33.32和26.61 ℃, 7-8月极端高温均为37.00 ℃。
2018年5月中旬, 在塑料花盆(规格为高25 cm, 直径20 cm)中播种紫花苜蓿种子。土壤基质为有机营养土∶ 蛭石=2∶ 1, 每盆施用有机肥30 g, 全光照下育苗。苗高3~4 cm时, 间苗, 每盆留下5株长势良好、分布均匀的幼苗。6月中旬进行遮荫处理。遮阳棚规格为3.0 m× 4.5 m× 6.0 m, 采用绿色遮阳网叠加设置遮荫梯度, 设一层和二层遮阳网两个遮荫梯度, TES-1339照度计(台湾)测量其光强分别为全光照的(46.30± 1.8)%和(28.63± 0.7)%, 分别记作L1和L2, 全光照为对照, 记作L0。遮阳网底部距地面50 cm, 以保持棚内气流通畅。同时对紫花苜蓿叶面喷施EBR, 设0.01、0.1和1 mg· L-1共3个浓度处理组, 以喷施蒸馏水为对照, 记为CK。每种处理设6个重复, 共54盆, 各EBR处理组每隔1 d喷施一次, 共3次。花盆按随机区组设计摆放于遮阳棚中央, 定期交换花盆的位置, 以消除边缘影响。常规水肥管理。
1.4.1 紫花苜蓿冠层光谱的测定 2018年7月上旬, 选择3个天气晴朗日期, 于每日11:00-13:00分别在各遮荫棚内紫花苜蓿冠层的东侧、南侧、西侧、北侧及中间各取两个点, 采用HR-350光谱仪(Hipoint, 台湾)测定紫花苜蓿冠层的光谱, 并计算各单色光所占比例、PAR(μ mol· m-2· s-1)和R/FR。
1.4.2 紫花苜蓿形态特征与生长特性的测定 2018年7月上旬, EBR处理21 d后, 每个花盆中随机抽取3个植株, 共计162株, 采用量角器测定植株各节茎叶夹角, 采用直尺测定株高和每节节间长, 采用螺旋测微仪(MNT-150, 中国)测定每节茎粗(测定部位为各节中部), 并收获植株。清洗植株并将其根、茎、叶分离, 采用叶面积仪(Area Meter AM300, 英国)测定各植株的叶面积, 随后根、茎和叶分别于105 ℃杀青45 min, 65 ℃下烘至恒重, 称重。
1.4.3 叶片光合色素含量的测定 EBR处理21 d后, 每个花盆选取2个植株, 摘取植株靠近顶端、完全展开的叶片2~3片。采用乙醇-丙酮混合液提取光合色素, 测定叶绿素a、b和类胡萝卜素的含量[15], 并计算叶绿素a和b的比值。
1.4.4 光合-光响应曲线的测定 EBR处理21 d后, 选择3个天气晴朗日期, 采用LI-6400XT便携式光合仪(美国)测定各处理组紫花苜蓿的光合-光响应曲线。测定方法为:每盆抽取2个植株, 选取植株靠近顶端、完全展开的叶片2片, 每日在8:00-16:00进行测定。以系统配置的红蓝光源(Li-6400-02BLED)作为测定光响应曲线的模拟光源, 将参比室CO2浓度控制为500 μ mol· mol-1。以由强到弱依次为 2000、1500、1000、800、600、400、200、100、50、0 μ mol· m-2· s-1来模拟光强。在不同光强下测定时, 均设置5 min的适应时间, 使之稳定后再进行净光合速率的测定。计算最大净光合速率(maximum net photosynthetic rate, Pnmax, μ mol CO2· m-2· s-1)、暗呼吸速率(dark respiration rate, Rd, μ mol CO2· m-2· s-1)、表观量子效率(apparent quantum yield, AQY, mmol CO2· mol-1 photon)光合响应参数时, 先使用SPSS进行拟合曲线。光响应曲线采用Farquhar模型[16], 即非直线双曲线模型进行拟合(式1), 获得不同遮荫和EBR处理下紫花苜蓿叶片的Pnmax, AQY, Rd和光响应曲线曲角(k)等参数。对曲线0~500 μ mol· m-2· s-1进行线性回归, 回归的直线与净光合速率为零(X轴)和净光合速率为Pnmax的两条水平线的交点分别为光补偿点(light compensation point, LCP, μ mol· m-2· s-1)和光饱和点(light saturation point, LSP, μ mol· m-2· s-1), 模型的数学表达式为:
Pn =
式中:PAR为光合有效辐射; Q为表观量子效率(AQY); Rd为表观暗呼吸速率; Pnmax为最大净光合速率; k为光响应曲线曲角。
1.4.5 叶片光合特性的测定 EBR处理21 d后, 采用LI-6400XT便携式光合仪(美国)进行测定。设置光强为1000 μ mol· m-2· s-1的红蓝光源, 25 ℃叶温, 流量为500 μ mol· s-1, CO2钢瓶供气。选择每个花盆中东、西、南、北方向的近顶端成熟叶子各1片进行测定, 每片叶子重复3次。主要测定参数为净光合速率(net photosynthetic rate, Pn, μ mol CO2· m-2· s-1)、胞间CO2浓度(intercellular CO2 concentration, Ci, μ mol CO2· mol-1)、气孔导度(stomatal conductance, Gs, mol H2O· m-2· s-1)、蒸腾速率(transpiration rate, Tr, mmol H2O· m-2· s-1)和叶面温度(temperature of leaf thermocouple, Tleaf, ℃)等, 由Pn/Ci估算羧化效率(carboxylation efficiency, CE, mol· m-2· s-1)。
紫花苜蓿的生长响应主要测定植株的根、茎、叶的比重和壮苗指数, 相关参数计算方法如下:
根重比(root mass rate, RMR)=根干重/植株总干重
茎重比(stem mass ratio, SMR)=茎干重/植株总干重
叶重比(leaf mass ratio, LMR)=叶干重/植株总干重
壮苗指数(strong seedling index)=(茎粗/株高+地下部干重/地上部干重)× 全株干重
其中, 茎粗为植株基部第一节中部的直径。
采用SPSS 17.0统计分析软件对各处理组进行方差分析, 采用Duncan新复极差法进行数据的多重比较, 光合参数和光响应曲线参数采用T检验进行比较。采用Excel 2010处理数据和制图。
与全光照(L0)相比, 遮荫条件下紫花苜蓿冠层光谱具有明显变化(图1)。随遮荫程度增加, 紫花苜蓿冠层760~622 nm(红光)和435~390 nm(紫外光)波段占PAR比例明显下降(P< 0.05), 577~492 nm(绿光)波段所占比例明显上升(P< 0.05), 450~435 nm(蓝光)波段无明显变化(图2)。随遮荫程度增加, 紫花苜蓿冠层PAR和R/FR均呈极显著下降趋势(P< 0.01)(表1)。
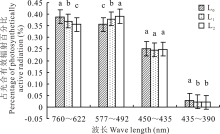 | 图2 越夏期不同遮荫条件下紫花苜蓿冠层各单色光占光合有效辐射的比例 不同字母表示差异显著(P< 0.05)。Fig.2 Percentage of monochromatic lights under different shading conditions in summer Different letters indicate significant differences (P< 0.05). |
| 表1 越夏期不同遮荫条件下紫花苜蓿冠层的光环境 Table 1 Luminous environment of alfalfa canopy under different shading conditions in summer (mean± SE) |
随遮荫强度增加, 不同EBR浓度处理下, 紫花苜蓿株高先上升后下降, 但未达显著水平(表2); 主茎节数在CK, 0.01和0.1 mg· L-1 EBR处理下明显下降(P< 0.05); 壮苗指数明显下降(P< 0.05); 叶面积明显先上升后下降(P< 0.05)。L1和L2下, 0.1和1 mg· L-1 EBR处理后紫花苜蓿叶面积明显大于对照(P< 0.05), 处理间其他参数无明显差异。
| 表2 越夏期遮荫及外源EBR处理下紫花苜蓿的生长特性 Table 2 Growth characteristics of alfalfa under different shading and exogenous EBR treatments in summer (mean± SE) |
随遮荫程度增加, 不同EBR浓度处理下, 紫花苜蓿单株生物量明显下降(P< 0.05)(表3); 根重比在1 mg· L-1处理下无明显变化, 其他处理下明显下降(P< 0.05); 叶重比在CK无明显变化, 其他处理下明显上升(P< 0.05); 茎重比无明显变化。L1和L2下, 处理间各参数无显著差异。
| 表3 越夏期遮荫及外源EBR处理下紫花苜蓿的生物量 Table 3 Biomass of alfalfa under different shading and exogenous EBR treatments in summer (mean± SE) |
随遮荫程度增加, 不同EBR浓度处理下, 紫花苜蓿节间长呈上升趋势, 处理间升幅存在较大差异(表4)。随光强减弱, 第1节在0.01 mg· L-1 处理下节间长显著上升(P< 0.05); 第3和4节在0.1和1 mg· L-1处理下节间长明显先上升后下降(P< 0.05); 第5和7节在0.01 mg· L-1处理下节间长明显先上升后下降(P< 0.05)。L1下, 第3和4节在0.1和1 mg· L-1处理下节间长明显大于其他处理(P< 0.05); L2下, 第1节节间长处理间存在显著差异(P< 0.05)。
| 表4 越夏期遮荫及外源EBR处理下紫花苜蓿的节间长 Table 4 Internode length of alfalfa under different shading and exogenous EBR treatments in summer (mean± SE) (cm) |
随遮荫程度增加, 不同EBR浓度处理下, 紫花苜蓿各节茎粗总体上呈下降趋势。随光强减弱, CK下, 第1~6节茎粗明显下降(P< 0.05); 0.01 mg· L-1处理下第2和3节茎粗明显下降(P< 0.05); 0.1 mg· L-1处理下第1~3节茎粗明显下降(P< 0.05); 1 mg· L-1处理下第3节茎粗明显下降(P< 0.05)。L1和L2下, 处理间各节茎粗无明显变化(表5)。
| 表5 越夏期遮荫及外源EBR处理下紫花苜蓿的茎粗 Table 5 Mainstem diameter of alfalfa under different shading and exogenous EBR treatments in summer (mean± SE) (mm) |
随遮荫程度增加, 不同EBR浓度处理下, 紫花苜蓿茎叶夹角总体上呈增加趋势(表6)。随光强减弱, CK下, 第7节茎叶夹角明显增大(P< 0.05); 0.01 mg· L-1处理下第1、3、5、6、7节茎叶夹角明显增大(P< 0.05); 0.1 mg· L-1处理下第3、5、6节和1 mg· L-1处理下第1、2、6、7节茎叶夹角均明显增大(P< 0.05)。L1下, 第5节处理间茎叶夹角存在显著差异(P< 0.05), 0.01 mg· L-1处理下茎叶夹角大于其他处理。L2下, 处理间各节茎叶夹角无明显差异。
| 表6 越夏期遮荫及外源EBR处理下紫花苜蓿的茎叶夹角 Table 6 Included angle between mainstem and leaf of alfalfa under different shading and exogenous EBR treatments in summer (mean± SE) (° ) |
随遮荫程度增加, 不同EBR浓度处理下, 各光合色素含量变化趋势存在较大差异。随光强减弱, 1 mg· L-1处理下叶绿素a含量和0.01 mg· L-1处理下叶绿素b含量均明显上升(P< 0.05); 各EBR处理下类胡萝卜素含量明显上升(P< 0.05); 叶绿素a/b呈下降趋势, 但未达显著水平。L1下, 1 mg· L-1处理后类胡萝卜素含量明显低于其他处理(P< 0.05), 其他参数处理间无显著差异。L2下, 处理间各参数无显著差异(表7)。
| 表7 越夏期遮荫及外源EBR处理下紫花苜蓿光合色素的含量 Table 7 Content of photosynthetic pigments in alfalfa under different shading and exogenous EBR treatments in summer (mean± SE) |
T检验结果表明, 随光强减弱, 不同EBR浓度处理下, 紫花苜蓿各光合与光响应参数变化趋势存在较大差异。CK, 0.01和0.1 mg· L-1处理下Pn和Pnmax明显下降(P< 0.05), Tleaf明显上升(P< 0.05); 1 mg· L-1处理下各光合与光响应参数均无明显变化; 各EBR处理下LSP明显下降(P< 0.05), Gs、Ci、Tr、CE、Rd和LCP亦呈下降趋势, 但未达显著水平。方差分析结果显示, L1下, 处理间Ci和Tleaf存在显著差异(P< 0.05), 1 mg· L-1处理下Ci和Tleaf分别明显高于和低于其他处理(P< 0.05); 其他光合与光响应参数无明显差异(表8和表9)。
| 表8 越夏期遮荫及外源EBR处理下紫花苜蓿的光合特性 Table 8 Photosynthetic characteristics of alfalfa under different shading and exogenous EBR treatments in summer (mean± SE) |
| 表9 越夏期遮荫及外源EBR处理下紫花苜蓿的光合-光响应曲线参数 Table 9 Photosynthetic light-response curve parameter of alfalfa under different shading and exogenous EBR treatments in summer (mean± SE) |
随模拟光强PAR增大, 全光照(L0)的Pnmax增幅最大, 遮荫(L1)条件下1 mg· L-1处理次之, 0.1 mg· L-1处理增幅最小。当模拟光强PAR大于1000 μ mol· m-2· s-1时, L1下各EBR处理及其CK的Pnmax明显低于L0(P< 0.05); PAR为600和800 μ mol· m-2· s-1时, L1下1 mg· L-1处理的Pnmax与L0无显著差异。L1下, 不同模拟光强中, 1 mg· L-1处理的Pnmax均大于其他处理(图3)。
Pearson相关分析结果表明, PAR、R/FR和435~390 nm(紫外光)占PAR的比例均与光强呈显著正相关(P< 0.01); CK下, 光强与主茎节数呈显著正相关(P< 0.01); 各处理下根重比与光强呈显著正相关(P< 0.05)。760~622 nm(红光)占PAR的比例、450~435 nm(蓝光)占PAR的比例、株高、壮苗指数、单株生物量、平均茎粗和叶绿素a/b与光强呈正相关, 其他参数与光强呈负相关(表10)。
| 表10 越夏期外源EBR处理下光强与紫花苜蓿冠层光环境因子、形态特征、生长特性与光合色素含量的相关性 Table 10 Correlation between light intensity and canopy luminous environmental factors, morphological and growth characteristics, and contents of photosynthetic pigments of alfalfa under different exogenous EBR treatments in summer |
叶片是植物光合作用的主要器官, 对环境变化敏感且可塑性大, 其形态结构的变化反映了植物对环境选择压力的适应性[17]。正常光照条件下, 植物茎叶夹角一般为锐角, 叶片上扬, 植株间排列紧凑; 弱光胁迫下, 植株内源赤霉素响应环境中R/FR值下降, 赤霉素信号转导通道中各基因表达增加, 赤霉素合成量增多, 促进了节间发育和主茎伸长[18, 19], 植物叶面积增大, 叶片变薄, 株幅增大, 茎叶夹角增大, 叶比重增加, 以增大吸光面积, 更多地吸收弱光环境下的散射光[20, 21]。本试验中, L1下紫花苜蓿叶面积、节间长和茎叶夹角明显增大, 主茎节数和茎粗明显减少, 支持了上述结论。弱光胁迫下, PAR和R/FR下降同时导致植株光合性能减弱, 光合产物合成和累积减少, 紫花苜蓿生物量、根重比和壮苗指数下降。高温导致植物体细胞膜系统受损, 加快细胞衰老, 增强细胞呼
吸, 促进碳水化合物向上部分配[22], 进一步加剧紫花苜蓿根系变短变细, 生物量下降。EBR最突出的生理作用是提高DNA、RNA聚合酶及质膜上ATP酶的活性, 促进核酸和蛋白质的合成及质膜分泌H+到细胞壁, 激活CycD3转录因子, 诱导细胞分裂素的产生, 使细胞伸长和分裂[23], 并通过调节根分生组织区和伸长区细胞的大小、数目及分裂周期等过程促进植物根的膨大、伸长及侧根的发生[24, 25]。本试验中, 外源EBR处理下, 紫花苜蓿叶面积、节间长和茎叶夹角增幅更大, 茎粗、壮苗指数和根重比降幅变小, 推测与上述研究有相同的作用机理。
光合色素是植物体内吸收光能的主要物质, 其含量可指示植物环境胁迫、光合能力和衰老进程等生理状态[26]。高温胁迫常降低叶绿体中一系列合成酶的活性, 导致叶绿素的生物合成减少[27], 同时引起植物体内大量产生活性氧, 加速叶绿素的降解[28]。弱光下植物单位叶面积叶绿体数目减少, 但叶绿体变大, 叶绿素含量增加, 其中叶绿素b的含量增幅更大, 叶绿素a/b值下降[29]。叶绿素b含量增加一方面有助于植物利用漫射光中占优势的较短波长的蓝紫光, 提高捕光能力; 另一方面增加捕光色素复合体LHCP含量, 均衡激发能在两个光系统间的分配[30]。叶绿素a/b值下降, 可增加叶绿体对2, 6-二氯酚靛酚的还原能力, 以提高叶绿体的光合磷酸化活性[31]。本试验中, 随光强减弱和叶片温度增加, 紫花苜蓿叶绿素a和b含量上升及叶绿素a/b降幅不明显, 可能与高温对叶绿素的降解作用有关, 是紫花苜蓿对弱光与高温耦合作用的适应性调整结果。外源1 mg· L-1 EBR处理后, 紫花苜蓿叶绿素a含量明显增加, 叶绿素b增幅变大, 可能由于EBR可抑制叶绿素酶活性, 防止叶绿素降解和促进叶绿素的合成[11, 12, 32]。随遮荫程度增加, 处理间类胡萝卜素含量变幅一致, 表明类胡萝卜素在紫花苜蓿抗高温和弱光胁迫中的作用可能较小。
光合作用是植物对温度和光照变化最为敏感的代谢反应。本研究中, 随遮荫程度和叶面温度增加, 紫花苜蓿Pn和LSP明显下降, Gs、Tr、Ci、Rd和LCP降幅亦较大, 可能原因是高温下, 叶片气体交换加快, 叶片水蒸气压亏缺增大, 部分气孔关闭、Gs下降; 叶绿体内基质和类囊体受损, 二磷酸核酮羚化酶对CO2的亲和力和Rubisco羧化活性下降, 光合系统从有活性中心转向无活性中心, ATP及NADPH减少, 导致LSP、AQY和Pn下降[33, 34, 35, 36]。弱光下, 叶片下表皮气孔的横轴加宽, 不利于气孔的迅速开放和关闭, Gs、Ci和蒸汽压亏缺下降, 有利于光合作用的进行, 但因PAR减少, 光合电子传递能力下降, Pn随之下降[37]。与CK相比, 外源1 mg· L-1 EBR处理后, Pn和Pnmax降幅不明显, 推测是一定浓度的EBR可提高紫花苜蓿的AQY, 有利于其在较低的光强下捕获光量子, 维持较高的光合物质积累[38], 同时缓解高温对蔗糖转运蛋白相关基因表达的抑制作用, 促进光合产物的运输[39]。
PAR、R/FR和435~390 nm所占比例与光强呈显著正相关, 表明绿色遮阳网可明显改变紫花苜蓿冠层的光强和光质; EBR处理后主茎节数与光强无明显相关性, 及EBR处理后大部分茎节茎粗随光强减弱降幅不明显, 表明外源EBR可促进原形成层细胞的分裂, 调节幼芽中维管束的数量[40]。EBR处理后, 根重比与光强呈显著正相关, 进一步说明EBR处理有利于光合产物的转运, 促进侧根的分化和产生, 减少弱光下根系的过度降解[25]。
越夏期绿色遮阳网模拟遮荫明显改变紫花苜蓿冠层光强和光谱组成。随遮荫程度增加, PAR、R/FR、红光和紫外光占PAR的比例明显下降, 造成紫花苜蓿光合产物向茎部转运, 根和叶生长受限, 光合色素含量和光合速率下降, 抑制了紫花苜蓿的生长。外源EBR可通过调整紫花苜蓿植株结构和光合产物的分配, 降低叶面温度, 增大光合面积和光合色素含量, 提高光合性能, 缓解高温与弱光对紫花苜蓿生长的抑制作用。高温和L1下, 外源1 mg· L-1 EBR是促进紫花苜蓿生长的最适浓度。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|




