作者简介:任海伟(1983-),男,山西孝义人,副教授,博士。E-mail:rhw52571119@163.com
将干玉米秸秆(DCS)与废弃白菜(CW)混合发酵贮存,研究了纤维素酶添加量对混贮品质及微生物多样性的影响。设置对照ME组(无酶添加)、CA组(酶添加量0.1%)和CB组(酶添加量0.3%)3个处理组,密封贮存60 d,间隔30 d分析其化学组分、发酵品质和微生物多样性。结果表明,贮存30 d时CA与CB组中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)和纤维素(CL)均显著低于ME组( P<0.05),乳酸(LA)和可溶性碳水化合物(WSC)含量显著高于ME组( P<0.05),pH和氨氮/总氮(AN/TN)显著低于ME组( P<0.05);60 d时3个处理组的乳酸/乙酸(LA/AA)值均高于3,乳酸/总有机酸(LA/TOA)值均高于0.6,其中CB组乳酸发酵强度最好。Miseq高通量测序分析发现,3个处理组在贮存60 d期间门水平优势类群为厚壁菌门(Firmicutes)和变形菌门(Proteobacteria),属水平优势类群为类乳杆菌属( Paralactobacillus)、乳杆菌属( Lactobacillus)和肠杆菌属( Enterobacter)。腐败菌(e.g. Enterobacter)丰度随时间延长逐渐下降, Paralactobacillus和 Lactobacillus丰度逐渐升高,纤维素酶有助于提高乳酸细菌丰度并使腐败细菌丰度下降,强化乳酸发酵。总之,低剂量纤维素酶有助于保存半纤维素(HC)、纤维素(CL)和可溶性碳水化合物(WSC)等组分,且发酵品质良好;高剂量纤维素酶能进一步强化乳酸发酵。综合考虑酶成本与贮存效果,推荐低剂量纤维素酶(0.1%)用于干秸秆和白菜废弃物的混合贮存。
Dry corn straw (DCS) and cabbage waste (CW) were mixed and ensiled trans-seasonally; the effect of cellulase addition on silage quality and microbial community diversity were assessed. Three treatments were compared; a control (ME) (no cellulase), 0.1% cellulase (CA) and 0.3% cellulase (CB). All silages were ensiled for 60 days in airtight containers. Chemical composition and fermentation quality were measured over a 30 day period. Microbial community diversity was analyzed using Miseq high-throughput sequencing technologies. The results showed that neutral detergent fiber (NDF), acid detergent fiber (ADF) and cellulose (CL) in groups CA and CB were significantly lower than ME after 30 days ( P<0.05); pH and ammonia nitrogen to total nitrogen ratio (AN/TN) were also significantly lower than ME after 30 days ( P<0.05). Lactic acid (LA) and water soluble carbohydrates (WSC) were significantly higher than the ME treatment ( P<0.05). Lactic acid to acetic acid ratio’s (LA/AA) were greater than 3 and LA to total organic acid ratio’s (LA/TOA) were greater than 0.6 for all treatments after 60 days, but fermentation intensity was highest in the CB treatment. The microbial community diversity results showed that Firmicutes and Proteobacteria were dominant at the phylum level, the dominant microflora at the genus level were Paralactobacillus, Lactobacillus and Enterobacter. Over time, the abundance of Enterobacter gradually decreased and the abundance of Paralactobacillus and Lactobacillus increased, which indicated that the addition of cellulase improved the abundance of lactic acid bacteria and reduced the abundance of spoilage bacteria. It was concluded that low cellulase (0.1%) was the most appropriate application rate; it was conducive to the preservation of hemicellulose (HC), CL and WSC and improved fermentation quality.
作物秸秆是常用的饲草和能源作物, 但由于我国农村耕作条件和习惯等因素, 秸秆多数在萎蔫干黄后才收获, 导致水分和糖分等养分大量流失, 甚至高度纤维化, 直接贮存不利于后期动物消化和能源转化。以青贮为代表的湿法贮存技术为干黄秸秆贮存提供了思路, 诸多学者将干秸秆与花椰菜[1]、马铃薯渣[2]、玉米粉浆[3]等物料混合贮存并获得良好品质, 减少了有机营养物质损失; 但由于干秸秆自身营养物质所限, 与其混合的原料必须满足高水分(65%~75%)、高糖分等特点, 造成干秸秆贮存的局限性。本课题组前期也发现干秸秆与白菜、莴笋叶等尾菜能混贮50~60 d, 但为了更好地保存营养物质, 混贮品质仍需进一步改善[4, 5]。
研究表明, 青贮过程中加入适宜添加剂能提高贮存品质并延长贮存周期。纤维素酶是常用的青贮添加剂, 能将植物细胞壁成分降解为可溶性糖, 为乳酸菌发酵提供碳源, 有效改善贮存品质。陶莲等[6]认为添加纤维素酶能提高华北驼绒藜(Ceratoides arborescens)青贮料的乳酸含量, 降低pH值、氨态氮和丁酸含量, 改善发酵品质。陈鑫珠等[7]认为纤维素酶能显著降低象草(Pennisetum purpureum)和甜玉米(Zea mays)秸秆混贮料的中性洗涤纤维含量, 提高乳酸含量。赵政等[8]发现玉米秸秆青贮中添加0.3%纤维素酶的贮存效果最佳, 腐败率低于1.4%, 有效降低了青贮腐败率, 提高了营养价值。Selmer-olsen[9]报道用纤维素酶处理的梯牧草(Phleum pratense)、牛毛草(Eleocharis yokoscensis)和红三叶草(Trifolium pratense)混合青贮, 显著降低了青贮pH, 增加了乳酸及水溶性碳水化合物含量, 明显改善了青贮品质。然而, 尚未见有关纤维素酶应用于秸秆/白菜混合贮存过程的文献报道。
青贮品质的优劣归根结底是微生物菌群代谢共同作用的结果。青贮中微生物多样性的研究方法主要有16S rRNA鉴定、PCR-DGGE 技术及高通量测序技术等, 其中高通量测序技术准确性高、灵敏度高、成本低, 能更全面、准确描述微生物群落信息[10], 但高通量测序技术用于青贮中微生物菌群研究的文献报道还不多, 仅有少数学者进行了报道。Li等[11]利用MiSeqPE 300平台发现加入微藻会影响五节芒青贮过程中的微生物菌群, 优势乳酸菌由原先Enterococcus变为Lactobacillus, Enterococcus和Lactococcus的丰度也分别从10.08%和57.00%下降至2.30%和0.79%。陶莲等[12]用Miseq测序技术分析了青贮前后玉米秸秆的菌群结构变化, 发现青贮后饲料的发酵品质良好, 其中厚壁菌门(Firmicutes)、片球菌属(Pediococcus)和乳杆菌属(Lactobacillus)的菌群丰度显著增加(P< 0.05)。而有关高通量测序用于秸秆与白菜废弃物混贮过程中的微生物菌群分析尚未见报道。
为进一步改善干玉米秸秆和废弃白菜的混合贮存品质, 拟从感官品质、化学组分和发酵品质等方面研究添加不同剂量纤维素酶对二者混贮品质影响, 并通过高通量测序考察贮存过程中的微生物多样性, 尤其是乳酸细菌类群的变化情况, 筛选适宜的纤维素酶添加量, 以期为干玉米秸秆与白菜混贮模式的技术推广提供借鉴。
干玉米秸秆(dry corn straw, DCS)取自甘肃省定西市陇西县, 摘穗并在田间留置一段时间后收集、粉碎至1~2 cm, 含水量为10.23%; 白菜废弃物(cabbage waste, CW)收集自兰州市七里河区职工菜市场, 含水量为91.41%, 切成2 cm× 2 cm备用。
纤维素酶(酶活力为10万U· g-1)购自宁夏和氏璧生物技术有限公司。
DNA试剂盒采用Water DNA Isolation Kit, 购自成都福际生物技术有限公司。
| 表1 干玉米秸秆和废弃白菜的化学成分 Table 1 Chemical compositions of dry corn straw (DCS) and cabbage waste (CW) |
纤维测定仪(F800, 山东海能科技有限公司); GC9790II气相色谱仪(浙江福立分析仪器有限公司); 紫外分光光度计(752N, 上海仪电分析仪器有限公司); 电泳仪(DYY-11, 北京市六一仪器厂); PCR仪(MG96+, 杭州朗基科学仪器有限公司); 微型台式高速离心机(TG16-W, 湖南湘仪离心机仪器有限公司)。
根据课题组前期试验基础[4], 准确称取3.23 kg干玉米秸秆和9.87 kg废弃白菜, 充分混匀后均匀喷洒事先配制好的纤维素酶液, 对照组喷洒相同体积的蒸馏水, 使贮存体系中含水量为73%。试验设置低剂量CA组(酶添加量0.1%)、高剂量CB组(酶添加量0.3%)和无酶添加的对照组(ME组)3个处理组, 每个处理组3个平行, 17 ℃恒温密封贮存于红泥青贮袋中, 连续贮存60 d(2015年1-3月), 间隔30 d进行感官评定、化学组分、发酵品质和细菌多样性分析。
准确称取2份有代表性的混贮料200 g, 其中1份取20 g按1∶ 9加蒸馏水打浆, 依次通过4层纱布和定性滤纸过滤, 3900 r· min-1离心10 min, 所得浸提液测定pH值后-20 ℃冷冻保存, 用于乳酸、乙酸、丙酸等有机酸和氨态氮的测定。另一份样品用于木质纤维等有机组分分析。
1.5.1 感官评价 现场感官评价参照德国农业协会评分法, 优良(1级)为15~20分, 尚好(2级)为10~15分, 中等(3级)为4~10分, 腐败(4级)为0~4分[13]。
1.5.2 化学成分分析 干物质含量(DM)采用105 ℃烘干法。中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)和酸性洗涤木质素(ADL)测定采用纤维测定仪[4]。纤维素(CL)、半纤维素(HC)和综纤维素(holocellulose, HoC)含量通过公式计算获得, CL=ADF-ADL, HC=NDF-ADF, HoC=CL+HC。可溶性碳水化合物(WSC)测定采用蒽酮硫酸比色法[4]。
1.5.3 发酵品质分析 pH值测定采用PHS-3D型pH计。氨态氮(ammonia nitrogen, NH3-N)测定采用苯酚-次氯酸钠比色法。乳酸含量测定采用山东省科学院SBA-40X生物传感器。乙酸、丙酸及丁酸等挥发酸含量测定采用气相色谱法, 进样口温度200 ℃, 载气为高纯氮气(99.999%), 不分流进样, 升温程序:40 ℃保持2 min, 以2 ℃· min-1升至100 ℃后保持5 min, 再以10 ℃· min-1升至200 ℃, 保持5 min。总有机酸包括乳酸、乙酸、丙酸和丁酸等。发酵品质采用V-score评分法, 满分为100分, 80分以上为良好, 60~80分为尚可, 60分以下为不良[13]。
1.5.4 细菌多样性分析 无菌环境下称取60 g贮存样品均分成3份, 分别加200 mL无菌生理盐水混合, 37 ℃振荡2 h得到菌悬液, 用直径47 mm、孔径0.22 μ m无菌滤膜过滤获得微生物菌体。再用无菌手术剪剪碎整张滤膜, 置于2 mL无菌离心管中, 然后按照Water DNA试剂盒说明步骤提取微生物DNA, 经2%琼脂糖凝胶电泳检测合格后送上海派森诺生物公司Illumina MiSeq平台进行测序。选取相对丰度高于0.1%细菌类群进行门水平和属水平的微生物菌群分析, 并深度分析优势乳酸细菌的多样性。
用Excel 2007软件处理基础数据, 用SPSS 18.0对试验结果进行数据统计分析, 各处理数据间用Duncan法进行多重比较。
2.1.1 纤维素酶对木质纤维组分的影响 由表2可知, 随着贮存时间延长, ME组中CL、HoC及NDF含量均呈上升趋势, CA和CB组中ADF、NDF及ADL则呈下降趋势, HC含量呈上升趋势。30 d和60 d时, 添加纤维素酶的CA和CB组中CL、ADF及NDF含量均显著低于ME组(P< 0.05); 30 d时CA和CB组中的HC、ADL含量与ME组差异不显著(P> 0.05), 且HoC含量显著低于ME组(P< 0.05); 60 d时CA组中ADL含量显著低于ME和CB组(P< 0.05), CB组中HoC含量显著低于ME和CA组(P< 0.05)。
| 表2 混贮过程中木质纤维组分的变化 Table 2 Changes of chemical composition during silage (% DM) |
2.1.2 纤维素酶对碳水化合物(WSC)和粗蛋白(CP)的影响 由表3可知, 随着时间延长, 3个处理组中CP含量呈快速下降趋势, 蛋白组分损失严重; 贮存30 d时3个处理组之间CP含量差异不显著(P> 0.05), 60 d时CA和CB组显著高于ME组, 但CA和CB组之间差异不显著(P> 0.05)。另一方面, 3个处理组中WSC含量随贮存时间的延长而呈显著下降趋势。30 d时CA和CB组中WSC含量显著高于ME组(P< 0.05), 且CB组最高; 60 d时CA组的WSC含量显著高于ME组(P< 0.05), 但CB组分别与ME、CA组之间差异不显著(P> 0.05)。
| 表3 混贮过程中WSC和CP组分的变化 Table 3 Changes of WSC and CP during silage |
由表4可知, 与ME组相比, CA和CB组pH值下降速度明显提升, 其中高剂量CB组pH下降速度最快, 且CA和CB组在贮存期间的pH始终介于3.90~4.10; 30 d时CA和CB组的pH值差异显著(P< 0.05), 但60 d时差异不显著(P> 0.05)。试验中30 d时高剂量CB组中LA含量显著高于ME组(P< 0.05), 60 d时无论纤维素酶剂量高低均能促进LA含量显著增加(P< 0.05)。AA含量亦随时间延长而显著提高, 60 d时CB组AA含量显著低于ME和CA组(P< 0.05)。3个处理组中PPA和BA含量均处于较低值, 尤其BA含量远低于优良青贮推荐值1%。CA组中EA含量随贮存时间延长呈显著增加趋势(P< 0.05), ME和CB组则变化不显著(P> 0.05); 30 d时CA组与CB组中EA含量显著低于ME组(P< 0.05), 60 d时差异不显著(P> 0.05)。另外, 3个处理组中LA/AA值均高于3, LA/TOA值也均在0.7以上, 其中CB组的LA/AA和LA/TOA均为最高值, 说明纤维素酶的添加有助于强化乳酸发酵强度, 且高剂量更有利于促进乳酸发酵。CA和CB组均显著降低了AN/TN值, 且二者之间差异不显著(P> 0.05), 说明纤维素酶的添加减少了蛋白质损失。
| 表4 混贮过程中有机酸的变化 Table 4 Changes of organic acids during silage |
2.3.1 门分类水平细菌群落组成 如图 1 所示, 原料DCS中主要包括厚壁菌门(Firmicutes)和变形菌门(Proteobacteria), 相对丰度分别为33.78%和65.26%; 少量的放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)相对丰度均低于1.00%。原料CW中Proteobacteria和Bacteroidetes是主要类群, 相对丰度分别为80.23%和18.57%; Firmicutes和Proteobacteria丰度都低于1.00%。DCS和CW混贮30和60 d时, ME组主要包括Firmicutes和Proteobacteria, 且Firmicutes丰度逐渐提高, Proteobacteria丰度逐渐下降; 30 d时相对丰度分别为51.10%和48.30%, 60 d时分别为56.60%和40.40%; 此外还含有少量Actinobacteria和Bacteroidetes, 但二者丰度之和仍低于1.00%。添加纤维素酶混贮后, CA和CB组也主要包含Firmicutes和Proteobacteria, 且变化趋势与ME组相同, 前者丰度逐渐增加, 后者丰度则逐渐下降。除此之外, CA和CB组中的Actinobacteria和Bacteroidetes丰度也有所增加, 但贮存过程中二者丰度之和仍低于5.00%。
2.3.2 属分类水平细菌群落组成 由图2可知, 原料DCS中含有肉食杆菌属(Carnobacterium)和肠球菌属(Enterococcus)等乳酸菌, 相对丰度分别为27.71%和0.94%, 同时附着有大量鞘氨醇单胞菌属(Sphingomonas)、肠杆菌属(Enterobacter)、泛生菌属(Pantoea)、假单胞菌属(Pseudomonas)和金黄杆菌属(Chryseobacterium)等非乳酸细菌, 其中Enterobacter和Pantoea丰度较高, 分别为47.11%和10.14%; 原料CW附着的乳酸细菌含量极低, 相对丰度仅为0.90%, 但存在大量腐败细菌, 尤其Pantoea、Pseudomonas和Chryseobacterium等丰度较高, 分别为17.10%、48.40%和16.26%, 此外也有少量Enterobacter等, 可见CW若不及时处理极易腐败变质。
DCS与CW混贮后, ME组中乳酸细菌主要包括肉食杆菌属(Carnobacterium)、类乳杆菌属(Paralactobacillus)、乳杆菌属(Lactobacillus)、片球菌属(Pediococcus)和乳球菌属(Lactococcus), 其中Paralactobacillus和Lactobacillus相对丰度较高, 30 d分别为22.90%和20.70%, 60 d时为15.40%和35.40%, 前者随时间延长丰度下降, 后者则升高。ME组中非乳酸细菌主要为Enterobacter, 且丰度从30 d时的44.90%下降为60 d时的36.00%, 除沙雷士菌属(Serratia)相对丰度为1.40%外, 其余Sphingomonas、Pseudomonas及Chryseobacterium等非乳酸细菌属的丰度均在1.00%以下。
加入纤维素酶混贮后, CA、CB组中肠杆菌属(Enterobacter)、乳杆菌属(Lactobacillus)和类乳杆菌属(Paralactobacillus)等细菌的相对丰度较高, 30 d时这3类细菌在CA组中的丰度依次为38.80%、18.10%和20.90%, 60 d时依次为27.40%、33.70%和18.70%; CB组30 d时丰度依次为35.80%、37.10%和13.20%, 60 d时依次为32.20%、40.80%和13.80%。另一方面, 30 d时ME、CA和CB组总乳酸细菌丰度分别为49.00%、44.40%和52.80%, 与ME组相比, CB组的总乳酸细菌丰度提高, 但CA组下降; CA和CB组还新增了片球菌属(Pediococcus)、寡养食单胞菌(Stenotrophomonas)、鞘脂杆菌科(Sphingobacteriaceae)、鞘氨醇单胞菌属(Sphingomonas)和农杆菌属(Agrobacterium), 但其相对丰度均低于5.00%。60 d时, CA和CB组总乳酸细菌丰度均高于ME组, 且CB组丰度最高, 达58.90%; Enterobacter相对丰度明显下降, 且CA组由30 d的38.80%降至60 d的27.40%, 下降较快; CB组由30 d时的35.10%降至60 d时的32.20%, 均低于ME组腐败菌的相对丰度(30 d时的44.90%和60 d时的36.00%)。总之, 添加纤维素酶明显降低了Enterobacter的相对丰度, 提高了乳酸细菌相对丰度, 且CB组始终高于CA组, 说明高剂量纤维素酶更有利于提升乳酸菌相对丰度。
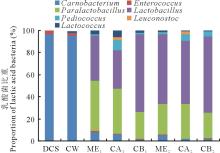
2.3.3 乳酸细菌的多样性分析 乳酸细菌是青贮
发酵过程中的优势菌, 对贮存品质优劣起重要作用, 因此有必要了解乳酸菌属的多样性。由图3可知, DCS和CW中乳酸菌主要为肉食杆菌属(Carnobacterium), 所占比例分别为96.50%和95.56%, 还含有少量肠球菌属(Enterococcus)和乳球菌属(Lactococcus), 但由于CW自身附着的乳酸细菌丰度不足1.00%, 故混贮原料附着的乳酸菌主要来自DCS。3个处理组在30和60 d时主要包含Carnobacterium、Enterococcus、类乳杆菌属(Paralactobacillus)、乳杆菌属(Lactobacillus)、片球菌属(Pediococcus)、明串珠菌属(Leuconostoc)和Lactococcus等乳酸菌。其中, Paralactobacillus和Lactobacillus在乳酸细菌中所占比重较高, 30 d时二者在CA组中占乳酸细菌的比重分别为40.66%和35.21%, CB组中所占比重分别为24.44%和70.30%; 60 d时二者在CA组中占乳酸细菌的比重分别为31.64%和57.02%, CB组中所占比重分别为23.27%和68.80%。另一方面, 随着时间的延长, CA组中Lactobacillus比重逐渐提高, Paralactobacillus比重逐渐下降, 而CB组中Lactobacillus和Paralactobacillus略有降低, 但其Lactobacillus的比重仍高于ME和CA组。
原料DCS与CW混合后的水分和WSC含量能达到青贮要求, 二者混贮有利于乳酸发酵和pH的快速下降, 从而减少原料中的养分损失。加入纤维素酶的CA和CB组中WSC含量损失更少, 原因是纤维素酶能分解原料中NDF和ADF等纤维组分为乳酸菌可利用的单糖, 降低原料中CL含量的同时增加发酵底物量, 促进乳酸菌等有益菌发酵繁殖。表2中NDF和ADF含量的变化也说明了这一点。庄苏等[14]认为纤维素酶处理显著降低了青贮料中NDF和ADF含量, 并显著增加WSC含量。薛艳林[15]认为青贮发酵过程中的微生物和酶类物质能降解半纤维素为微生物可直接利用的WSC, 经青贮发酵后的NDF含量显著降低。倪奎奎等[16]认为纤维素酶的添加显著降低了麦秸青贮料的NDF和ADF含量。Amvan等[17]也认为添加纤维素酶能使青贮牧草的NDF和ADF含量显著降低。另一方面, 纤维素酶的加入促进了ADL的分解, 弱化了其对纤维素等结构性碳水化合物的束缚, 有利于提高混贮料在动物瘤胃中的生物降解效率或能源转化效率。王晓娟等[18]认为ADL对CL和HC等碳水化合物既有物理性阻碍, 又有牢固共价键束缚, 使其对酶或微生物作用有屏障保护。总之, 加入纤维素酶有利于保存WSC、HC和HoC等组分, 显著降低NDF、ADF等组分含量, 这与Sun等[19]研究结果一致。
混贮过程中快速生成乳酸和pH迅速下降是青贮成功并获得高品质青贮料的关键因素。青贮发酵过程中除生成较高含量的乳酸外, 还会生成乙酸、丙酸和丁酸等小分子有机酸, 但pH下降主要缘于乳酸的累积。一般认为, 发酵良好的青贮料中, 乳酸含量应占到总有机酸的60%以上, 乙酸含量占1%~4%, 丙酸含量占1.5%左右, 丁酸含量则接近于0, 乳酸/乙酸(LA/AA)值应高于2∶ 1[20]。试验中, 3个处理组均符合上述良好青贮条件, 但与无添加剂ME组相比, CA和CB组pH值下降速度明显加快, 且高剂量CB组LA/AA和乳酸占总有机酸比例(LA/TOA)均明显高于CA和ME组, 说明高剂量纤维素酶的添加有利于强化乳酸发酵, 提高乳酸生成比重, 这与高剂量纤维素酶能有效提升乳酸菌相对丰度结果一致。Selmer-olsen[9]认为用纤维素酶处理的梯牧草、牛毛草和红三叶草混合青贮, 显著降低了青贮pH, 增加了乳酸含量。Tengerdy等[22]研究也发现纤维素酶的添加能显著降低青贮料的pH值, 增加乳酸和WSC含量, 本研究结论与其一致。另有报道认为, 当青贮料中乳酸/乙酸高于3时, 一般是同型发酵乳酸菌占主导地位[23]。推测试验中3个处理组可能均为同型乳酸发酵。
氨态氮主要是微生物或酶分解蛋白质、氨基酸和含氮物质所生成, AN/TN值越大, 说明蛋白质分解程度越高, 青贮质量越差。试验中加入纤维素酶后, CA和CB组均使AN/TN值显著降低(P< 0.05), 且远低于优质青贮料的推荐值10%, 说明纤维素酶的添加有助于减少蛋白质损失。Dean等[24]也认为青贮料中添加纤维素酶能够获得较低的pH和NH3-N含量, 从而提高青贮品质。但从粗蛋白角度分析, 贮存30 d时3个处理组中粗蛋白含量均显著下降, 且含量不足1%, 原因可能是因为原料中粗蛋白在植物蛋白酶与微生物的共同作用下先分解为肽氮和游离氨基酸氮, 其中一小部分氨基酸进一步被降解成氨、有机酸及生物胺等产物。尤其贮存体系pH值低于4.2时蛋白质一般分解为较稳定的氨基酸[25], 并不会继续降解为氨等产物, 所以出现了CP含量很少而AN/TN值不高的状态, 推测试验中蛋白质主要分解为肽或者氨基酸产物。
另外, 贮存60 d期间3个处理组的感官品质均为优等, 但V-score评分结果却为尚可。出现这种差异的原因可能是感官评定存在一定的主观性, 个人评价之间存在差异, 而V-score评分则根据氨态氮含量以及乙酸、丙酸、丁酸等挥发酸含量来确定发酵品质, 较为客观。Filya[26]认为优质青贮料应具有较高含量的乳酸和较低的丁酸、氨态氮含量及pH值, 试验中3个处理组均符合优质青贮标准, 且CA和CB组品质更好。总之, 纤维素酶的加入改善了秸秆与白菜的混贮发酵品质, 有利于乳酸生成, 降低pH和NH3-N含量, 高剂量纤维素酶(0.3%)对混贮发酵品质的促进效果更明显。
贮存过程中感官品质、化学组分及发酵品质的变化本质上是微生物菌群共同作用的结果。从门水平细菌群落分析, 原料DCS主要包含Proteobacteria和Firmicutes, CW主要包含Proteobacteria和Bacteroidetes, 混合贮存60 d期间始终以Proteobacteria和Firmicutes为主。加入纤维素酶后, 无论剂量高低, 仍以Proteobacteria和Firmicutes为主, 但高剂量纤维素酶CB组的Firmicutes丰度明显提高, 而Proteobacteria丰度在CA和CB组则明显下降。据报道, 芽孢杆菌能降解大分子化合物, 如纤维素、淀粉、蛋白质等有机组分[12], 而Firmicutes细菌可产芽孢, 所以推测加入纤维素酶的CA和CB组ADF、NDF及CP含量的显著降低也可能是由Firmicutes引起的。
从属水平细菌群落可知, CW中乳酸细菌含量不足1%, DCS中有约28%左右的乳酸细菌, 二者混贮具有乳酸细菌互补性, 能使混贮发酵过程快速启动, 并抑制腐败菌生长。试验中ME组包括Enterobacter、Lactobacillus、Paralactobacillus、Pediococcus、Lactococcus、Carnobacterium和Serratia等近30个属, 细菌丰富程度较高, 与其他学者报道结果有一致也有差异。Duniè re等[27]发现玉米青贮中主要细菌包括Paenibacillus、Flavobacteriaceae、Sphingomonas、Exiguobacterium、root nodule bacteria、Acinetobacter和Buchnera等。刘晶晶等[28]发现青贮柳枝稷中主要包括Lactobacillus、Enterobacter、Enterococcus、Clostridium、Aerococcus、Sporolactobacillus、Lachnospira、Ruminococcaceae、Weissella、Pantoea和Serratia等。加入纤维素酶后, CA和CB组主要的属水平细菌与ME组基本一致, 但加入纤维素酶后乳酸菌属的相对丰度大大提高, 并使有害菌Enterobacter丰度明显降低, 尤其高剂量纤维素酶使CB组乳酸细菌丰度高达55.70%。正是这些乳酸细菌的快速繁殖和主要代谢物乳酸的积累使贮存过程pH快速下降, 从而抑制腐败细菌, 促进了有机组分的保存, 这与发酵品质、化学组分变化结果一致。
乳酸菌是影响青贮品质好坏的主要有益微生物。Cai等[21]发现从青贮水稻中分离得到161株乳酸菌包含Lactococcus、Lactobacillus、Leuconostoc、Enterococcus和Pediococcus, 这些菌株主要为同型发酵乳酸菌, 占总数的66.00%。乳酸菌多样性结果显示, 原料中乳酸菌主要为Carnobacterium, 但DCS和CW混贮后的Carnobacterium所占的比例不足10%, 逐渐演变成Paralactobacillus和Lactobacillus为主要乳酸细菌。加入纤维素酶后, CA和CB组中仍以Paralactobacillus和Lactobacillus为主, 且CA组的Paralactobacillus始终高于CB组, 而CB组Lactobacillus始终高于CA组, 这可能是纤维素酶添加剂量高低所致, 但总体上贮存期间均以耐酸性能较好的杆菌为主。
加入纤维素酶有效促进了干玉米秸秆与白菜废弃物的混贮发酵和乳酸生成, 使pH值快速下降, 从而抑制有害菌生长。低剂量纤维素酶有利于ADL组分的降解以及WSC、HC和HoC等组分的保存, 高剂量纤维素酶有助于改善发酵品质, 但综合考虑有机组分保存和酶制剂成本等因素, 建议选择低剂量纤维素酶(0.1%)。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|